三种猴头菇口服液对大鼠胃黏膜损伤的保护作用研究
,*
(1.广东轻工职业技术学院食品生物与技术学院,广东广州 510300;2.华南理工大学食品科学与工程学院,广东广州 510641;3.广东太阳神集团有限公司,广东广州 510665)
猴头菇亦称猴头菌(Hericiumerinaceus(Rull ex F.)Pers.),是一种外形独特、营养丰富且功效多样的食用菌资源,是我国珍贵的药食兼用真菌,又称猴头菌、猴头、猴菇、猴蘑[1-3]。猴头菇的主要活性成分包括多糖、寡糖、甾醇类、萜类和酚类等,我国传统医学认为其性平、味甘、益五脏,具有助消化的作用,现代医学还发现其具有提高免疫力、抗肿瘤、抗衰老、降血脂等多种保健功能[5-6]。
近些年来,现代食药工业为猴头菇的产品化注入了新的活力,例如猴菇米稀、猴菇酥性饼干、猴头健胃灵胶囊、猴头菇胃肠保健口服液、猴头菇口服液以及猴菇饮等[7]。其中,猴头菇口服液产品的生产由来已久,而且受众广泛且不断推陈出新。口服液产品的主要功效包括养胃和中以及辅助保护胃黏膜[8-9],其主要活性成分猴头菇多糖的生物活性、入药机理及潜在的应用途径也被进行了大量研究[10-12]。但是,关于猴头菇口服液产品之间的功效比较方面研究却鲜有报道。
本研究以猴头菇口服液为研究对象,基于大鼠胃黏膜损伤模型评估三种猴头菇口服液对胃黏膜损伤的保护作用,并对损伤指标的差异进行全面系统的阐述。以期为消费者在此类产品的功效筛选方面提供理论依据,又为科研人员在构建大鼠胃黏膜损伤模型方面提供技术参考。
1 材料与方法
1.1 材料与仪器
猴头菇口服液A(产品主要原料为猴头菇,辅料为鸡与蛇,提取工艺为高温水提,多糖含量≥120 mg/100 mL,批号20161021,下文简称口服液A)、猴头菇口服液B(产品主要原料为猴头菇,辅料为鸡,提取工艺为先酶解再高温水提,多糖含量≥200 mg/100 mL,批号20161021,下文简称口服液B) 广东太阳神集团有限公司提供;猴菇饮口服液 湖北东信药业有限公司生产,产品主要原料为猴头菇,国药准字Z42020182,批号151215,下文简称猴菇饮;硫糖铝 上海旭东海普药业有限公司生产,国药准字H10950279,批号KF151007;实验动物 SD大鼠,SPF级,体重200~230 g,中山大学(大学城)实验动物中心,实验动物生产许可证号SCXK(粤)2011-0029;无水乙醇 南京化学试剂股份有限公司;95%乙醇 天津市富宇精细化工有限公司;乙酸(AR级)、氯化钠、NaH2PO4·2H2O 广州化学试剂厂;Na2HPO4·12H2O 甲醛天津市福晨化学试剂厂;中性树胶 广州市秀威贸易有限公司;TO型生物透明剂 广西岑溪市松香厂;苏木素 Fluka上海化学试剂公司;伊红 Ameresco公司。
BS110S电子天平 北京赛多利斯天平有限公司;ACS-1A1型电子计量秤 深圳爱华衡器有限公司;OLYMPUS SZ61型体视显微镜、OLYMPUS CX31型显微镜 日本OLYMPUS公司;MICROM HM450电脑程控式切片机 德国MICROM公司;TB-718生物组织自动包埋机、TC-120组织自动脱水机 孝感市泰维电子公司;BI2000图像处理系统 成都泰盟科技有限公司;DM5000B型正置荧光显微镜 德国LEICA公司;全自动菌落分析仪 杭州讯数科技有限公司。
1.2 实验方法
1.2.1 大鼠急性胃粘膜损伤模型的构建与治疗
1.2.1.1 实验动物分组 选取健康的SD雌性大鼠144只,体重200~230 g,大鼠随机分成12组,每组12只,分别为正常组,乙醇模型组,口服液A低、中、高剂量组,口服液B低、中、高剂量组,猴菇饮低、中、高剂量组以及硫糖铝阳性对照组。
1.2.1.2 给药方案 采用预先给药的方式。正常组、模型组及阳性对照组的每日给药剂量相同,不同的是前两者给予等体积的纯净水,其余组别的给药剂量见表1;全部样品均经口灌胃给药,每日定时给药1次,其中,硫糖铝阳性对照组在造模前一周开始给药(给药1周),余下各组灌胃给药30 d。
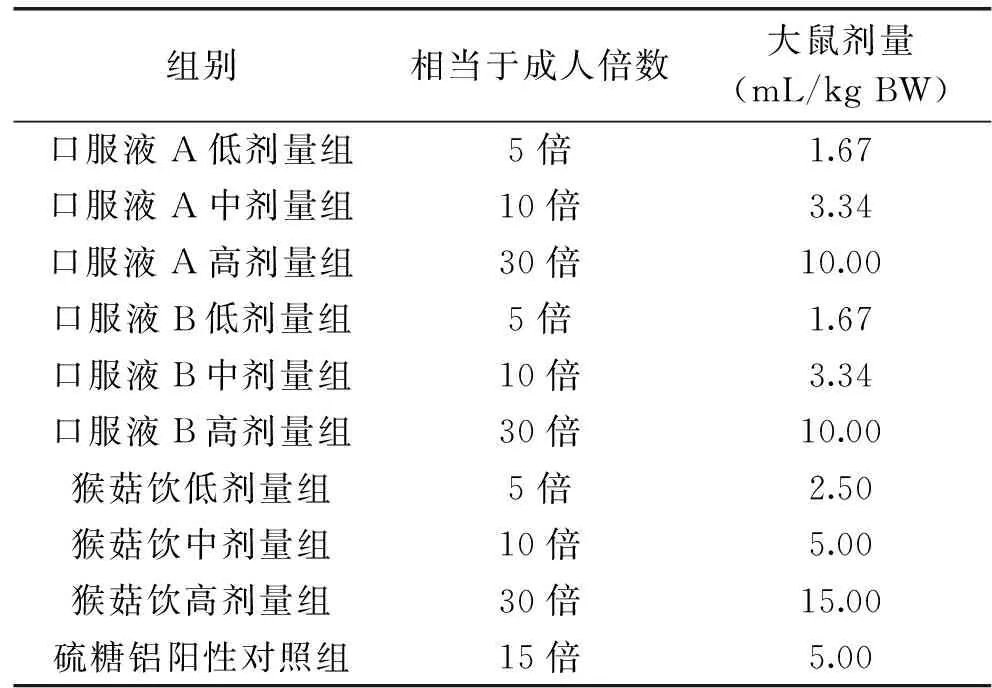
表1 按体重系数等效换算的给药剂量Table 1 Equivalent conversion of the dose according to the body weight coefficient
1.2.1.3 大鼠胃黏膜大体形态观察、组织病理学检查 在各组大鼠给药结束后,将大鼠禁食24 h(不禁水)。除正常对照组外,其余各组大鼠灌胃给予无水乙醇,剂量为1 mL/只。1 h后处死动物,暴露完整胃,结扎幽门,灌注适量10%甲醛溶液,固定20 min,然后沿胃大弯剪开,洗净胃内容物,展开胃粘膜,置于体视显微镜下观察。大体形态观察完毕后,将每只动物胃粘膜损伤最严重的部位切下,固定于10%甲醛溶液,常规制片,苏木素-伊红(hematoxylin-eosin staining,HE)染色,脱水,封片,镜下观察。
1.2.1.4 急性损伤指标测定 胃黏膜急性损伤指标主要包括胃粘膜充血面积、损伤积分指数、损伤发生率、损伤抑制率以及胃黏膜镜下积分[13]。
胃粘膜充血面积=出血带长度×出血带宽度,评分标准见表2;

表2 急性损伤肉眼观察评分标准Table 2 Scoring criteria for visual observation of acute injury
损伤总积分=A+B+C×2
式中,A、B、C分别为出血点分值、出血带长度分值及出血带宽度分值;
损伤积分指数=某组损伤评分总和/该组动物数量;
损伤发生率(%)=某组出现出血充血的大鼠数量/该组大鼠数量×100;
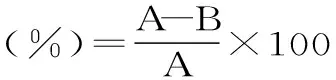
式中,A、B分别为模型组与实验组的损伤积分;
胃黏膜镜下积分:以胃黏膜病变部位为研究对象,选择胃粘膜正横切面,包括粘膜全层的区域观察,评分标准见表3;

表3 急性损伤镜下观察评分标准Table 3 Scoring criteria for microscopic observation of acute injury
病变总积分=A+B×2+C×3
式中,A、B、C分别为充血积分、出血积分及上皮细胞变性坏死积分。
1.2.2 大鼠慢性胃粘膜损伤模型的构建与治疗
1.2.2.1 实验动物分组 选取健康的SD雌性大鼠144只,体重200~230 g,检疫7 d。具体的建模方式如下[14-19]:将全部动物禁食24 h(不禁水),之后用10%水合氯醛麻醉后实施剖腹手术,消毒腹部,于剑突下切开腹腔,将胃轻轻拉出腹腔外,假手术组于胃幽门处浆膜下,采用微量注射器注射50 μL的灭菌生理盐水,其它组别在同一部位局部注射50 μL的60%乙酸溶液,缝合切口。每只大鼠术后肌内注射青霉素2000 U,且连续抗生素处理3 d,直至伤口完全愈合。术后第2 d,将大鼠随机分成12组,每组12只,分别为假手术组,乙酸模型组,口服液A低、中、高剂量组,口服液B低、中、高剂量组,猴菇饮低、中、高剂量组以及硫糖铝阳性对照组。
1.2.2.2 给药方案 假手术组、模型组及阳性对照组的每日给药剂量相同,不同的是前两者给予等体积的纯净水,其余组别的给药剂量同1.2.1.2,全部样品均经口灌胃给药,每日给药1次,连续给药7d。
1.2.2.3 胃黏膜大体形态观察 在各组大鼠给药结束后,将大鼠禁食24 h(不禁水),之后处死动物,取出整个胃浸泡于10%的甲醛内,浸泡20 min后沿胃小弯剪开,洗净内容物,取腺胃区展开平铺于玻璃板上,用纸吸干溃疡内的水分,置于显微镜下观察。
1.2.2.4 慢性溃疡指标测定 胃黏膜慢性损伤在体内表现为溃疡,溃疡指标主要为溃疡面积。将洗净内容物后的不含水分的胃黏膜置于全自动菌落分析仪中观察并对胃溃疡组织进行拍照,利用图像处理系统分析并测量溃疡底部的面积。
1.3 数据处理
实验结果以均值±标准差表示。采用SPSS 21.0软件对数据进行统计学分析,运用student t检验评价显著性水平,P<0.05表示差异显著。
2 结果与分析
2.1 口服液样品对大鼠急性胃粘膜损伤的保护作用
2.1.1 口服液样品对胃黏膜大体形态及病变组织的影响 如图1所示,正常组大鼠胃黏膜红润,无出血点或出血带;模型组胃黏膜局部肿胀,有清晰可辨的出血带,充血严重;阳性组胃黏膜无明显的出血带,局部有轻微的充血现象。此外,在三种口服液处理组中,样品对胃黏膜形态的保护呈现出典型的量效关系,即同模型组比较,随着口服液样品的剂量升高,无水乙醇对大鼠胃黏膜的损伤程度减弱。
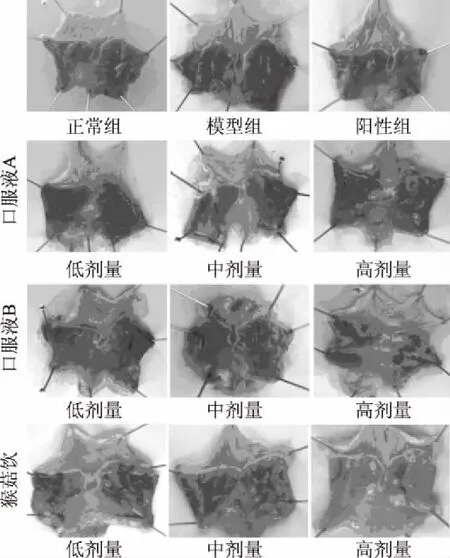
图1 不同组别大鼠的胃黏膜大体形态Fig.1 General morphology of gastric mucosa of rats in different groups
选取大鼠胃黏膜的病变部位,制成组织切片,之后进行HE染色。如图2所示,正常组大鼠胃黏膜细胞紧实、密集,细胞的蓝紫色较深,胃黏膜形态完整、边界清晰;模型组胃黏膜细胞排列松散、碎片化严重,空腔细胞成片聚集,胃黏膜呈现病理性肿胀;阳性组胃黏膜细胞排列较为紧密,局部出现空腔细胞,胃黏膜轻微肿胀且边界清晰。此外,在三种口服液处理组中,样品对胃黏膜病理症状的缓解呈现出典型的量效关系,即同模型组比较,随着口服液样品的剂量升高,无水乙醇对大鼠胃黏膜的病理性损伤减弱。
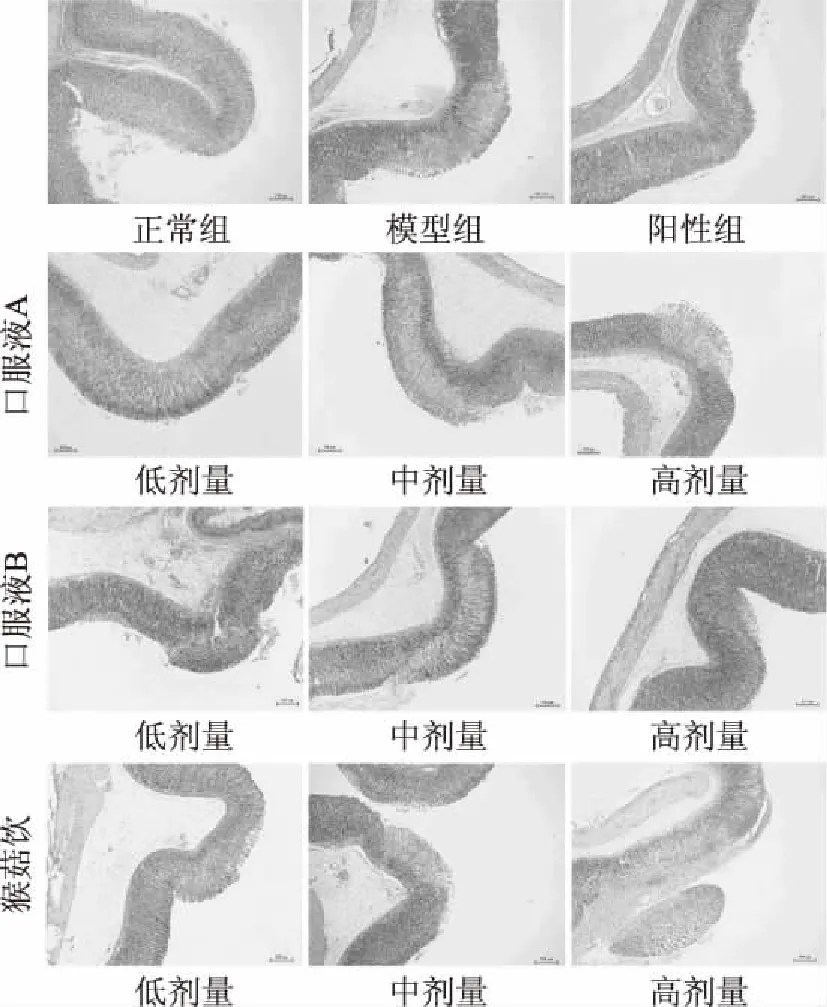
图2 不同组别大鼠胃黏膜HE染色(40×)Fig.2 HE staining pictures of gastric mucosa of rats in different groups(40×)
2.1.2 口服液样品对胃黏膜急性损伤指标的影响 由表4可知,模型组大鼠胃黏膜出血充血严重,并且其胃黏膜充血面积、损伤积分指数及胃黏膜镜下积分等多项损伤指标均偏高;中、高剂量口服液A,高剂量口服液B以及高剂量猴菇饮的损伤积分指数均明显降低,能够不同程度地缓解乙醇诱致的大鼠胃粘膜出血充血程度,与同期乙醇模型组相比,具有显著性差异(相应的P值分别为P<0.05、P<0.01、P<0.001及P<0.01);高剂量口服液A,低、中、高剂量口服液B以及低、中、高剂量猴菇饮的胃粘膜镜下积分明显减少,与同期乙醇模型组相比,具有显著性差异(相应的P值分别为P<0.001、P<0.01、P<0.05、P<0.001、P<0.01、P<0.01及P<0.001);硫糖铝阳性对照组大鼠的胃粘膜出血情况明显减轻,并且其损伤积分指数、胃黏膜镜下积分均明显降低,与同期乙醇模型组相比,具有显著性差异(相应的P值分别为P<0.001及P<0.001)。
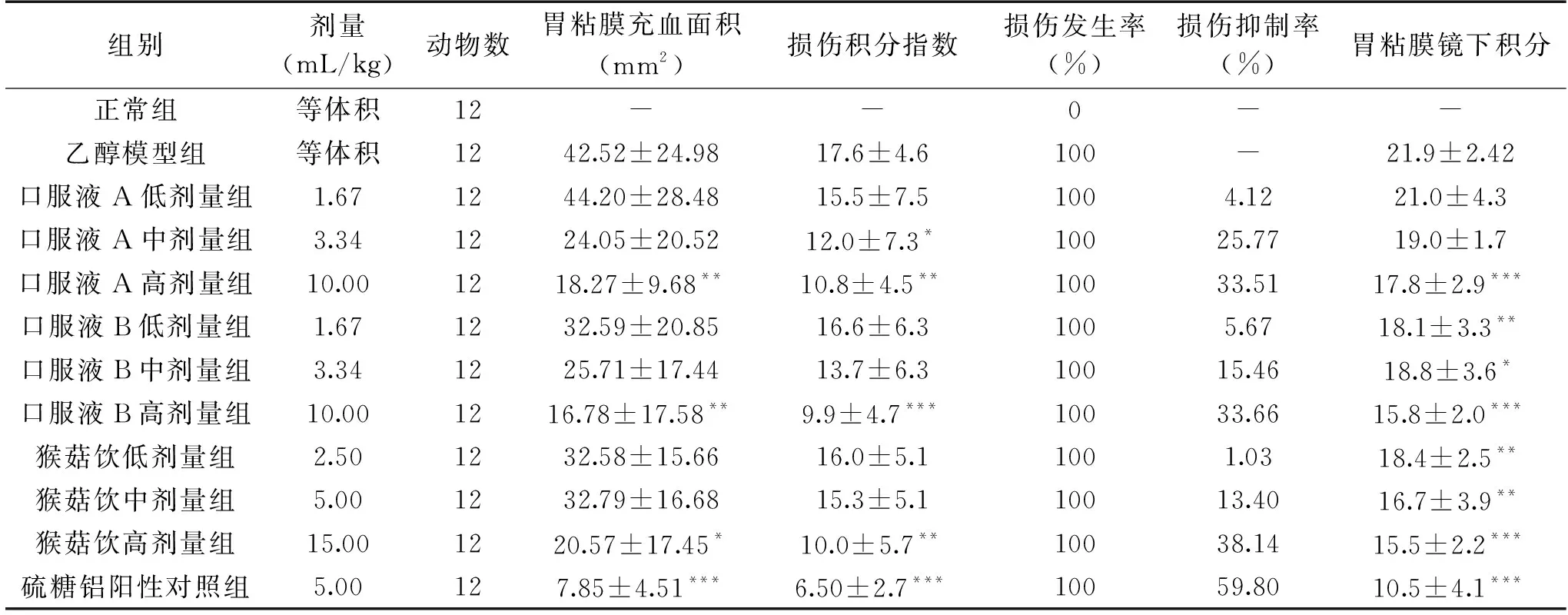
表4 口服液样品对大鼠胃黏膜急性损伤指标的影响Table 4 Effects of oral liquid samples on the indexes of acute injury of gastric mucosa in rats
上述结果表明,三种口服液样品对胃粘膜均具有不同程度的保护作用,这种作用虽然不及临床使用的阳性药物,但却较好地缓解了胃黏膜急性损伤。其中,高剂量口服液B能够极显著地降低胃黏膜损伤积分指数及胃黏膜镜下积分,因此在治疗或保护胃黏膜急性损伤方面,口服液B最佳。
2.2 口服液样品对大鼠慢性胃粘膜损伤的保护作用
2.2.1 口服液样品对胃黏膜大体形态的影响 在慢性损伤试验中,不同样品对大鼠胃黏膜的大体形态的影响如图3所示。假手术组大鼠胃黏膜色泽鲜丽,无淤青无囊肿;模型组的胃黏膜淤青聚集,出现较大面积的囊肿、溃烂;阳性组的胃黏膜色泽微暗,无明显的淤青、囊肿。此外,在三种口服液处理组中,样品对胃黏膜形态的保护呈现出典型的量效关系,即同模型组比较,随着口服液样品的剂量升高,乙酸诱导的大鼠胃黏膜的溃疡程度减弱。
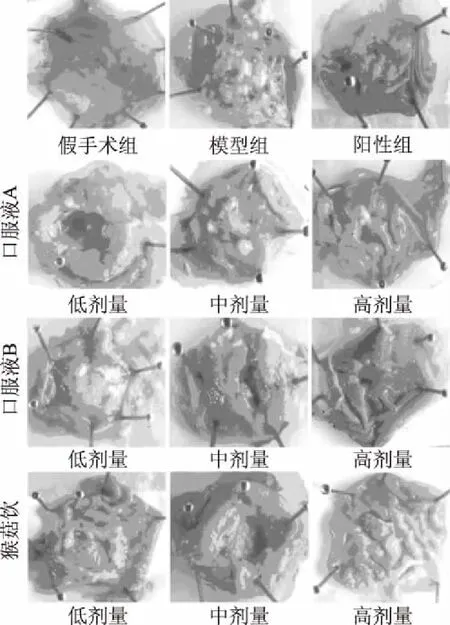
图3 不同组别大鼠的胃黏膜大体形态Fig.3 General morphology of gastric mucosa of rats in different groups
2.2.2 口服液样品对胃黏膜慢性溃疡指标的影响 不同样品对乙酸诱导的大鼠慢性胃粘膜损伤的保护作用主要体现在对慢性溃疡指标的影响,实验数据如表5所示。假手术组大鼠胃粘膜的溃疡面积几乎可以忽略,故在实验中没有计算出溃疡面积;乙酸模型组大鼠的胃浆膜层下注射乙酸溶液后发生明显的溃疡,其溃疡面积明显升高;与同期模型组比较,中、高剂量的口服液A以及高剂量的猴菇饮可以明显减少大鼠的胃溃疡面积,具有显著性差异(相应的P值分别为P<0.01、P<0.001及P<0.05);然而,与同期模型组比较,阳性药物硫糖铝并不能够明显减少大鼠的胃溃疡面积,在数值上无统计学差异。上述结果表明,口服液A在治疗或保护胃黏膜慢性损伤方面具有良好的效果。
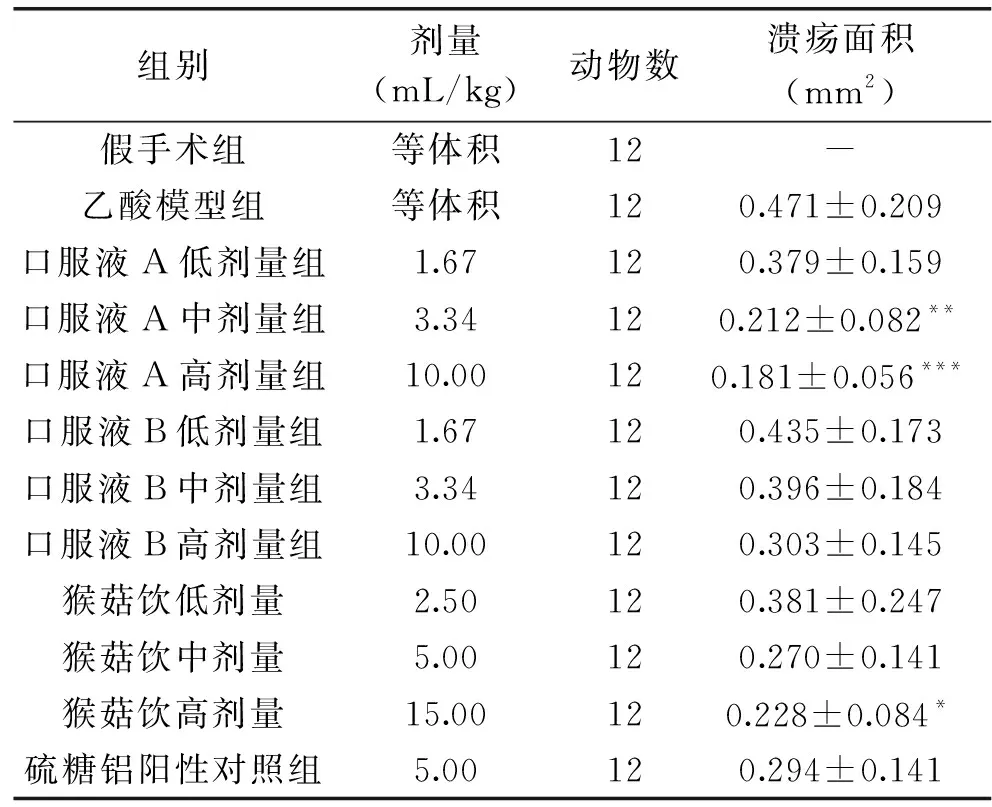
表5 口服液样品对大鼠胃黏膜慢性溃疡指标的影响Table 5 Effects of oral liquid samples on the indexes of chronic ulcer of gastric mucosa in rats
3 讨论与结论
本文研究了三种不同的猴头菇口服液对大鼠胃黏膜损伤的保护功效。在大鼠胃黏膜急性损伤模型中,三种口服液样品能够不同程度地保护胃粘膜,低浓度的三种样品对胃黏膜的保护功效差别不大;然而,高浓度样品的功效差异明显,其中,口服液B的功效最佳,其疗效优于猴菇饮、次于硫糖铝。在大鼠胃黏膜慢性损伤模型中,口服液A的护胃效果较好,能够促进慢性胃溃疡的创伤愈合及修复;猴菇饮的功效次之;口服液B的护胃效果较弱,与同期模型组相比,其仅在胃溃疡面积的平均值方面有减少的趋势,但并无统计学意义上的显著性差异。
文中涉及的动物模型为大鼠胃黏膜损伤模型,其实,关于此类模型的构建并不简单。急性胃粘膜损伤模型的构建在文献中屡有报道[20-22],难度相对较低。而慢性胃黏膜损伤模型的构建涉及动物手术,难度偏大且建模成功率较低;具体来讲,乙酸诱导大鼠慢性胃粘膜损伤的模型成功与否关键在于是否将乙酸溶液完全注射在浆膜层以下[23-24],由于胃壁含有非富的血管,胃组织被乙酸腐蚀后即发生坏死及出血,注射后第二天大鼠出现胃穿孔现象,随着时间的延长,粘膜层开始修复,包围底部形成脊形态,同时胃底部肌层逐渐生长并形成疤痕。本文中测量的胃溃疡面积即是脊(再生粘膜层)的底部,胃溃疡体积为与脊平齐的注入液体的体积。虽然已有报道探究了猴头菇口服液对胃上皮细胞的保护作用[25]以及猴头菇胃肠保健口服液对HAART药物所致胃肠道反应的疗效[26],但是本文的研究内容仍有独特之处,即在既往研究的基础上完善了不同猴头菇口服液产品的护胃功效的评价体系。
综上所述,本文成功构建了大鼠胃黏膜损伤模型并基于此评估了不同的猴头菇口服液的护胃功效,但不同产品功效各异。猴菇饮口服液作为非处方药,效用相对温和一些,对急、慢性胃黏膜损伤都有温和的保护作用;猴头菇口服液B、猴头菇口服液A分别对急性胃黏膜损伤、慢性胃黏膜损伤有良好的保护作用。使上述产品存在差异的原因可能在于产品配方、提取工艺及多糖浓度,本文的研究结果可为开发具有胃黏膜损伤保护作用的功能食品、保健食品及药品提供科学的参考价值。

