L-谷氨酸对樱桃番茄果实病程相关蛋白的影响
杨佳丽,王 乐,相玉婷,王 茜,王 愈
(山西农业大学食品科学与工程学院,山西太谷 030801)
作为呼吸跃变型果实,樱桃番茄(SolanumlycopersicumL.)采后生理品质变化迅速,且因其营养丰富、含水量高,很容易遭受病原菌的侵染[1],尤其是由真菌引起的侵染性病害,是造成其损失的重要因素[2-3]。其中,由腐生型病原菌Alternariaalternata引起的黑斑病是引起番茄果实发生腐烂的重要病害[4]。因长期施用化学杀菌剂会对食品安全和环境带来不容忽视的负面影响,当前利用诱导因子激发植物自身抗性已成为减少或替代化学杀菌剂的有效途径[5-7]。
植物体内存有大量抗逆境的基因或蛋白,当受到外界环境刺激或胁迫时,会诱导启动植物自身抗性相关基因或蛋白的表达,从而使其获得对逆境的抗性[8-9]。已有研究显示,病程相关蛋白(Pathogenesis-related proteins,PRs)是参与植物抗病性的一类重要物质[10]。PRs家族蛋白具有潜在的抑菌作用,直接或者间接的抑制病原菌的生长及传播[11]。如PR2、PR5蛋白具有β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)特性,PR3和PR4蛋白则具有几丁质酶(chitinases,CHI)活性。因葡聚糖和几丁质是病原真菌细胞壁的主要成分,GLU和CHI可通过催化这两种物质的水解或通过释放寡糖诱导植物抗性,有效抑制病原菌的侵染[12]。大量研究报道表明,利用拮抗菌或其它激发子诱导果实产生抗性的同时,GLU和CHI活性也显著提高[13]。PR9蛋白则具有过氧化物酶(peroxidase,POD)活性,在植物体内POD一方面作为活性氧清除剂,与超氧化物歧化酶和过氧化氢酶组成了抗氧化酶保护系统,另一方面,参与合成细胞壁木质素,有效提高病原菌侵染宿主细胞时细胞壁的强度,在植物的防御反应中发挥重要的作用[14]。PR1蛋白一般认为是系统获得性抗性(systemic acquired resistance,SAR)激活的标志蛋白[15]。PRs广泛存在于各类植物中,不仅可由病虫害诱导产生,也可被一些化学物质,如水杨酸、氨基酸衍生物等诱导合成,其在植物体内的积累已被认为是诱导抗性的重要生化机制之一[16]。
L-谷氨酸(以下简称“谷氨酸”)在生物体内氨基酸代谢中具有中心地位,参与合成多种与抗性密切相关的代谢物质,如精氨酸、脯氨酸和γ-氨基丁酸[17]。目前,已有研究报道了谷氨酸在植物响应非生物胁迫时发挥着重要作用,然而有关谷氨酸在参与响应病原菌侵染中的作用鲜有报道[18]。谷氨酸因其安全环保,生产、保存成本低,使用简单等优点,成为一种具有广阔应用前景的理想诱导因子。前期研究发现,谷氨酸作为外源激发子可有效抵御Penicilliumexpansum对梨果实的侵染[19]。为进一步明确谷氨酸对采后果实的抗性调控机制,本试验拟以樱桃番茄为研究对象,探究其对果实病程相关蛋白及其编码基因表达的影响,为开发基于谷氨酸的绿色保鲜剂提供充分的理论基础。
1 材料与方法
1.1 材料与仪器
樱桃番茄 品种为“千禧”(SolanumlycopersicumL. cv. Qianxi),采收于山西太谷当地的温室大棚,挑选无病虫害侵染、无机械损伤、大小统一且均处以红熟阶段的果实;Alternariaalternata(CGMCC3.4578) 中国普通微生物菌种保藏管理中心;L-谷氨酸 分析纯,上海阿拉丁生化科技股份有限公司,调整其溶液pH至7左右;几丁质酶检测试剂盒 南京建成生物工程研究所;Trizlol试剂、PrimescriptTMRT reagent Kit with gDNA Eraser试剂盒、SYBR® Premix Ex TaqTM试剂盒 日本TaKaRa公司。
Spectra max plus 384酶标仪 美国MD公司;NanoDrop l000分光光度计 美国Thermo公司;PTC-225型Thermal Cycler PCR仪 美国Bio-Rad公司;StepOne Real-Time PCR仪 美国ABI公司。
1.2 实验方法
1.2.1 病原菌孢子悬浮液制备 将病原菌A.alternata在PDA培养基上25 ℃条件下培养7~10 d后,将A.alternata孢子用无菌水洗出,而后用血球计数板方法调整孢子悬浮液至所需浓度。
1.2.2 体外实验
1.2.2.1 谷氨酸对A.alternata生长的影响 将定量的A.alternata孢子悬浮液分别与不同浓度的谷氨酸溶液(0、10、100、1000 mg/L)混合1 min后,吸取100 μL混合液涂布在PDA表面,并将其置于25 ℃条件下培养72 h后统计每个平板中的菌落数。每个处理3个重复,每个重复不少于3个平板,统计结果单位用CFU/plate表示。
1.2.2.2 谷氨酸对A.alternata孢子萌发的影响 将谷氨酸溶液加入PDB培养基后使其最终浓度分别达到0、10、100和1000 mg/L,随即接入最终浓度为105spores/mL的A.alternata孢子悬浮液,25 ℃条件下摇床震荡培养24 h后,对至少100个孢子的萌发情况在显微镜下进行统计分析。每个处理3个重复,每个重复不少于3个样品,平均孢子萌发率用%表示。
1.2.3 樱桃番茄果实处理与取样
1.2.3.1 谷氨酸诱导处理时间对樱桃番茄果实黑斑病的影响 在大量预实验和前期研究基础上[19],继续选用下述谷氨酸浓度和诱导时间开展后续试验。将果实浸泡于0.1%次氯酸钠2 min后,用水清洗干净,晾干备用。番茄果实随机分为2组:对照组浸泡于水10 min后取出晾干;谷氨酸处理组浸泡于谷氨酸溶液(100 mg/L)10 min后取出晾干。在25 ℃,相对湿度高于95%条件下分别诱导处理0、12、24和36 h后,在果实表面赤道部位制造1个伤口(直径3 mm,深2 mm),随即接入浓度为104spores/mL的A.alternata孢子悬浮液20 μL。将处理后的果实密封并置于恒温恒湿箱内,定时观察果实的发病情况,每个处理3个平行,每个平行25个果实。
1.2.3.2 取样 为了测定果实的酶活性和基因表达量,将经过上述2个处理(对照组和谷氨酸处理组)的番茄置于恒温恒湿条件下(25 ℃,相对湿度高于95%),分别于0、12、24、36和48 h切取果实表皮组织并立即用液氮冷冻,置于-80 ℃下保存备用。
1.2.4 指标测定
1.2.4.1 孢子萌发率的测定

1.2.4.2 果实发病率的测定

1.2.4.3 病程相关蛋白编码基因表达丰度的测定 果实组织总RNA提取参照Luan等[20]的Trizol方法。通过PrimescriptTMRT reagent Kit with gDNA Eraser试剂盒合成cDNA后,参照SYBR® Premix Ex TaqTM试剂盒说明,利用实时荧光定量PCR(RT-qPCR)方法测定病程相关蛋白编码基因的表达量。目的基因引物设计利用Primer Premier 7.0软件(PREMIER Biosoft International)进行,具体引物序列如表1所示,以LeActin为内参基因。基因的相对定量利用2-ΔΔCt方法计算[21]。当处理组目的基因转录水平为对照组的2倍及以上时,表示该基因上调表达;当处理组基因表达量为对照组的0.5倍以下时,则认为该基因下调表达。
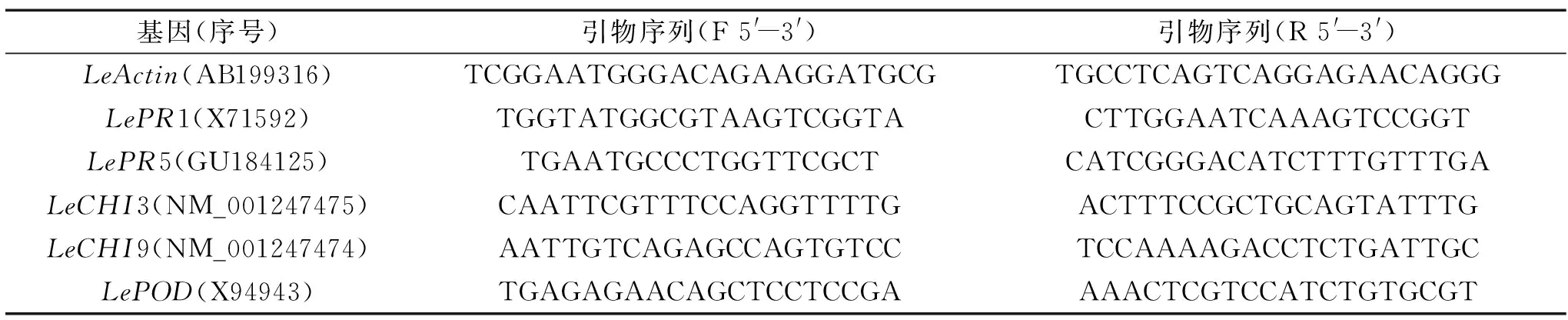
表1 病程相关蛋白编码基因引物序列Table 1 Primer sequences of PR genes
1.2.4.4 酶活性测定β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)活性测定参照Zheng等[22]的方法,几丁质酶(chitinases,CHI)活性利用南京建成生物工程研究所试剂盒测定,过氧化物酶(peroxidase,POD)活力依据Lurie等[23]的愈创木酚法测定。按照Bradford[24]方法检测组织中蛋白质的含量。果实组织酶活性以每毫克蛋白中的酶活力表示,单位为U/mg。
1.3 数据处理
整个实验至少重复2次,直到2次实验结果保持一致。实验数据利用SPSS/PC ver. II.x软件进行邓肯氏(Duncan’s)差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 谷氨酸对病原菌A. alternata体外生长的影响
为进一步明确谷氨酸对病原菌的作用,研究了在体外条件下不同浓度谷氨酸对A.alternata生长的影响。结果如表2所示,在PDA培养基上,谷氨酸对病原菌的存活菌落数没有产生明显的影响;同时,在PDB培养条件下,各个浓度的谷氨酸对病原菌的孢子萌发也无显著抑制效果。显然,在本次试验条件下,谷氨酸不会对病原菌A.alternata产生直接的抑制作用。
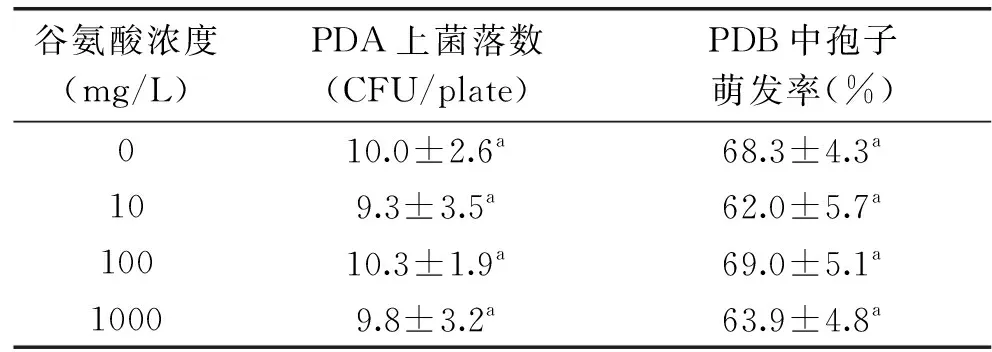
表2 谷氨酸对病原菌A. alternata在PDA和PDB培养基中生长的影响Table 2 Effect of glutamate on A. alternatasurvival in PDA and PDB
2.2 谷氨酸诱导处理时间对樱桃番茄果实黑斑病的影响
如图1所示,谷氨酸对番茄果实黑斑病的抑制效果与其诱导处理时间密切相关。当果实未经谷氨酸诱导直接接入病原菌A.alternata时,其发病率与对照组相比无明显差异,即谷氨酸对番茄黑斑病并无直接抑制作用。然而当谷氨酸诱导时间延长至24和36 h时,果实的发病率显著低于对照组,分别降低了约30.8%和29.5%。

图1 谷氨酸诱导处理时间对番茄果实发病率的影响Fig.1 Effect of glutamate on disease incidence of tomato fruit 注:*表示对照组与处理组差异显著(P<0.05)。
2.3 谷氨酸对病程相关蛋白编码基因的影响
谷氨酸处理组的LePR1基因被迅速诱导表达,在12和24 h时,其转录水平分别为对照组的9.1倍和14.2倍(图2A)。由图2B所示,LePR5基因在被谷氨酸诱导处理24 h时上调表达约2.8倍。PRs家族中PR3和PR4具有几丁质酶特性,结果显示编码几丁质酶的基因LeCHI3和LeCHI9变化规律一致,尤其是在48 h时,谷氨酸处理组LeCHI3转录水平为对照组的3.7倍(图2C)。PR9具有过氧化物酶活性,RT-qPCR检测结果表明,LePOD与LePR1表达趋势类似,可被谷氨酸快速激活,尤其在12 h时基因相对表达量约为对照组的16.0倍(图2E)。
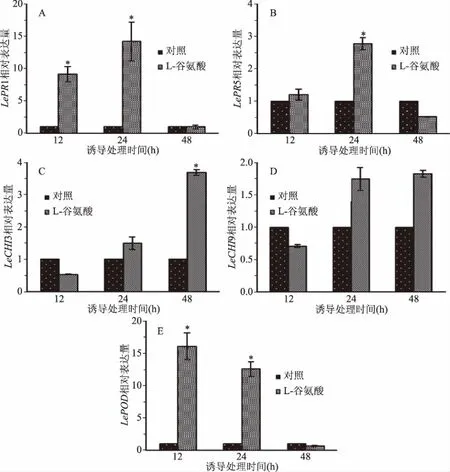
图2 谷氨酸对樱桃番茄果实PRs基因的影响Fig.2 Effect of glutamate on the gene expression of PRs in cherry tomato fruit注:*表示目的基因显著上调表达,P<0.05(Fold change≥2)。
2.4 谷氨酸对β-1,3-葡聚糖酶、几丁质酶和过氧化物酶活性的影响
病程相关蛋白PRs是参与植物诱导抗性的重要机制之一,图3显示了经谷氨酸处理后,β-1,3-葡聚糖酶、几丁质酶和过氧化物酶等在果实组织内的变化趋势。由图3A可知,对照组在整个贮藏期间GLU无明显变化,而果实经谷氨酸处理12 h后,GLU活性逐渐上升,24 h时达到酶活高峰,约为对照组的1.3倍。CHI显示了与GLU相近的变化规律,谷氨酸处理果实后可快速提高CHI活性,同样在24 h时达到峰值(图3B)。谷氨酸处理组POD活性整体呈先升后降趋势,至24 h时达到峰值,而后虽然开始下降,但其酶活性依然高于对照组(图3C)。
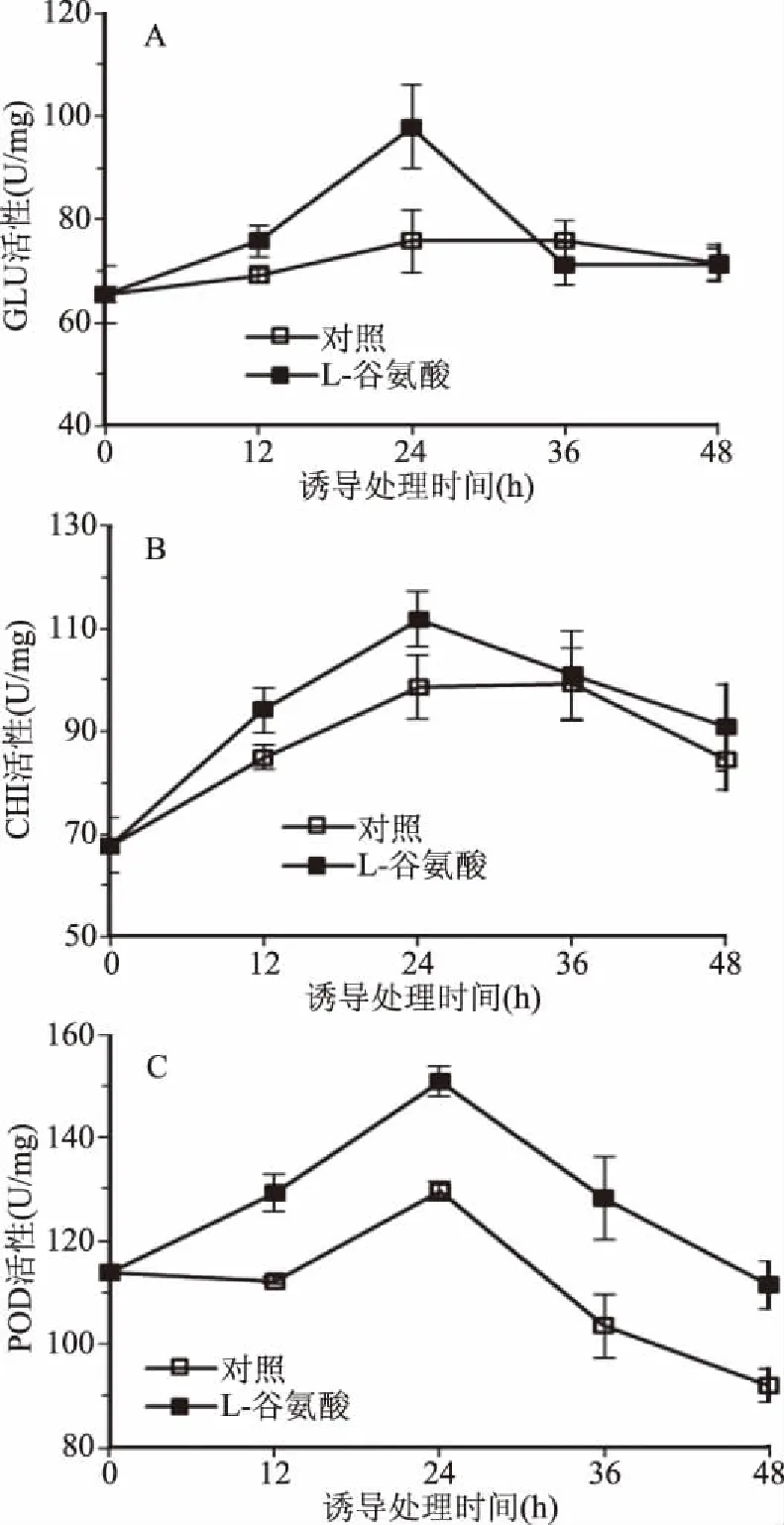
图3 谷氨酸对樱桃番茄果实GLU,CHI和POD活性的影响Fig.3 Effect of glutamate on the activities of GLU,CHI and POD in cherry tomato fruit
3 讨论与结论
本研究中,谷氨酸作为外源因子可以有效抑制由A.alternata引起的番茄黑斑病,且其抑制效果与对果实的诱导处理时间密切相关。当番茄未经谷氨酸诱导时,其对A.alternata的侵染无任何抵御能力,然而随着诱导时间的增加,尤其是达到24 h及以上时,果实对黑斑病的防御能力显著提升。事实上,在外源因子的激发下,果实诱导抗性的形成通常需要一定的时间响应[25]。如利用外源草酸处理甜瓜时,当诱导时间达到48 h以上才可以有效启动果实自身抗性抵御Trichotheciumroseum的侵染[26]。同时,体外试验结果显示谷氨酸对A.alternata在PDA上的生长以及在PDB中的孢子萌发状态并无任何影响。以上结果暗示,谷氨酸有效抵御病原菌的侵染可能是通过诱导提高果实自身抗性,而非直接的抑菌作用。
病程相关蛋白被认为是植物诱导抗性的重要生化机制之一,可以直接或者间接的抑制病原菌的生长、传播,具有潜在的抑菌活性。大量研究表明,PR1蛋白是植物诱导系统获得性抗性激活的标志蛋白,并与水杨酸信号路径紧密相关[27]。本研究结果显示,编码PR1蛋白的LePR1基因可被谷氨酸快速强烈诱导表达,这与Kadotani等[28]报道结果类似,当用谷氨酸处理过水稻根部后,不论是其根部组织还是叶片组织,与水杨酸相关的基因,如OsPR1b基因显著上调表达。葡聚糖和几丁质是真菌细胞壁的主要成分,具有β-1,3-葡聚糖酶和几丁质酶特性的PRs可通过分解这两种物质破坏病原真菌细胞壁的结构。已有证据显示,PR5蛋白可特异性地与β-1,3-葡聚糖结合,具有β-1,3-葡聚糖酶活性[29]。
本研究中,编码PR5蛋白的LePR5基因和β-1,3-葡聚糖酶活性均可被谷氨酸诱导激活。同时,谷氨酸处理对果实中的几丁质酶及其编码基因LeCHI3和LeCHI9也有类似的诱导作用。另外,PR9蛋白具有过氧化物酶活性,可通过催化合成木质素强化细胞壁抵御病原菌的侵染。谷氨酸处理不仅诱导LePOD基因上调,还使得POD活性大大提高。葛永红等[30]利用苯丙噻重氮处理苹果后发现大大促进了果实体内病程相关蛋白(如β-1,3-葡聚糖酶,几丁质酶和过氧化物酶)的积累,这与本研究结果类似。由上述结果推断,谷氨酸对A.alternata的作用机制可能与其诱导了番茄果实体内的病程相关蛋白有关。
综上,谷氨酸对病原菌A.alternata没有直接的抑制作用,其防御果实病害的机制可能是通过诱导提高番茄果实自身的抗性。谷氨酸处理可通过诱导编码病程相关蛋白的基因上调,如LePR1、LePR5、LeCHI3、LeCHI9和LePOD,并提高β-1,3-葡聚糖酶、几丁质酶和过氧化物酶的活性,最终增强果实抵御病原菌的能力。然而,谷氨酸作为新型的化学诱导因子,其诱导抗性机制还有待后续进一步研究,以为其商业化提供坚实的理论基础。

