贵州秋季栽培不同荞麦品种成熟期果实中黄曲霉及其毒素的分离与鉴定
(1.贵州师范大学荞麦产业技术研究中心,贵州贵阳 550000;2.贵州省农业农村厅,贵州贵阳 555001)
荞麦属于双子叶植物蓼科(Polygonaceae)荞麦属(FagopyrumMill)。在我国南北方均有分布,北方主要以甜荞为主,南方主要以苦荞为主[1-2]。荞麦具有药食同源的特性,其种子中具富含芦丁、槲皮素和其他黄酮类化合物,具有“三降”以及抗氧化、抗炎、抗癌[3-4]等特性,被认为是一种潜在的“功能性食品”。近年来,随着人们消费饮食理念的改变和对健康水准的提高,荞麦以其独特的营养成分和丰富的活性物质,受到越来越多人的青睐,需求日渐增加。但是荞麦生产中,由于土壤、环境等影响,在加工、储存、运输等方式不当时,荞麦及其相关产品可能出现发霉变质的现象,由此会影响荞麦产品的品质,甚至不能食用。
黄曲霉(Aspergillusflavus)是子囊菌亚门的一种丝状真菌,是曲霉属真菌中常见的种[5]。以腐殖质等有机质为营养,普遍存在于世界各地的土壤中,并在收获前后对众多农作物造成严重污染,如玉米、花生、水稻、棉籽等[6-8]。其次生代谢产物是一组结构相关的二氢呋喃香豆素的衍生物,俗称黄曲霉毒素(Aflatoxin),是一类剧毒类物质,其中以B1毒性最大,对人和动物的肝脏组织有严重损害作用,能够引起肝脏组 织癌变导致死亡[9]。目前国内外有关黄曲霉及其毒素的报道很多,如在农业方面,由于黄曲霉毒素侵染导致全球农作物大面积污染受损,致使农作物产量和质量都受到影响,导致严重的经济损失,以花生玉米尤为严重[10]。在食品工业方面,黄曲霉毒素污染是全世界严重的食品安全问题,它不仅是危害健康的潜在来源,而且还涉及农产品的腐败。黄曲霉毒素及其动物生物转化产物,均被称为食源性致癌物质,对人类和动物健康产生严重的有害影响[11]。
荞麦产品黄曲霉鉴定和黄曲霉毒素检测一直是贸易出口商品的检测和关注重点,林巧等[12]对213份凉山州苦荞茶中的黄曲霉毒素B1(aflatoxinB1,AFB1)安全性进行评估,有150份样品被检测出受到不同程度AFB1的污染,检出率为70.42%。王艳等[13]调查了6个不同地区不同类型的荞麦食品中AFB1、AFB2、AFG1、AFG2的污染情况,结果表明荞麦食品受到黄曲霉毒素污染,但污染程度较轻。林巧等[14]对HPLC法定量检测AFB1的可行性进行的系统研究,证实HPLC法用于苦荞制品中AFB1检测具有可行性。据陈庆富[1]报到,近年来荞麦育种取得显著进步,培育出来的品种除了甜荞、常规苦荞以外,还培育出了薄壳的米苦荞、多年生苦荞等新类型新品种。关于这些新类型新品种成熟种子中的黄曲霉安全性等还缺乏研究。本研究在前期检测中发现某些米苦荞籽粒样品中存在B1、B2、G1、G2四种毒素,为研究其来源,以贵阳秋季栽培的2个米苦荞、2个多苦荞、2个甜荞、2个常规苦荞为材料对其成熟期成熟种子果壳和籽粒进行了黄曲霉分离鉴定,并采用HPLC法对所有品种籽粒及其分离出的黄曲霉菌株进行B1、B2、G1、G2毒素的检测,以期为荞麦黄曲霉毒素的来源研究和预防提供指导。
1 材料与方法
1.1 材料与仪器
采用DG18(氯硝胺18%甘油培养基)作为真菌培养基,参考张初署等[15]的配制方法,121 ℃灭菌25 min;无水乙醇 分析纯;乙腈 色谱纯;次氯酸钠溶液 有效Cl->2.5%,分析纯;石碳酸棉蓝染液 上海江莱生物科技有限公司;2×EasyTaq PCR SuperMix、真菌基因组DNA提取试剂盒、黄曲霉毒素标准品 北京Sigma-Aldrich公司;通用引物ITS1、ITS4 上海生工科技有限公司。
RXZ型人工气候培养箱 宁波江南仪器厂;DV214C万分之一电子天平 奥豪斯国际贸易有限公司;DZS2-LCO80高温高压灭菌锅 山东新华医疗器械股份有限公司;CX-41光学显微镜 奥林巴斯公司;BCD-525海尔双开门冰箱 合肥美的电冰箱厂;BS-1E恒温振荡培养箱 国华电器有限公司;TGL-16G微型高速离心机 上海安亭科学仪器厂;CJ-1S净化工作台 天津市泰斯特仪器有限公司;TCT5PCR基因扩增仪 上海领成生物科技有限公司;Gel--k8500全自动凝胶成像系统 北京科创锐新生物科技有限公司;电动移液器 Eppendorf(德国);LC-DCY-12SF氮气吹干仪 力辰科技;U3000高效液相色谱仪-荧光检测器(配光化学衍生) Thermo scientific。
1.2 实验方法
1.2.1 取样 此次实验中供试荞麦品种(见表1)于2018年8月10日秋播行播于贵州省贵阳市乌当区百宜镇贵州师范大学荞麦产业技术研究中心百宜基地(海拔1345 m,东经106°53′,北纬26°52′),行间距33 cm,底肥使用25 kg/亩复合肥与磷肥(1∶1)混合物,播种量月2~3 kg/亩,无中耕和追肥。供试种子样品,均是于2018年11月6日取自各供试荞麦品种成熟期收获前。根据五点取样法,在种植区10×10 m的范围内各取5个10 种子样品清除杂质,混匀后平均分成四份,分别编号1#,2#,3#,4#,放置于4 ℃冰箱待用。

表1 供试荞麦品种信息Table 1 Buckwheat varieties information
1.2.2 黄曲霉的分离纯化 将种壳与籽粒分离,各称取2 g。对籽粒进行表面消毒,用无菌水(3次)、70%乙醇(3 min)、次氯酸钠(5 min)、70%乙醇(30 s)、无菌水冲洗依次进行处理消毒直至无菌[16]。种壳和籽粒(研磨成粉)均加入无菌水制成10-1浓度的悬浊液,150 r/min振荡30 min。取出后吸取1 mL悬浊液加入9 mL无菌水制成10-2浓度悬浊液,后依次吸取1 mL稀释成10-3、10-4、10-5浓度梯度悬浊液[17],每个稀释度吸取200 μL涂布于DG18培养基中,每个编号的每个稀释度重复4次,28 ℃培养7 d,每个品种方法均一致[18]。
以每个平板中真菌菌落数20~40个为宜,籽粒选取10-3为最适浓度,壳以10-4为最适浓度。对平板中各菌落进行形态、颜色、质地等观察并计数,挑取表面长有黄绿色孢子的黄曲霉疑似菌落于空白DG18培养基中进行划线分离纯化培养7 d,对单个黄曲霉疑似菌落生长情况进行观察。
1.2.3 分离菌落光学及扫描电镜观察 挑取分离纯化得到的各菌株于载玻片上,滴一滴乳酸石碳酸棉蓝染液,5 min后盖上盖玻片,吸去盖玻片周围多余染液,光学显微镜下观察菌株顶囊、瓶梗、梗基、分生孢子、分生孢子梗等结构并拍照[19]。用胶带轻轻粘取黄曲霉菌落的孢子及菌丝于样品台上,将样品台放置于镀碳膜仪器中,碳镀膜约25 min,取出后放置于扫描电镜中进行观察并拍照。
1.2.4 菌株基因组DNA提取、扩增与测序 取50 mg 1.2.2中纯化的黄曲霉疑似菌丝于灭菌研钵中,采用试剂盒法提取菌株总DNA,以提取的DNA为模板,采用真菌通用引物ITS1(5′-TCCGTAGGTGAA CCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGAT ATGC-3′)用于rDNA ITS区段的聚合酶链式反应(polymerase chain reaction,PCR)扩增[20-21],PCR反应体系:DNA模板1 μL,2×EasyTaq PCR SuperMix 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,用ddH2O补足至总体积25 μL。反应条件为95 ℃预变性6 min,接下来的34个循环包括94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,最后一个循环在72 ℃延伸10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳检测并拍照。
回收PCR产物后交由上海生物工程有限公司测序。将结果输入NCBI利用BLAST将培养好的不同菌系的黄曲霉菌株从DG18培养基上刮下,进行序列相似性比对。
1.2.5 菌株产黄曲霉毒素检测分析
1.2.5.1 样品前处理 精密称取研磨后取样5 g,置于50 mL离心管中,加84%乙腈溶液20 mL,震荡浸提30 min,转入离心机,在5000 r/min转速下常温离心10 min,吸取提取液10 mL于玻璃试管中,42 ℃氮吹至近干,以20 mL 10%乙腈溶液漩涡混匀20 s,置于免疫亲和柱上净化。免疫亲和柱先以柱子自带的PBS活化后,分批加入10%乙腈做溶剂的样品溶液,控制流速在3 mL/min,待样品过柱完成后,用20 mL屈臣氏纯净水洗涤免疫亲和柱,用洗耳球吹干免疫亲和柱,然后用2 mL甲醇洗脱免疫亲和柱,收集流出液体,42 ℃氮吹至近干,以1 mL流动相溶解,漩涡混匀20 s,过0.22 μL尼龙滤膜至液相色谱样品瓶中,待测。
种子剥壳后表面消毒,磨成粉后称取5 g,之后处理方法同菌株。
1.2.5.2 色谱条件 HypersilTMBDS C18 色谱柱(4 mm×250 mm,5 μm);流动相:乙腈/甲醇/超纯水(19∶19∶62,体积比);柱温:40 ℃;流速:1 mL/min;光化学柱后衍生,检测波长入射:360 nm,发射:460 nm;进样量25 μL。
1.2.5.3 标准溶液配制 配制B1:10.83、8.664、4.332、2.166、1.083 μg/L;B2:2.94、2.352、1.176、0.588、0.294 μg/L;G1:10.33、8.264、4.132、2.066、1.033 μg/L;G2:3.22、2.576、1.288、0.644、0.322 μg/L标准系列溶液,依据1.2.5.2色谱条件进行测定,以配制的黄曲霉毒素混合标准液各浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3 数据分析
采用SPSS 20.0对所得数据进行差异性分析。
2 结果与分析
2.1 黄曲霉菌株分离结果
将8个不同荞麦品种的果壳和籽粒分别进行黄曲霉培养7 d后发现,所有品种果壳中均没有出现黄曲霉菌落,黄曲霉发生率为0%;籽粒中只有米苦荞品种出现黄曲霉菌落,其中贵米苦荞18-1号黄曲霉发生率为1.56%,贵黑米苦荞12号黄曲霉发生率为0.78%。结果见表2。
表2 黄曲霉菌株分离结果Table 2 Aspergillus strains isolation results
2.2 菌株形态学鉴定结果
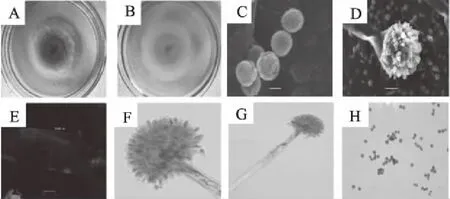
图1 分离菌株的形态特征图Fig.1 Morphological characteristics of isolated strains 注:A、B分别为DG18培养基上菌落正、反图,C为扫描电镜分生孢子,D为扫描电镜产孢结构,E为扫描电镜分生孢子梗,F为光学显微镜产孢结构,G为光学显微镜产孢结构,H为光学显微镜分生孢子。
从8个品种荞麦籽粒中分离获得4株黄曲霉菌株,经仔细观察并与黄曲霉菌株形态学特征进行比较,结果发现分离的4株黄曲霉菌株在外观形态与生长速率上表现出高度一致,并且在光学显微镜下的形态也保持一致,因此从形态上看,分离的4株菌株应均属黄曲霉菌株。
2.3 菌株分子鉴定结果
经初步鉴定后共分离四株黄曲霉菌株,从贵米苦荞18-1号中分离出3株,分别命名为Mi18-S1、Mi18-S2、Mi18-S3,贵黑米苦荞12号中分离出1株,命名为Heimi12-S4。凝胶电泳结果见图2。测序后发现4株菌株ITS区段DNA序列完全一致,输入NCBI中进行BLAST对比后发现与黄曲霉菌株ITS区段DNA序列的相似性为100%(图3),因此可鉴定分离菌株为黄曲霉菌株。
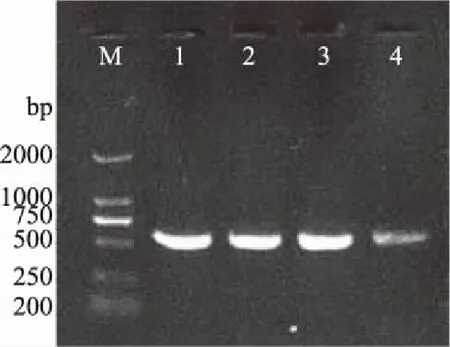
图2 黄曲霉菌株ITS序列扩增结果 Fig.2 ITS sequence amplification results of A.flavus注:M表示marker,图中左侧表示marker扩增带大小;1~4分别表示黄曲霉菌株Mi18-S1、Mi18-S2、Mi18-S3、Heimi12-S4。

表3 黄曲霉菌株形态学特征Table 3 Morphological characteristics of Aspergillus flavus

图3 鉴定菌株序列blast比对结果Fig.3 Sequence blast alignment of identified strain
2.4 黄曲霉毒素混合标准品标准曲线
在所选用色谱条件下,黄曲霉毒素得到良好的基线分离,其标准品色谱图见图4,黄曲霉毒素的色谱峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标,4种毒素在20 min内出峰,先后顺序为 AFG2、AFG1、AFB2、AFB1。绘制标准曲线所得线性回归方程如表4 所示,相应的检测范围内浓度与峰面积有良好的线性关系。

表4 黄曲霉毒素混合标准溶液的线性回归方程Table 4 Linear regression equation of aflatoxin mixed standard solution
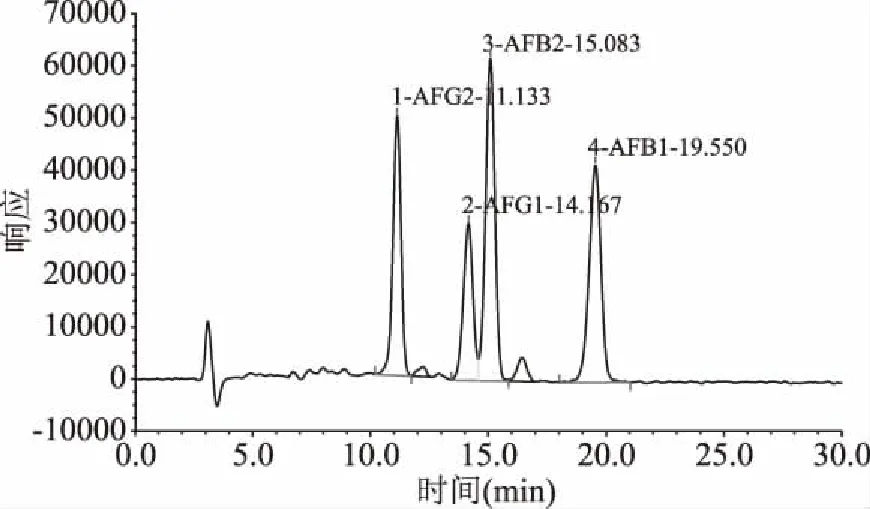
图4 黄曲霉毒素混合标准品色谱图Fig.4 Aflatoxin mixed standard chromatogram
2.5 黄曲霉菌株产毒量测定
米苦荞籽粒高效液相色谱图见图5,只有贵米苦荞18-1号和贵黑米苦荞12号在相应时间内出峰,并且4种毒素均有。
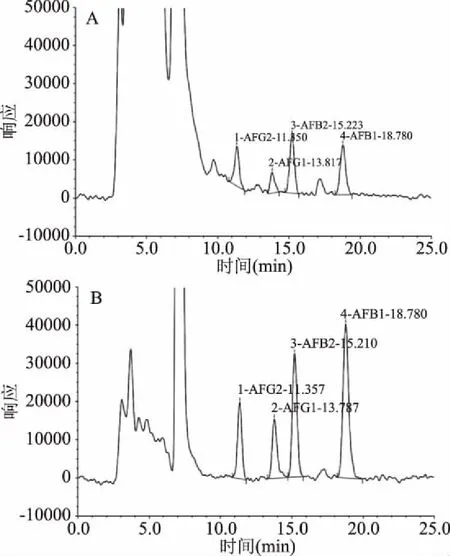
图5 贵米苦荞18-1号(A)和贵黑米苦荞12号(B)籽粒中黄曲霉素高效液相色谱图Fig.5 High performance liquid chromatography in rice grains of Guimiku 18-1 and Guiheimi 12
各样品籽粒中产生黄曲霉毒素及含量见表5。由表5可知,不同品种籽粒间产毒能力有显著差异,贵米苦荞18-1号中AFB1产毒量为(5.861±0.055) μg/kg、AFB2为(1.605±0.052) μg/kg、AFG1为(3.846±0.476) μg/kg、AFG2为(1.754±0.143) μg/kg,AFT总量为(12.625±1.941) μg/kg。贵黑米苦荞12号中AFB1产毒量为(14.475±0.533) μg/kg、AFB2为(3.463±0.063) μg/kg、AFG1为(9.111±1.636) μg/kg、AFG2为(3.393±0.151) μg/kg,AFT总量为(30.442±1.474) μg/kg。

表5 不同荞麦品种籽粒中的黄曲霉毒素含量(μg/kg)Table 5 Aflatoxin content(μg/kg)in rice grains of different buckwheat varieties(μg/kg)
分离黄曲霉菌株产毒种类及含量见表6。由表6可知,各菌株均产AFB1、AFB2、AFG1、AFG2,和籽粒中结果一致,且不同菌株之间差异显著。
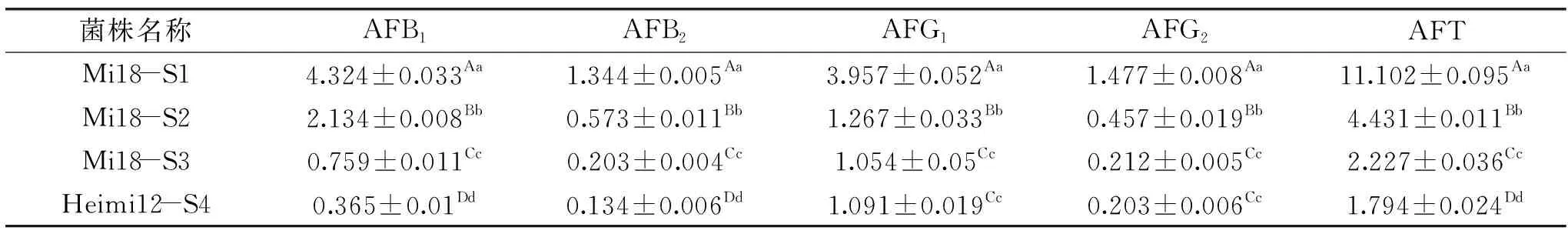
表6 黄曲霉菌株产黄曲霉毒素含量(μg/kg)Table 6 Contents of aflatoxin(μg/kg)produced by Aspergillus flavus strains(μg/kg)
3 结论与讨论
本研究利用荞麦中的米苦荞、多年生苦荞、甜荞和常规苦荞等8个品系的材料,首次对成熟期成熟果实果壳和籽粒进行了黄曲霉菌株的分离与鉴定及毒素研究。结果显示所有荞麦果壳上均未分离到黄曲霉菌株,而籽粒中仅从米苦荞品种分离出并发现成熟期少数种子中含有黄曲霉毒素。由于供试荞麦中除米苦荞以外的荞麦品种都具有厚的果壳,可对籽粒有一定保护作用。本研究中多苦荞、甜荞、常规厚壳苦荞这3类荞麦品种相对于米苦荞类型而言不容易被黄曲霉感染,并不表示这3类荞麦品种不被黄曲霉感染,其未检出黄曲霉的原因可能是由于果壳厚、保护完整,或者取样样本随机的原因。推测供试米苦荞带菌带毒的可能原因是果实果壳常常开裂暴露部分米粒、易被虫食形成损伤,导致少数籽粒遭遇黄曲霉菌感染而带菌和带毒。因此在米苦荞生产上需要更加严格监测控制,特别是80%以上果实成熟时就要及时收获干燥和良好保存,同时在育种上需要选育不开裂薄壳苦荞品种,以减少黄曲霉感染。
本研究结果表明不同荞麦品种带菌产毒多少存在差异,Chitarrini等[22]用产生AFB1的黄曲霉菌株NRRL 3357接种于F.tataricum(var.Golden)和F.esculentum(var.Aelita)两种荞麦品种的瘦果中,以分析它们在瘦果感染期间产毒素的能力。结果表明,F.tataricum的瘦果对F.flavus感染敏感较低,产毒较少,说明了荞麦籽粒中黄曲霉产毒量多少和种子自身有很大关系,不同品种之间存在显著差异。本研究只有米苦荞产毒,其他品种不产,并且米苦荞的两个样品产毒量也存在差异,因此这种品种间带菌产毒的差异为今后抗黄曲霉荞麦品种的选育提供帮助。
本研究发现籽粒中产毒量远大于从籽粒中分离菌株的产毒量,据Ramon等[23]的报道,得克萨斯州商品棉籽中黄曲霉毒素所占百分比会随着时间的增加而增加,污染情况也变得严重。本研究中毒素在籽粒中积累时间较菌株中长,所以毒素积累多。因此需按时收获成熟荞麦,收获过晚可能会导致荞麦籽粒中黄曲霉污染增加。
本研究结果显示荞麦中不同黄曲霉菌株产毒量存在显著差异,如Heimi12-S4总产毒量为(1.794±0.024) μg/kg,而Mi18-S1总产毒量为(11.102±0.095) μg/kg。因此在今后荞麦种植过程中,可以依据菌株间产毒差异性从而筛选出黄曲霉毒素生物防控菌株和不产毒菌株,深入探索抑制黄曲霉生长及黄曲霉毒素产生的作用机制,为荞麦中黄曲霉毒素的防控提供更准确更全面的信息。

