靶向血管内皮生长因子受体2的sKDR抑制血管内皮细胞生长和血管生成的研究
郑红淑,王秀岩,李然伟,冯树强,李春艳,徐文翠
(吉林大学第二医院 泌尿外科,吉林 长春130041)
恶性肿瘤的生长、侵袭和转移与新生血管形成密切相关,血管形成在肿瘤多个生物学过程中均起到至关重要的作用[1]。近年来抗血管生成是治疗肿瘤的研究热点之一,已被许多研究证明是有效的,已成为癌症治疗不可替代的方法。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成最重要的因子,可通过不同形式的干预,以阻断肿瘤新生血管形成。抑制肿瘤血管生成的策略包括抑制血管生成因子及其受体的产生,抑制VEGF信号通路,抑制VEGF与其受体之间的结合,抑制VEGF信号的细胞内转导。VEGF促肿瘤生长和血管形成作用主要与其受体KDR(kinase insert domain receptor,KDR)有关[3]。KDR是一种跨膜蛋白,在正常组织中不表达,但在多种实体肿瘤组织细胞及肿瘤血管内皮细胞均有高表达[4,5]。我们构建了含有KDR胞外VEGF结合区编码基因和信号肽的真核分泌型表达质粒PQE40-KDR,即可溶性血管内皮生长因子受体sKDR(soluble KDR,sKDR),通过阳离子及脂质体将其转染到人脐静脉内皮细胞HUVEC(Human umbilial vein endothelial cell,HUVEC),观察其对细胞增殖和血管生成的影响,为寻求更加确实有效的分子靶向用药的基因治疗临床恶性实体肿瘤的新靶点提供实验依据。
1 材料与方法
1.1 一般材料小鼠抗His标签单克隆抗体和TA克隆载体pMD19-T Simple Vector购自Qiagen公司;IPTG购自Promega公司;各种限制性内切酶、工具酶及DNA片段回收试剂盒和表达载体pQE40购自TaKaRa公司;NTA-Ni2+琼脂糖树脂购自Qiagen公司;重组人VEGF和rhVEGF165购自Peprotech公司;RPMI-1640培养基、小牛血清购自Hyclone公司;TRIzoL试剂购自Gibco公司;转染试剂LipofetamineTM2000购自Invitrogen公司;G418和酶标仪分别为Sigma和Biorad公司产品。
1.2 实验方法①获取KDR胞外可溶性片段的获得及构建sKDR真核分泌型表达载体:采用胶原酶(Ⅰ型)消化法,在无菌条件下提取新生儿脐静脉内皮细胞(HUVEC)。用含有用添加20%小牛血清的RPMI-1640培养液进行培养。取第二代HUVEC,利用TRIzol法提取总RNA,RT-PCR法扩增KDR胞外第1-4个Ig样结构域cDNA片段。根据人KDR基因的cDNA序列及相应编码结构域,设计引物序列如下:sense 5’ -GCCTCTGTGGGTTTGCCTAGTGTTTC,下游引物antisen se5’- ATTGGTAAGGATGACAG TGTAATTTC,扩增片段长度在1 149 bp时,利用下述2条引物从重组TA克隆载体上扩增sKDR片段,引物序列:sense 5’-CGGGATCCATGGCCTCTGTGGGT-3’(含BamH Ⅰ酶切位点),antisense:5’-CCCAAGCTTATTGGTAAGGATGAC-3’(含HindⅢ酶切位点)。将PCR产物和载体PQE40分别用BamHⅠ/ HindⅢ双酶切后进行连接。将C端加有6His-Tag的KDRcDNA片段,N端带有Kozak序列GCCACC及ATG起始密码的小鼠Igk信号肽序列的cDNA片段与PQE40载体进行连接,构建分泌型真核表达质粒PQE40-KDR,即sKDR载体连接方式及酶切位点情况(图1)。
②采用酶联免疫吸附试验(ELISA)法进行稳定表达sKDR细胞株的筛选:在200 μg/ml的G418浓度下对稳定株进行培养,在400 μg/ml的G418浓度下筛选阳性转染株,将筛选出的PQE40-KDR阳性细胞克隆,用无血清培养基培养,取培养上清依次进行倍比稀释(1∶1,1∶2,1∶4,1∶8,1∶16,1∶32,1∶64,1∶128),包被96孔酶标板,利用rhVEGF165作为一抗,小鼠抗人VEGF单抗作为二抗,再加入辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG,以四甲基联苯胺(TMB)作为底物进行显色,硫酸终止后在酶标仪上检测450与620 nm处吸光度A比值(A450/A620比值)。
③逆转录-聚合酶链反应(RT-PCR)鉴定稳定表达sKDR的细胞株:取稳定表达sKDR的HUVEC,Trizol法提取细胞总RNA。取2 μg 总RNA用逆转录酶进行逆转录合成cDNA,PCR分别扩增KDR和β-action。KDR引物:上游引物5’-AATTACTTGCAGGGGACAGAG,下游引物5’-TTCTGGGTATCTTGCACAAAG,扩增片段位于胞外第1-4 Ig样结构域,长度352 bp;β-action引物:上游引物5’-GTGGGGCGCCCCAGGCACCA,下游引物5,-CTCCTTAATGTCACGCATTTC,扩增片段长度为630 bp。采用1%琼脂糖凝胶电泳分离产物,并在紫外线灯下拍照保存。重复3次。
④四甲基偶氮唑盐(MTT)比色法检测HUVEC的增殖情况:选用生长良好的第3代HUVEC,调整细胞密度为2×104个/ml,接种于96孔细胞培养板,37℃培养24 h,细胞贴壁后换为不含血清的RPMI1640培养液继续培养24 h,分别加入pQE40-KDR组,pQE40组及未转染组HUVEC无血清培养上清,浓度100 μl/ml。随后分别观察HUVEC的生长情况。
⑤sKDR蛋白对CAM血管生成的影响:将鸡胚置于37.8℃的孵箱中孵育,每天轻轻翻蛋2-3次。取孵满8 d的鸡胚,用酒精消毒蛋壳,在鸡胚长轴的气室一端打一1-2 mm的减压孔,另在鸡胚长轴中央(胚头右下方)开一1-2 cm2的天窗,形成人工气室。带有5 cm圆孔硝酸纤维素滤膜,高压灭菌,分别取PBS(10 μl)、VEGF(20 ng)、VEGF(20 ng)+不同浓度sKDR(0.5 μg、1 μg和2 μg)点于纸片上,待其充分吸收后,加入鸡胚尿囊膜血管较少的部位。加鸡胚,用灭菌透明胶带封闭,孵育72 h,数码相机拍照。
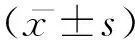

图1 p QE40-KDR连接方案示意图
(说明:本图为作者原创,是本文中sKDR真核分泌型表达质粒构建的重要环节。Igκ信号肽位于pQE40真核表达质粒CMV启动子的下游,可引导表达的蛋白分泌到细胞外,KDR cDNA为KDR胞外第1-4 Ig样结构域,6His为组氨酸标签。这种结构可使sKDR在信号肽的指导下分泌到细胞培养上清,并能通过6His组氨酸标签进行纯化)
2 结果
2.1 稳定表达sKDR的HUVEC培养上清与VEGF的结合活性:稳定表达sKDR的培养上清pQE40-KDR经倍比稀释后与rhVEGF蛋白呈现出不同的结合力,在1∶1-1∶16稀释范围内,随稀释度增大A值逐渐降低,二者呈明显正相关,相关系数r=0.9063。转染空质粒组(pQE40)和未转染组的HUVEC培养上清与VEGF无结合力(表1)。

表1 表达sKDR的HUVEC培养上清与rhVEGF165结合力
2.2 RT-PCR检测稳定表达sKDR的HUVEC细胞KDRmRNA表达水平:将各组 KDR与内参β-action电泳条带进行光密度扫描后分析,发现pQE40-KDR与β-action比值为0.665±0.048,而pQE40组和未转染组分别0.160±0.015和0.161±0.020。与pQE40组比较,pQE40-KDR组的KDR表达水平明显增高,差异具有统计学意义(t=17.387,P<0.0001);pQE40组与未转染组比较,差异无统计学意义(t=0.02317,P=0.9826)。未转染组也呈现出一定水平的KDRmRNA,(图2)。
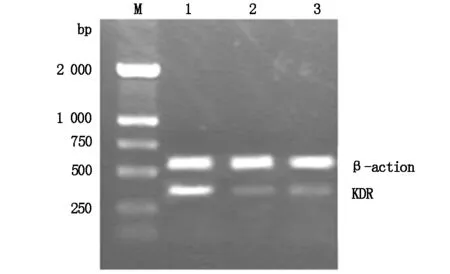
M:标样;1:pQE40-KDR;2:pQE40;3:未转染组
2.3 sKDR对HUVEC增殖能力的影响:MTT法检测HUVEC增殖,我们发现与PBS组相比,未转染组、pQE40组和pQE40-KDR组, KDR可显著诱导并加速内皮细胞增殖。加入sKDR后,随着加入浓度的增加,内皮细胞增殖受抑程度增强,说明内皮细胞增殖与sKDR浓度水平呈正相关。两者相对比,差异有统计学意义(表2)。

表2 sKDR对脐静脉内皮细胞增殖的影响
Note:*compare with PBS group;#compare with KDR group
2.4 sKDR对CAM血管生成的影响:KDR可显著促进CAM血管生成。6只经KDR处理的鸡胚其血管均以KDR为中心呈放射状分布。当加入含量为2 μg的 sKDR时,6只鸡胚中只有一枚血管呈放射状分布显示出极强的血管抑制功能,两者相对比,差异有显著统计学意义(P<0.01),(图3)。

图3 sKDR对鸡胚尿囊膜血管生成的影响
3 讨论
VEGF可特异性结合VEGFR(主要是VEGFR1和VEGFR2),诱导血管形成。VEGFR-2的结构包括细胞内部分、跨膜部分和细胞外部分,这些都是信号传输所必需的。近年来,国内外研究普遍认为,sKDR是VEGFR2的膜外部分的一种可溶性形式,它对VEGF具有相同的高亲和力,但不诱导血管生成。因此,sKDR可与VEGF结合,并与正常的VEGFR-2竞争,通过形成具有跨膜VEGF受体的非活性异二聚体,可以发挥显性负作用。因此,sKDR向肿瘤组织的传递抑制了肿瘤组织中新生血管的形成,具有抗肿瘤作用。在VEGF受体中,VEGFR2即KDR在介导VEGF刺激内皮细胞增殖及血管通透性方面的作用更重要[6,7]。临床实验结果证实多种肿瘤细胞均表达KDR,肿瘤细胞分泌的VEGF与血管内皮细胞及肿瘤细胞膜上的KDR结合后通过自分泌和旁分泌效应,促进内皮细胞增殖,并增加血管通透性,加速肿瘤细胞分裂增殖,导致肿瘤生长与转移[8,9]。提示在HUVEC中存在VEGF/KDR信号传导途径。VEGF能与KDR结合,从而促进细胞增殖诱导新生血管形成,因此干扰VEGF/KDR信号传导亦就成为目前抗肿瘤血管生成治疗中的主要策略[4,5]。由于KDR仅存在于血管内皮细胞和大多数肿瘤细胞表面,肿瘤细胞表达分泌的VEGF只有与血管内皮细胞膜上的KDR结合后,才能诱导内皮细胞增殖生长及血管通透性增加[9,10,11]。因此,瞄准KDR并使其生物活性失活的策略将能在很大程度上遏制肿瘤血管生成,阻止肿瘤持续生长。
本实验结果中的各项统计数据初步说明,我们针对血管内皮生长因子受体2(VEGF2)构建的真核分泌型表达载体pQE40-KDR,即sKDR具有特异性抑制VEGF/KDR信号传导的功能,从而有效遏制了HUVEC增殖和CAM血管生成。本实验同时表明,sKDR仅具有与配体结合的能力而无信号传导功能,因其与KDR的特异性结合而显著下调了VEGF与KDR结合的能力,可显著降低VEGF的水平和活性,从而达到抑制HUVEC细胞增殖和阻抑CAM血管新生的目的。因此,这一发现对于抑制恶性实体瘤转移具有极其重要的意义。也为分子靶向用药的基因治疗,甚至抗血管治疗肿瘤的新药研发提供了实验依据和新思路。因此,靶向KDR一方面可通过干扰VEGF/KDR的信号传导,另一方面可与VEGF的竞争性结合起到耗竭VEGF的作用,从而有效抑制细胞生长,KDR作为新的抗癌基因治疗靶点具有一定的潜力和临床应用前景。

