多囊卵巢综合征患者促排卵周期中成熟卵泡性激素浓度对妊娠的影响
秦 爽 阮祥燕 王宾红 鞠 蕊 张露平 豆竹丽 程姣姣 金 婧
(首都医科大学附属北京妇产医院内分泌科,北京 100026)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种复杂的内分泌紊乱疾病,患病率高达6%~20%[1],是育龄期女性最常见的内分泌和代谢紊乱综合征。目前其病因尚不明确,可能与遗传、环境(尤其是营养)等因素有关,有学者[2]认为胰岛素抵抗、高雄激素血症和肥胖在PCOS患者的发病中起重要作用。患者常以持续性无排卵、高雄激素血症和不孕为主要特征,PCOS是导致妇女不孕的主要疾病,促排卵治疗是其主要的治疗方法[3-4]。
性激素浓度在月经周期中呈周期性变化,早卵泡期雌激素 (estradiol,E2)最低,随着卵泡的募集尤其是优势卵泡的生长,雌激素浓度逐渐升高最终达到峰值[5]。血清E2浓度在卵泡发育和卵成熟中起重要作用,过低的E2可能对妊娠造成不利影响,会影响卵泡发育内环境,不利于卵泡的成熟、正常减数分裂及受精[6-7]。大多数PCOS患者表现为血清高雄激素浓度及高抗缪勒激素(anti-Müllerian hormone,AMH)浓度,而对于PCOS患者,妊娠可能使血清雄激素浓度及AMH浓度升高[8]。本研究拟通过比较促排卵治疗后妊娠患者与未妊娠患者的性激素六项浓度的差异,为PCOS患者的促排卵治疗的成功妊娠提供更合理的临床指导。
1 对象与方法
1.1 研究对象
选取2019年3月至2020年1月于首都医科大学附属北京妇产医院内分泌科就诊的198例(共计470个监测排卵周期)PCOS不孕患者为研究对象,根据患者促排卵治疗后血人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)结果是否阳性分为妊娠组(64例,68个周期)和未妊娠组(134例,402个周期)。本研究经医院伦理委员会批准,伦理批准文号:2020-KY-011-01。所有患者均充分知情并签署知情同意书自愿参加本研究。
1.2 诊断及纳入标准
1.2.1 PCOS诊断标准
符合我国中华医学会妇产科学分会内分泌学组及指南专家组制定的《多囊卵巢综合征中国诊疗指南》[9]:月经稀发或闭经或不规则子宫出血是诊断疑似 PCOS 的必需条件,另外再符合下列两项中一项即可诊断:①高雄激素临床表现或高雄激素血症;②超声表现为多囊卵巢。同时也应排除其他引起高雄激素的疾病或引起排卵异常的疾病。
1.2.2 纳入及排除标准
纳入标准:①年龄20~40岁,已婚,有正常性生活,有生育要求;②在排除男方不孕因素后,未避孕未孕1年以上;③无严重内、外科合并症。
排除标准:①患有急性生殖泌尿系统传染病或性传播疾病;②其他妇科疾病所致不孕者;③有严重的遗传疾病;④患精神疾患需长期服药者;⑤免疫系统疾病者需应用激素类药物。
1.3 研究方法
1.3.1 病史采集
制定统一调查量表,由专门医生进行病史及信息采集,记录患者的:①一般情况:年龄、学历、职业、血压、身高、体质量、腰围、臀围(hip circumference,HC)、计算体质量指数(body mass index,BMI);②月经史及孕产史:月经周期,不孕年限,孕产次数;③超声检查:子宫大小、内膜厚度及分型,双侧卵巢体积、窦卵泡数量;④基础内分泌、肝肾功能、糖脂代谢指标:基础内分泌值[卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌激素 (estradiol,E2)、孕激素(progesterone,P)、催乳素(prolactin,PRL) 和总睾酮(testosterone,T)]、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素[fasting insulin,FINS(OH)]、皮质醇(cortisol,COR)、促甲状腺素(thyroid-stimulating hormone, TSH)、AMH、游离睾酮(free testosterone,FT)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、载脂蛋白A1(apolipoprotein A1,APOA1)、载脂蛋白B(apolipoprotein B,APOB)、脂蛋白a(lipoprotein a)、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)。
1.3.2 治疗方案
患者促排卵前均予口服屈螺酮炔雌醇片(优思悦)配合减重及生活方式干预等综合预处理治疗三个周期。所有患者均于月经周期第3天开始口服来曲唑(letrozole),5 mg/d,共5 d,并于月经周期第8~10天开始每间隔2~3 d一次进行阴道彩超检查监测卵泡生长及子宫内膜情况,彩超检查均由内分泌科1~2个医师进行,根据卵泡生长速度给予高纯度尿促性素(high purified human menopausal gonadotrophin,HP-HMG)肌肉注射治疗,同时根据子宫内膜生长情况,给予重组人生长激素(recombinant human growth hormone,r-hGH)皮下注射治疗,当阴道彩超提示成熟卵泡出现(卵泡直径≥16 mm)时检测血清性激素六项(FSH、LH、E2、P、PRL、T)浓度,取血前患者安静休息15~20 min,统一由抽血室护士进行抽血,内分泌实验室人员完成测定,同时给予患者促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)皮下注射并指导患者同房的最佳时机。
1.4 统计学方法

2 结果
2.1 两组患者的基线资料比较
两组患者的年龄、BMI、学历、职业、腰围、臀围、血压、既往孕产次数、监测排卵周期数、基础内分泌水平、肝肾功能及糖脂代谢指标,组间比较差异无统计学意义(P>0.05)。妊娠组的不孕年限短于未妊娠组,基础AMH浓度高于未妊娠组,差异有统计学意义(P<0.05)。详见表1。
表1 两组患者的基线资料比较
Tab.1 Baseline date of two groups

表1 两组患者的基线资料比较
FactorPregnant group(68 cycle)Non-pregnant group(402 cycle)Z/tPAge/a29(28-32)30(28-32)-1.2430.214BMI/(kg·m-2)24.6(20.3-27.1)23.4(20.7-26.2)-1.0630.288Waist circumference/cm81(75-89)81(75-87)-0.4150.678Hip circumference/cm95.5(89.75-99)95(90-100)-0.9070.364SBP/mmHg△122±12119±121.2520.052DBP/mmHg△81±1177±101.959Gravidity0(0-1)0(0-1)-0.4320.665Parity00-0.5860.558Total treatment cycle2(1-4)2(1-4)-0.8500.395Infertility age/a12(1-2)-5.7970.000Basics LH/FSH1.31(0.78-1.83)1.31(0.80-2.12)-0.6700.503AMH/(ng·mL-1)8.66(4.29-12.76)7.08(3.39-9.79)-2.1410.032FT/(pg·mL-1)6.905(4.085-9.57)5.06(3.215-8.12)-1.8800.060FINS(OH)/(pmol·L-1)63.51(41.43-90.84)65.94(44.99-93.80)-0.6780.492FPG/(mol·L-1)4.96(4.68-5.20)4.96(4.77-5.31)-0.8320.405COR/nmmol·L-1)357.4(271.2-464.8)339.4(240.9-461.9)-1.3510.177TSH/(mIU·L-1)2.11(1.5-3.2)2.21(1.51-3.11)-0.1080.914ALT/(U·L-1)17.35(12.32-25.85)16.3(11.9-24.05)-0.3550.723AST/(U·L-1)18.2(15.77-21.92)17.6(14.9-22.15)-0.1530.879BUN/(mmol·L-1)4.39(3.95-5.49)4.29(3.73-5.08)-1.0430.297Cr/(μmmol·L-1)53.3(49.3-59.05)54.3(48.7-60.05)-0.0320.974TC/(mmol·L-1)4.93(4.35-5.62)4.89(4.26-5.47)-1.0470.295TG/(mmmol·L-1)1.17(0.9-1.80)1.08(0.80-1.76)-0.6260.531LDL-C/(mmol·L-1)3(2.58-3.64)2.86(2.27-3.50)-0.8000.424Lpa/(mg·L-1)114.5(59.97-271.16)124(55.4-275.95)-0.3060.760
△1 mmHg=0.133 kPa; BMI: body mass index;SBP: systolic blood pressure; DBP: diastolic blood pressure; LH: luteinizing hormone; FSH: follicle-stimulating hormone; AMH: anti-Müllerian hormone; FT: free testosterone; FINS(OH): fasting insulin; FPG: fasting plasma glucose; COR: cortisol; TSH: thyroid-stimulating hormone; ALT: Alanine aminotransferase; AST: Aspartate amino-transferase; BUN: blood urea nitrogen; Cr: creatinine; TC: total cholesterol; TG: triglyceride; LDL-C: low density lipoprotein cholesterol; Lpa: Lipoprotein a.
2.2 两组患者促排卵周期中各项指标比较
促排卵周期中妊娠组成熟卵泡出现的天数晚于未妊娠组,妊娠组成熟卵泡直径、子宫内膜厚度、成熟卵泡出现时的血清E2浓度及血清T浓度,高于未妊娠组,差异有统计学意义(P<0.05)。两组患者促排卵周期中应用的生长激素剂量及HP-HMG的剂量、子宫内膜分型及成熟卵泡出现时的血清FSH、LH、P、PRL浓度比较,差异无统计学意义(P>0.05)。详见表2。
2.3 成熟卵泡性激素浓度对妊娠的影响
以是否妊娠为因变量,以上述分析中有统计学意义的指标为自变量(成熟卵泡直径、子宫内膜厚度、成熟卵泡出现时的血清E2浓度及血清T浓度),进行多因素Logistic回归分析。多因素分析结果表明成熟卵泡的血清E2(1 pg·mL-1)与妊娠关联强度OR=1.003(95%CI:1.001~1.006)。详见表3。
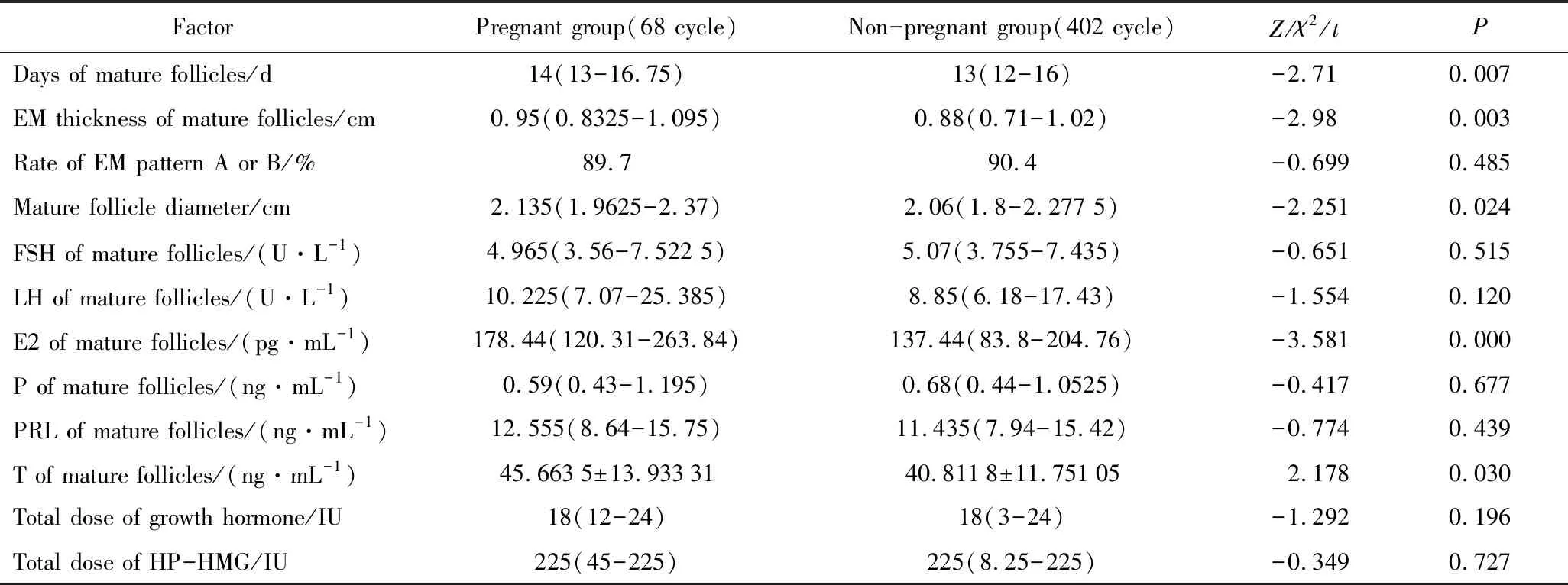
表2 两组患者促排卵周期中各项指标比较

表3 成熟卵泡性激素浓度对妊娠的影响的多因素分析
3 讨论
PCOS是女性最常见的激素紊乱综合征,占无排卵性不孕妇女的80%,排卵障碍是导致PCOS患者不孕的主要原因,PCOS患者常表现为卵泡选择障碍、不能形成优势卵泡,而卵泡发育停留在小窦卵泡阶段[10],因此对于有生育要求的患者促排卵治疗是其成功妊娠的关键。芳香化酶抑制剂——来曲唑是最常用的促排卵药物,与应用氯米芬促排卵治疗相比,应用来曲唑治疗的排卵率、妊娠率及活产率均较高,且多胎妊娠率较低[11-12]。PCOS患者大多合并肥胖,而肥胖又会使得患者的内分泌及代谢紊乱加重,故促排卵治疗前对患者进行减重及生活方式干预的综合预处理治疗可以改善患者的临床症状、降低高雄激素血症及恢复排卵[13-14]。
在正常女性的月经周期中,卵泡的生长受促性腺激素的调节,卵泡产生的雌、孕激素呈规律性变化,同时反馈性影响促性腺激素的分泌。早卵泡期E2处于较低浓度,随着优势卵泡成熟,E2浓度逐渐升高并达到峰值。有研究[15]证实过低的E2浓度不利于妊娠,通过监测E2浓度可以对促排卵治疗的妊娠结局起到很好的预测作用,对改进促排卵方案起到重要帮助作用。研究[5,14]表明雄激素浓度也有周期性改变,在控制性超促排卵中,当有多个卵泡发育成熟时,雄激素浓度会相应升高。
本研究通过对PCOS不孕患者促排卵周期中成熟卵泡的性激素六项的监测,得出妊娠组的E2浓度明显高于未妊娠组,178.44(120.31~263.84)vs137.44(83.8~204.76)(P<0.05),并且成熟卵泡的血清E2(1 pg·mL-1)与妊娠关联强度OR=1.003(95%CI:1.001~1.006),当卵巢中的一个卵泡发育成熟且质量较高时,血清中的E2浓度可能升高至每毫升数百皮克,表明高E2浓度越高预测卵泡质量越好,且对成功妊娠起到积极作用。与以往的研究[10,15]结果相似;通常在卵泡发育过程中,随着卵泡体积的增大及个数增多,T浓度逐渐升高[16],支持本研究中妊娠组成熟卵泡的T浓度明显高于未妊娠组;促排卵后成熟卵泡出现的天数妊娠组晚于未妊娠组,妊娠组成熟卵泡的直径明显大于未妊娠组,表明卵泡大小与卵泡的质量呈正相关[17];成熟卵泡出现的子宫内膜厚度妊娠组明显高于未妊娠组0.95(0.832 5~1.095) cmvs0.88(0.71~1.02)(P<0.05),为比较适宜受精卵着床的厚度[18],本研究中患者均为年轻女性,平均年龄为28~32岁,均无内、外科合并症,促排卵前的糖脂代谢、肝肾功能指标均大致正常,比较各项指标差异无统计学意义,故促排卵前应给与患者合理的孕前管理,通过口服复方避孕药、减重及生活方式干预等综合预处理治疗,明显提高促排卵治疗的妊娠成功率,降低早期流产率及孕晚期合并症的发生[8,14,19]。已有研究[8,20]证实妊娠的PCOS女性的血清AMH浓度与E2浓度呈正相关,妊娠女性的血清AMH及E2浓度均明显升高,与本研究结果一致:妊娠组患者的AMH及E2浓度明显高于未妊娠组。本研究均采取来曲唑联合HP-HMG促排卵方案,促排卵治疗周期中通过监测成熟卵泡的性激素六项、卵泡大小指导临床应用HP-HMG的剂量,提高妊娠成功率的同时避免了多胎妊娠及卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)[21]等严重不良反应的发生。
综上所述,对PCOS患者促排卵治疗周期中成熟卵泡的性激素六项尤其是E2的监测,对临床应用HP-HMG剂量及患者同房的最佳时机起到指导作用,增加患者促排卵治疗的临床妊娠率、降低早期流产率及不良反应发生率。

