铅与孔雀石绿的显色系统研究及其在水质在线监测仪中铅的检测应用
陈利娜
【摘 要】随着社会的发展, 环境污染日益严重。一些重金属造成的污染, 对人体健康造成严重威胁。铅是一种容易在生物体内积蓄的有毒金属, 人体通过水、空气、食物等吸收的铅含量达到一定量后, 会引起贫血、肾损伤等疾病。所以, 对环境样品中微量铅进行在线监测具有重要意义。目前测定微量铅的方法有原子吸收光谱法和分光光度法等,分光光度法是目前應用较多的方法。
【关键词】铅;孔雀石绿;分光光度法
【Abstract】With the development of society, the environmental pollution has become more and more serious. The pollution caused by some heavy metals is a serious threat to human health. Lead is a kind of toxic metal that is easy to accumulate in organism. When the lead content absorbed by human body through water, air and food reaches a certain amount, it will cause anemia, kidney damage and other diseases. Therefore, on-line monitoring of trace lead in environmental samples is of great significance. At present, there are many methods for the determination of trace lead, such as atomic absorption spectroscopy and spectrophotometry, and spectrophotometry is a widely used method at present.
【Keywords】lead; malachite green; spectrophotometry
1 材料和方法
1.1 仪器与试剂
1.1.1 仪器
752N 紫外可见分光光度计,上海精密科学仪器。
1.1.2 试剂
①0.25mol/L的硝酸:在1000ml烧杯中倒入700ml纯水,加入16ml硝酸,之后转移到1000ml容量瓶中,并用纯水定容至1000ml。
②1000mg/l铅标准储备液:在1000ml烧杯中倒入700ml纯水后加入1.598g硝酸铅,待溶解后加入10ml硝酸,之后转移到1000ml容量瓶中,并用纯水定容至1000ml。
③10mg/l铅标准溶液:取铅标准储备液溶液10ml,转移到1000ml容量瓶中,并用纯水定容至1000ml。
④8.3%盐酸:在1000ml容量瓶中加入800ml纯水,后加入83ml盐酸,用纯水定容至1000ml。转移到塑料瓶中,密封保存。
⑤缓冲液:首先是0.1M pH 4.7缓冲储备液。在一个1000ml烧杯中倒入800ml纯水,后加入13.6g乙酸钠,待溶解后加入5.7ml乙酸,使pH在4.7~4.8之间,之后转移到1000ml容量瓶中,并用纯水定容至1000ml。
其次是2M pH 4.7缓冲储备液。在一个1000ml烧杯中倒入800ml纯水,后加入272g乙酸钠,待溶解后加入乙酸使pH达到4.7,大约加入乙酸116ml,之后转移到1000ml容量瓶中,并用纯水定容至1000ml。
⑥碘化钾+抗坏血酸:在250ml烧杯中加入150ml 2M pH 4.7缓冲储备液,后加入1.25g抗坏血酸、83g碘化钾,待溶解后转移到250ml容量瓶中,并用2M pH 4.7缓冲储备液定容至250ml,转移到塑料瓶中。
⑦显色剂:在250ml烧杯中倒入150ml 0.1M pH 4.7缓冲储备液,后加入0.0825g孔雀石绿,待溶解后转移到250ml容量瓶中,并用0.1M pH 4.7缓冲储备液定容至250ml。转移到塑料瓶中。
⑧5%的盐酸羟铵:取烘干后的盐酸羟铵5g溶解于纯水中,用纯水定容至100ml。
1.2 试验方法
1.2.1 酸用量的确定
取1ml,5mg/l的铅标准溶液于比色管中,定容至10ml。加入8.3%的盐酸量依次为0、1、2、3、4、5ml;加入1ml碘化钾溶液,1ml显色剂,700nm处测其吸光度值。
1.2.2 碘化钾用量的选择
取1ml,5mg/l的铅标准溶液于比色管中,定容至10ml。加入8.3%盐酸3ml;加入1ml碘化钾溶液;1ml显色剂,700nm处测其吸光度值。
1.2.3 标准曲线的绘制
移取浓度为10mg/l铅标准液1、2、3、4、5ml于10ml比色管中,用纯净水定容10ml,分别得到浓度为1、2、3 、4 、5 mg/l铅标准溶液。然后依次加入3ml8.3%的盐酸,2ml碘化钾-抗坏血酸,1ml显色剂,绘制标准曲线,以试剂空白作参比,700nm处测其吸光度值,作吸光度值对铅浓度的标准曲线,求出直线回归方程。
1.2.4 反标实验
移取浓度为10mg/l铅标准液1、1.1、1.5、1.8ml于10ml比色管中,用纯净水定容10ml,分别得到浓度为1、1.1、1.5、1.8mg/l铅标准溶液。然后依次加入3ml8.3%的盐酸,2ml碘化钾-抗坏血酸,1ml显色剂,700nm处测其吸光值,求出其示值误差。
1.2.5 Cd2+干扰影响测试
①移取浓度为10mg/l铅标准液1、2、2.5、3ml于10ml比色管中,用纯净水定容10ml,分别得到浓度为1、2、2.5 、3mg/l铅标准溶液。然后依次加入加入1ml盐酸羟铵量,3ml8.3%的盐酸,2ml碘化钾-抗坏血酸,1ml显色剂,700nm处测其吸光值,求出其示值误差。
②移取浓度为10mg/l铅标准液1、1.2、1.5、1.8ml于10ml比色管中,用纯净水定容10ml,分别得到浓度为1、1.2、1.5 、1.8mg/l铅标准溶液。然后依次加入2ml盐酸羟铵量,3ml8.3%的盐酸,2ml碘化钾-抗坏血酸,1ml显色剂,700nm处测其吸光值,求出其示值误差。
2 结果与讨论
2.1 酸用量的影响
实验表明,8.3%盐酸在用量为2~3ml时,吸光度趋于稳定,若在增加盐酸用量吸光度值降低,因此选择浓度8.3%的盐酸用量为3ml。
2.2 碘化钾用量的影响
实验表明,当碘化钾-抗坏血酸用量为1.5~2.5 ml时吸光度趋于稳定,若增加其用量吸光度出现大幅增加,且不稳定,因此碘化钾-抗坏血酸的最佳用量选定为2 ml。
2.3 标准曲线
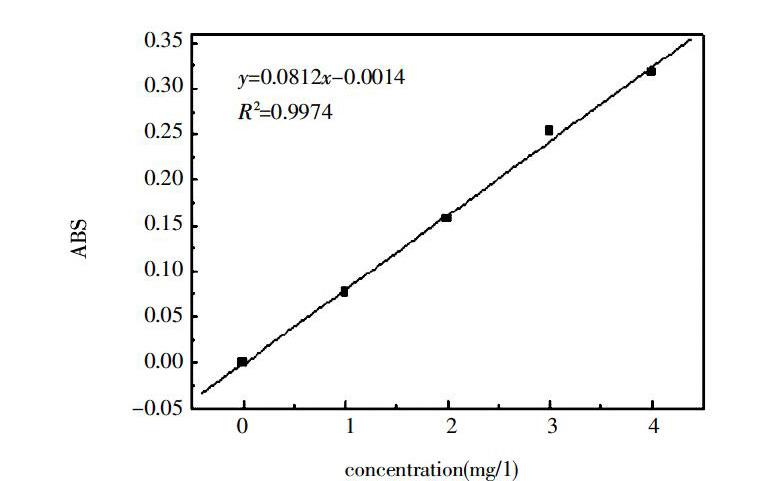
以铅离子浓度为横坐标,吸光度A为纵坐标,如图1,建立标准曲线,在0~4mg/l范圍内,铅离子浓度与吸光度有良好的线性关系,符合朗伯比尔定律,回归方程:y=0.0812x-0.0014,R2=0.9974。
2.4 低浓度反标实验
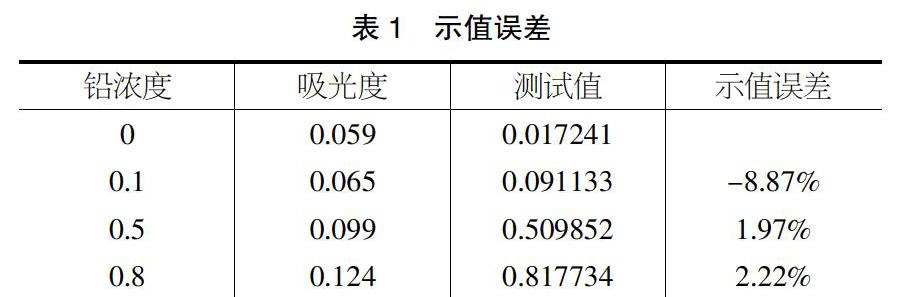
表1实验结果表明,低浓度反标实验符合铅在线监测仪测试标准要求,测试范围为0.2~1mg/l。
2.5 Cd2+干扰影响测试
结果表明,镉离子对铅的干扰可以通过加入一定量得盐酸羟铵来消除,铅浓度大于1mg/l时,加入盐酸羟铵量为1ml,铅浓度低于1mg/l时,Cd2+影响较大,盐酸羟铵加入量为2ml,测试结果满足行业标准的±15%的要求。
3 结语
①分光光度法,孔雀石绿与铅的显色反应。确认铅与孔雀石绿显色的酸性条件,用盐酸调节酸度,通过吸光度确认浓度为8.3%的盐酸用量为3ml。通过吸光度变化确认碘化钾—抗坏血酸用量为2ml,碘化钾为反应过程中提供过量碘离子,抗坏血酸为掩蔽剂,掩蔽其他金属干扰离子。显色剂孔雀石绿的用量定为1ml,因为其本身作为一种染料,色泽较深,若加入量过大会影响溶液吸光度。
②通过单因素实验,选定最佳测试方法,绘制标准曲线。标准曲线:y=0.0812x-0.0014,R2=0.9974,符合朗伯比尔定律。由于以铅浓度为0mg/l作为零点,对于低浓度的测定不理想,因此将曲线零点定为1mg/l,即增加水样中铅的本底浓度,使得测试低浓度时也符合线性关系,达到测试要求。在检测水样时加入定量铅,保证铅本底浓度为1mg/l。
③根据铅在线监测仪测试标准要求,低浓度示值误差符合要求。以铅浓度大于1mg/l和小于1mg/l确定掩蔽剂盐酸羟铵用量屏蔽Cd2+干扰,测试结果满足行业标准的±15%的要求。
【参考文献】
【1】向国强,罗一凡.固相萃取-火焰原子吸收光谱法测定食品样品中痕量铅[C]//全国青年分析测试学术报告会,2008.

