野生Paxillus ammoniavirescens 菌的分子鉴定及生物学特性研究
杜 萍,凃 慧,蒋佳颖,崔宝凯,戴玉成*
(1.长江师范学院现代农业与生物工程学院,重庆 408100;2.北京林业大学微生物研究所,北京 100083)
Paxillus ammoniavirescens (Contu & Dessi) 在分类学上属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、牛肝菌目(Boletales)、网褶菌科(Paxillaceae)、网褶菌属(Paxillus)。Paxillus Fr.属在北半球分布广泛,与多种寄主树木如杨、桦、栎、椴树、云杉、冷杉等形成外生菌根关系[1-2]。
网褶菌属种类富含褐色色素,受伤则变褐棕色,Paxillus involutus (Batsch) Fr.是“舒筋散”中药的重要成分之一,有治腰腿疼痛、手足麻木、祛风散寒、舒筋活络等功效。该属很多种类在记载中有毒[3]或生吃有毒[4-5],可出现胃肠道病症[3],但在我国北方一些地区却广泛采食[6]。P.involutus 在前苏联时期曾被大量腌制后食用,在中欧、德国等地均有食用,但在德国和波兰等国曾发生食用者中毒现象[7]。据报道,摄入该菌后可造成免疫溶血甚至致命[8-9]。肖冬来等人[10]已在P.ammoniavirescens 中检测出有溶血素蛋白。然而,根据不同国家的观察者的经验,对该菌和其他近缘种是否有害的评估是不同的。“毒性”评估的差异可能取决于物种的差异鉴定。
P.involutus 是研究最广泛的外生菌根 (ECM)真菌之一。该菌在北半球发生普遍,与许多针叶树和落叶树形成外生菌根[2]。该菌在形态学、生理学和生态学等有关表型性状上表现出明显的变异,也是伞菌纲外生菌根菌生态学或生理学研究的一个重要模式种[11]。在生物修复重金属污染方面,植物和真菌形成的菌根共生体已显示出巨大的应用潜力[12]。菌根真菌可提高宿主植物对重金属的耐受性,在缓解植物受重金属毒害方面具有重要作用[13-15]。P.involutus 不仅能与耐镉植物灰杨(Populus tremula ×P.alba) 形成外生菌根,提高灰杨对Cd2+的吸收和耐受能力[16],其本身也具有较强的Cd2+富集能力[17]。抗盐菌根菌Paxillus 在盐胁迫下具有维持K+/Na+平衡的能力,可提高树木耐盐性[18]。
Paxillus 属的特点是难以进行物种鉴定,导致再生困难,因此,需要大量的菌种[1]。为了更好地了解、保护、开发大型野生食用菌资源,有必要对该物种的分类问题进行深入研究。目前,内转录间隔区ITS (internal transcribed spacer) 基因序列分析法广泛应用于野生真菌的鉴定和分类中,是一种非常可靠的方法。目前,国内缺少对网褶菌属的分子系统研究,已有资料多是关于其可食性和生态学特性方面[19-20]。国外对网褶菌属研究较多,常将P.involutus 作为外生菌根菌研究的模式种[21]。目前,关于P.involutus 和P.rubicundulus P.D.Orton 的基因组已经完全测序[22-23]。本研究从黑龙江农业经济职业学院校园内分离获得一株野生网褶菌属菌株,拟通过分子鉴定以及生物学特性研究,为进一步开发利用提供理论基础。
1 材料与方法
1.1 供试样品
供试野生菌样品(图1)于2014 年9 月采自黑龙江省牡丹江市黑龙江农业经济职业学院校园内云杉(Picea asperata Mast.)树根部周围,菌样编号为DP20140901。
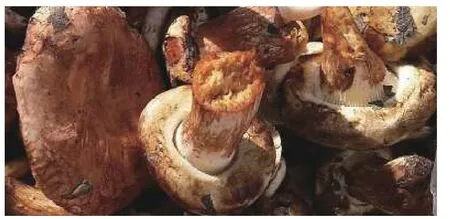
图1 野生蘑菇新鲜子实体Fig.1 Fresh fruiting bodies of the wild mushroom
1.2 子实体形态观察
取子实体完整部分,观察并描述其表面性状、结构、颜色、质地,进行形态学特征初步鉴定。
1.3 菌种分离
采用子实体组织分离法分离菌种,在PDA 平板上培养8~10 d 后,挑取菌落边缘菌丝体进行转接和纯化培养,于25 ℃恒温培养箱中培养2 周,置于4 ℃冰箱保存备用。
1.4 样品rDNA ITS 区段的PCR 扩增、测序及分析
1.4.1 样品基因组DNA 提取与检测 菌丝体培养、收集及DNA 提取和检测方法详见文献[24]。
1.4.2 样品rDNA ITS 区段的PCR 扩增与测序 采用真菌通用引物ITS5: 5′-GGAAGTAAAAGTCGT AACAAGG-3′;ITS4: 5′-TCCTCCGCTTATTGATA TGC-3′,由英骏生物技术有限公司(invitrogen)合成[25]。PCR 扩增体系为:10 × Buffer 5 μL,25 mmol·L-1MgCl24 μL,4 mmol dNTPs 3 μL,5 U·μL-1Taq DNA polymerase 0.5 μL,10 μmol·L-1引 物 各2 μL,模板DNA 2 μL,ddH2O 31.5 μL,反应总体积为50 μL。扩增条件:94 ℃预变性1 min;94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1.5 min,共30 个循环;最后于72 ℃延伸8 min,终止温度为4 ℃。扩增产物经1.5%琼脂糖凝胶电泳检测,产物和Marker 上样量均为5 μL,电泳结果于Bio-Rad 凝胶成像系统成像。PCR 扩增产物送交华大基因(北京)公司测序。
1.4.3 ITS 序列分析与系统发育树构建 将测序获得的ITS 序列通过NCBI 进行Blast 搜索,分析同源性。选择与供试菌株ITS 序列相似度99%以上的23 条序列,以黑木耳Auricularia heimuer F.Wu,B.K.Cui, Y.C.Dai 的ITS 序列[26]为外群构建系统发育树,采用Clustal X 1.83 程序进行多序列匹配排列,然后通过MEGA-X 程序中的Neighbor-Joining (NJ) 方法、采用Jukes-Cantor 计算模型构建系统发育树,进行1 000 次Bootstrap 可信度分析,Kimura 2-parameter 法计算遗传距离,空位作为完全缺失处理。
1.5 生物学特性分析
1.5.1 碳源对Paxillus ammoniavirescens 菌丝体生长的影响 试验碳源:麦芽糖、甘露醇、可溶性淀粉、蔗糖、葡萄糖为分析纯。此外,采用市售玉米粉作为碳源之一。
无碳基础培养基:KH2PO41.0 g,MgSO40.5 g,蛋白胨2 g,琼脂18 g,水1 L。分别以等量的(2%)麦芽糖、甘露醇、可溶性淀粉、玉米粉、蔗糖、葡萄糖加入到无碳基础培养基中。对P.ammoniavirescens 母种培养基中碳源进行单因素筛选试验。各设4 个重复。接种菌饼后置于25 ℃下恒温培养。接种2 d 后开始记录菌丝体生长速度,观察记录菌落特征、生长势等。其中菌丝体生长速度= 菌落半径(mm)/菌丝生长天数(d)。菌丝体日均生长速度差异显著性采用SPSS 16.0 软件中Duncan 式新复极差法进行分析。
1.5.2 氮源对Paxillus ammoniavirescens 菌丝体生长的影响 试验氮源:牛肉膏、硫酸铵、酵母膏、蛋白胨为分析纯。此外,采用市售麦麸和黄豆粉作为有机氮源。
无氮基础培养基:葡萄糖20 g,KH2PO41.0 g,MgSO40.5 g,琼脂18 g,水1 L。分别以等量的(0.2%)牛肉膏、麦麸、硫酸铵、酵母膏、黄豆粉、蛋白胨加入到无氮基础培养基中。对卷边网褶菌母种培养基中氮源进行单因素筛选试验。其余方法同上。
1.5.3 温度对Paxillus ammoniavirescens 菌丝体生长的影响 将含有最适碳源和氮源的无菌培养基制成平板,接种菌饼后,分别置于21、23、25、27、29、31 ℃的恒温培养箱中暗培养,其余方法同上。
1.5.4 pH 对Paxillus ammoniavirescens 菌丝体生长的影响 采用1 mol·L-1HCl 或NaOH 溶液,将含有最适碳源和氮源的液体培养基(可溶性淀粉20 g,蛋白胨2 g,KH2PO41.0 g,MgSO40.5 g,水1 L)调配为pH 2.0~8.0 共13 个处理(间隔0.5),每250 mL 三角瓶装液量为30 mL,每个处理4 次重复,于25 ℃恒温培养箱中静止培养。培养两周测量菌丝体干质量,并记录菌丝体长势、菌丝体及发酵液颜色变化等。
1.5.5 碳源、氮源、无机盐对Paxillus ammoniavirescens菌丝体生长的影响 从碳源(可溶性淀粉)、氮源(蛋白胨)和无机盐(KH2PO4和MgSO4)中各选出3 个水平,进行四因素三水平的正交试验,以确定各组分的最佳使用量。250 mL 三角瓶的装液量为50 mL,灭菌前用1 mol·L-1HCl 或NaOH 溶液调节培养液为pH 4.5,接种菌饼后于25 ℃恒温培养箱中静止培养20 d,其余方法同1.5.4。
2 结果与分析
2.1 子实体形态观察
菌盖半球形,平展或中央下凹近漏斗状,边缘内卷,直径4~15 cm。幼菇菌盖表面微粘,成熟后干燥,中央多成龟裂状。菌盖多绒至平滑,黄至红褐色。菌肉厚,黄褐色,伤后变红变褐黑色。菌褶延生,黄褐色,伤后初转红再转黑褐色。菌柄圆柱状,上下同粗,长4~8 cm,直径1~2 cm,表面光滑,颜色同菌盖,实心。子实体有特异性气味。经查阅图鉴,初步判定为网褶菌属种类[20]。
2.2 ITS 序列及系统发育分析
经测序获得菌株ITS 区域核苷酸序列总长为746 bp,将样品ITS 序列(序列号是MG571758)输入NCBI 系统,用Blast 进行搜索比对,结果有23 株核酸序列与其具有99%以上的相似度,分别来自英国、美国、德国、法国、加拿大、澳大利亚、爱尔兰、西班牙、意大利、波兰等国家,没有发现中国的报道;宿主及生长环境有椴树(Tilia)、栎树(Quercus)、桦树(Betula)、杨树(Populus)、公园、草原等地(表1)。当物种的rDNA ITS 区序列与比对序列同源性≥99%时,可认为相同种[27]。因此,鉴定该株野生菌为Paxillus ammoniavirescens。它的5.8 S 和内转录间隔区2(ITS 2)具有高度保守性,5.8 S 编码序列一般为158 bp,ITS 2 一般为229 bp;内转录间隔区1(ITS 1)序列中度保守,在275 bp 左右;18 S和28 S 基因序列变化幅度较大。ITS 序列在655~746 bp 左右。
从图2 系统发育树可以看出,所有分析菌株共分为4 类,即P.ammoniavirescens,P.obscurisporus,P.involutus 和P.cuprinus,而实验菌株与P.ammoniavirescens 种类聚为一枝,因此,被鉴定为P.ammoniavirescens。
2.3 碳 源 对Paxillus ammoniavirescens 菌 丝 体 生长的影响
由表2、图3 可见,P.ammoniavirescens 菌丝体在供试碳源培养基上均能生长,菌丝体颜色因碳源种类不同而呈浅黄至黄灰色(图3)。在0.05 水平上,菌丝体日均生长速度差异显著(表2),其中在可溶性淀粉和葡萄糖培养基上日均生长速度最快,菌丝体浓密,长势强;其次是甘露醇、蔗糖为碳源的培养基,菌丝体较密,生长整齐,与玉米粉培养基上的菌丝体日均长速差异不显著;而在无碳基础培养基(CK)上生长速度最慢,菌丝体稀疏,颜色浅,长势弱。可见,P.ammoniavirescens菌丝体生长对碳源的需求量较大,且来源广泛。此外,菌丝体颜色因碳源种类不同而呈浅黄至黄灰色,说明碳源种类不同影响 P.ammoniavirescens 菌丝体的颜色。
2.4 氮 源 对Paxillus ammoniavirescens 菌 丝 体 生长的影响
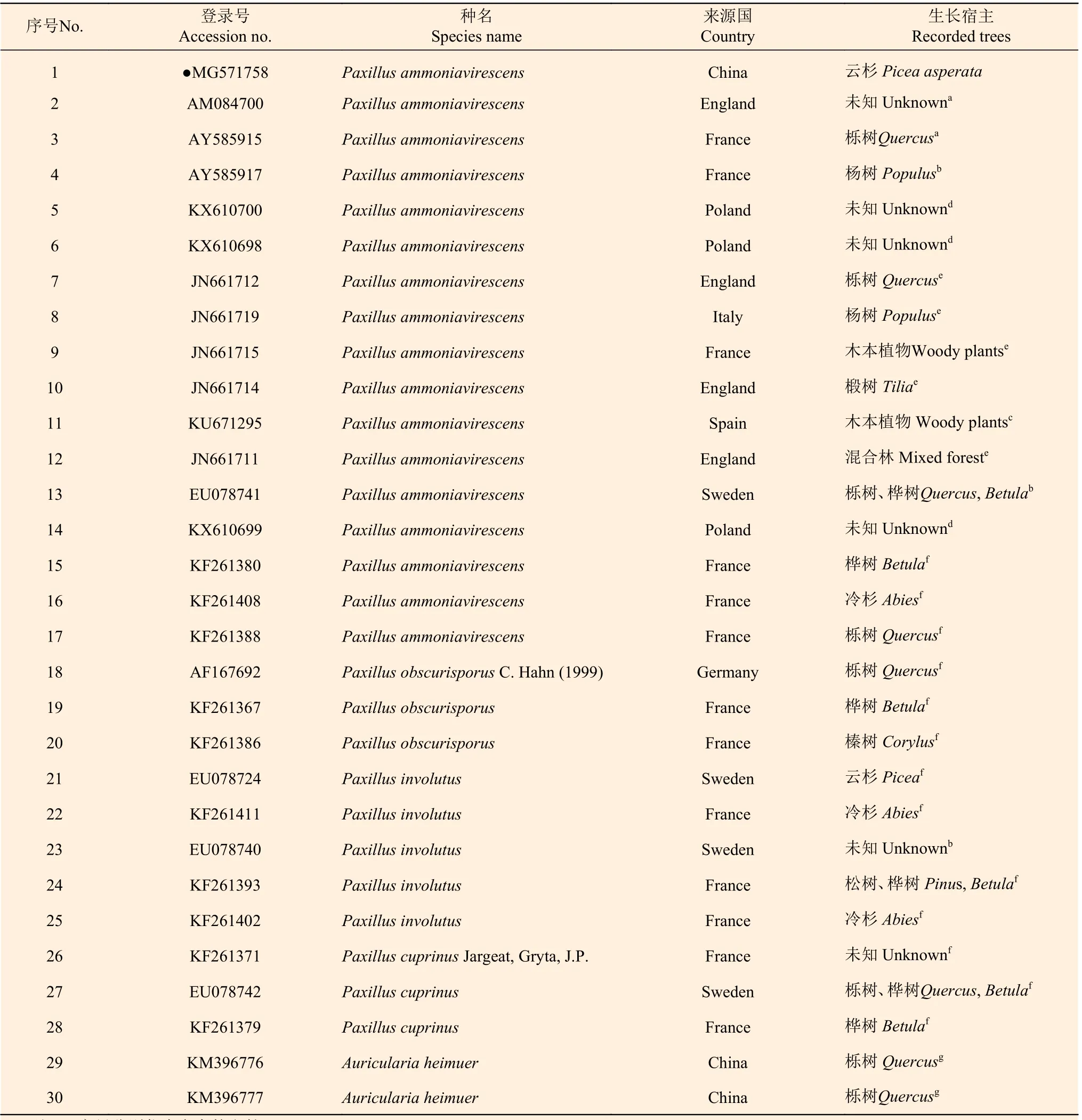
表1 本研究中使用的物种来源和ITS 区域的GenBank 序列号信息Table 1 A list of species, origin and GenBank accession number of ITS sequences used in this study
试验菌株菌丝体在不同氮源培养基上均能生长,颜色因培养基种类不同而呈浅黄至黄褐色,并有不同程度的褐色素分泌。在0.05 水平上,菌丝体的日均生长速度差异显著(表3),其中在蛋白胨培养基上日均生长速度最快,菌丝体浓密,粗壮,边缘生长整齐,菌丝体日均生长速度为0.857 mm·d-1;其次是麦麸和黄豆粉为氮源的培养基,但菌丝体生长较稀疏;在酵母膏培养基上菌丝体生长浓密,但长速较慢。而在无氮基础培养基(CK)中生长速度最慢,菌丝体稀疏,颜色浅,可见,P.ammoniavirescens 菌丝体生长对氮源种类要求较严格。

图2 基于ITS 序列构建的系统发育树Fig.2 Phylogenetic tree based on ITS sequences
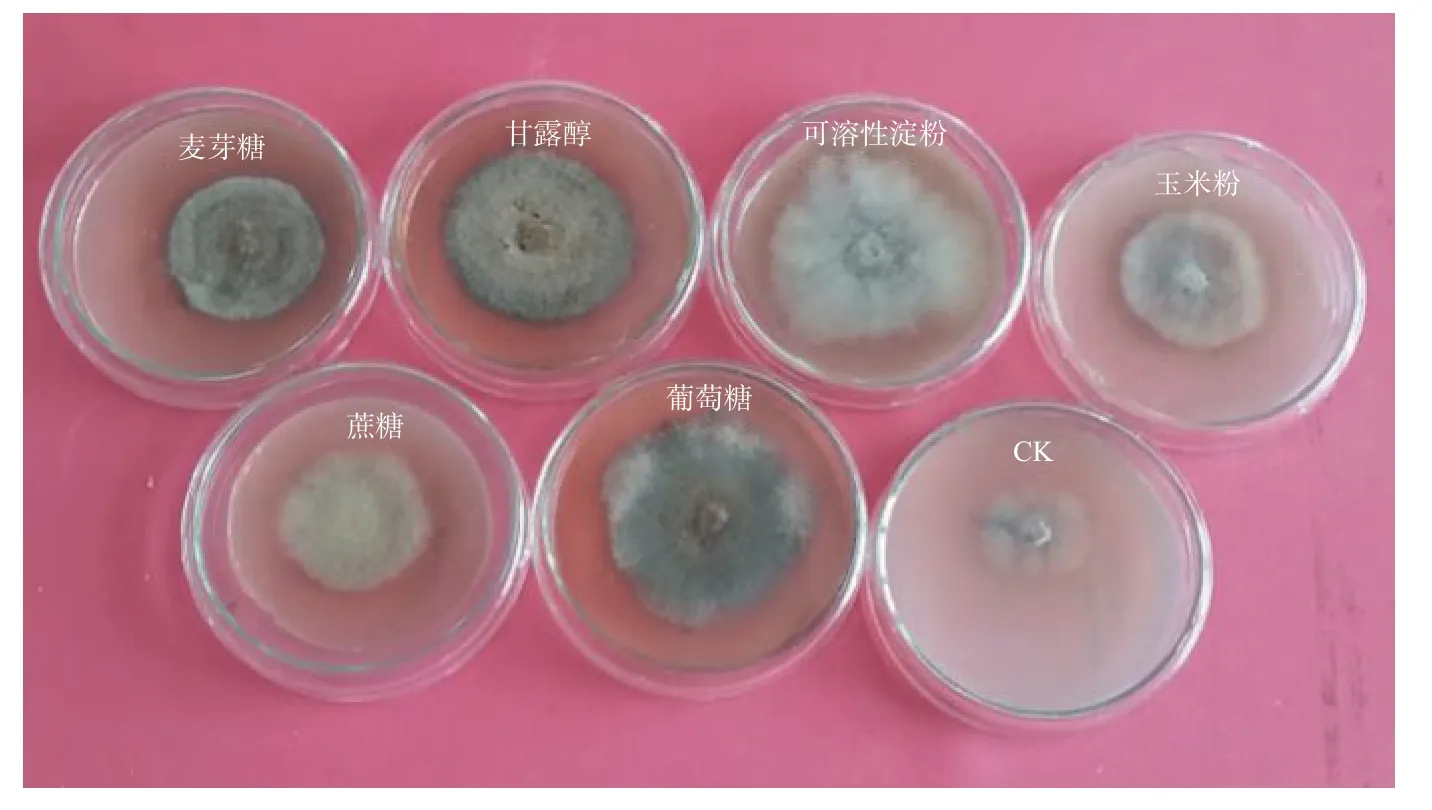
图3 Paxillus ammoniavirescens 菌丝体在不同碳源培养基上的生长情况Fig.3 Paxillus ammoniavirescens growing on various carbon media
2.5 温度对Paxillus ammoniavirescens 菌丝体生长的影响
由表4 可见,试验菌株通过不同温度试验表明,试验菌株在21~29 ℃范围内均能生长,其中25 ℃时生长速度最快,长势最好,其次为27 ℃,而31 ℃时菌丝体不生长,表明P.ammoniavirescens菌丝体生长对温度要求严格,过高或过低均不利,且适宜生长温度范围较窄。
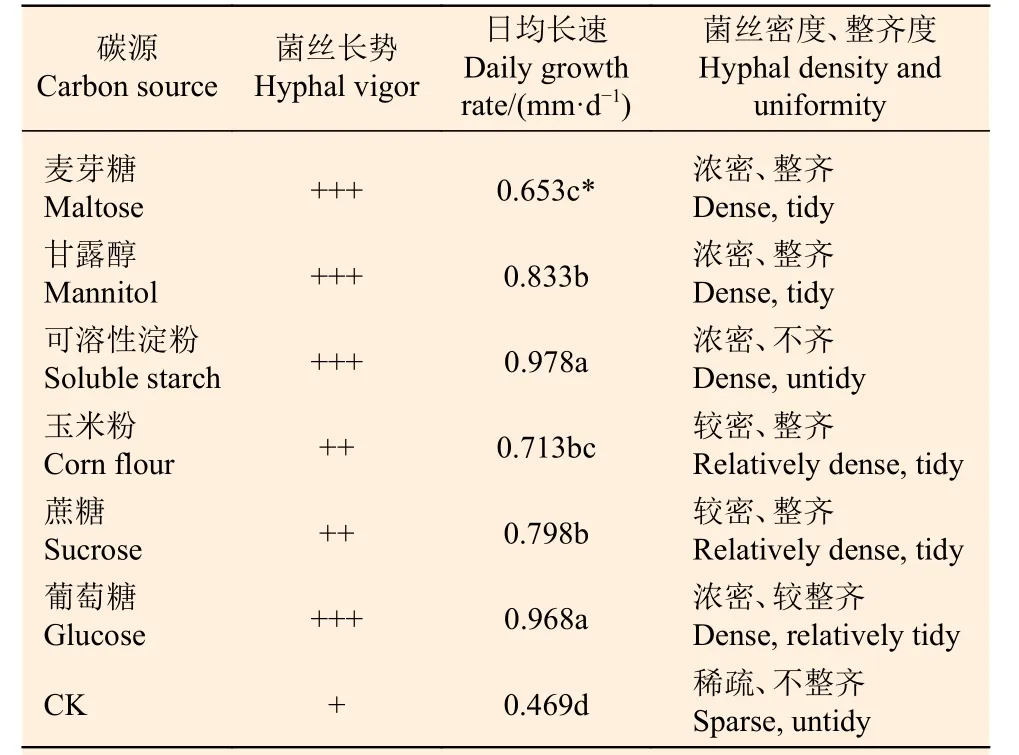
表2 碳源对Paxillus ammoniavirescens 菌丝体生长的影响Table 2 Effect of carbon sources on mycelial growth of Paxillus ammoniavirescens
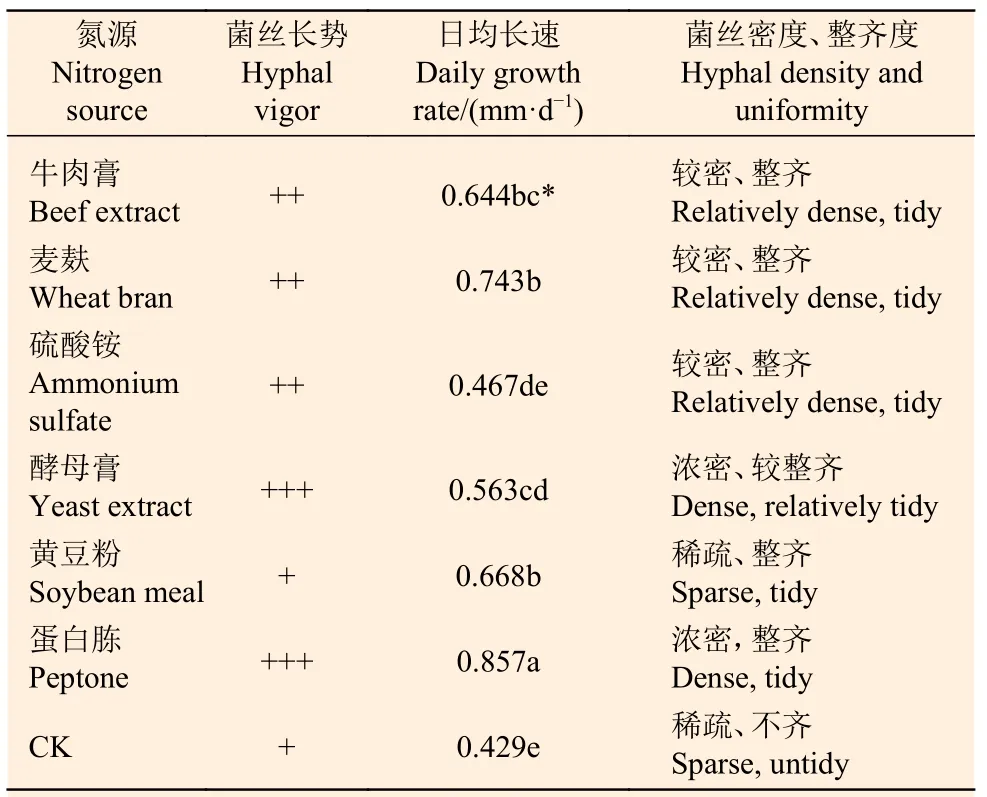
表3 氮源对Paxillus ammoniavirescens 菌丝体生长的影响Table 3 Effect of nitrogen sources on mycelial growth of Paxillus ammoniavirescens
2.6 pH 对Paxillus ammoniavirescens 菌丝体生长的影响
由表5 可以看出,试验菌株菌丝体在pH 2.0~6.0 范围内均能生长,其中在pH 4.5 时长势最好,菌丝体干质量均高于其他处理;当pH 大于5.0 时菌丝体生长速度逐渐减慢,菌丝体生物量减少,当pH≥6.5 时菌丝体几乎不生长,说明P.ammoniavirescens 喜欢偏酸性环境条件,且适宜生长的酸碱度范围较窄。
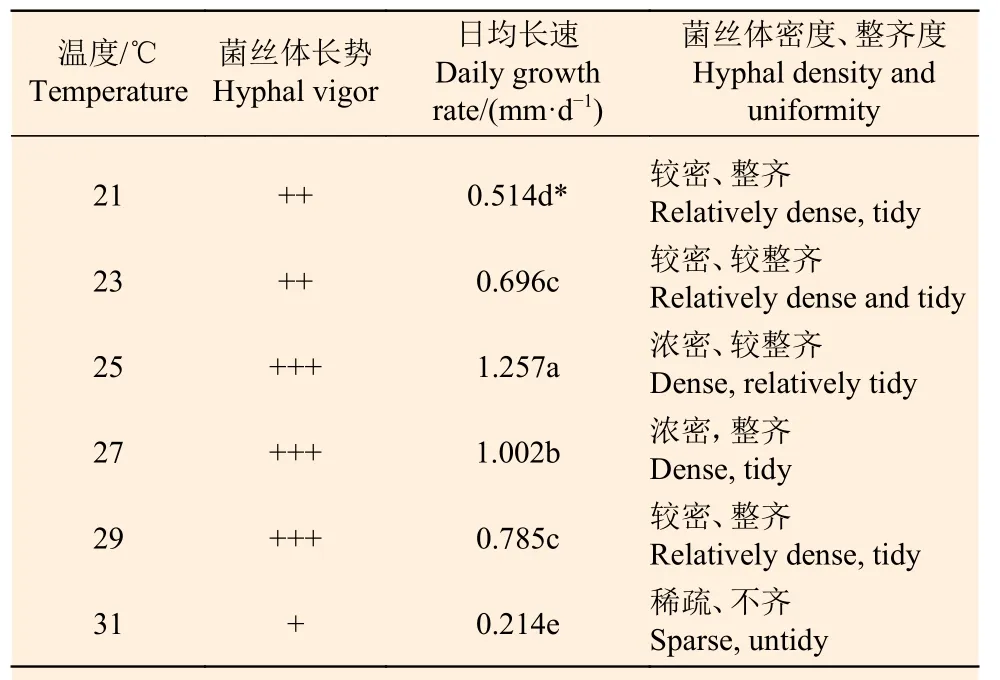
表4 温度对Paxillus ammoniavirescens 菌丝体生长的影响Table 4 Effect of temperature on mycelial growth of Paxillus ammoniavirescens
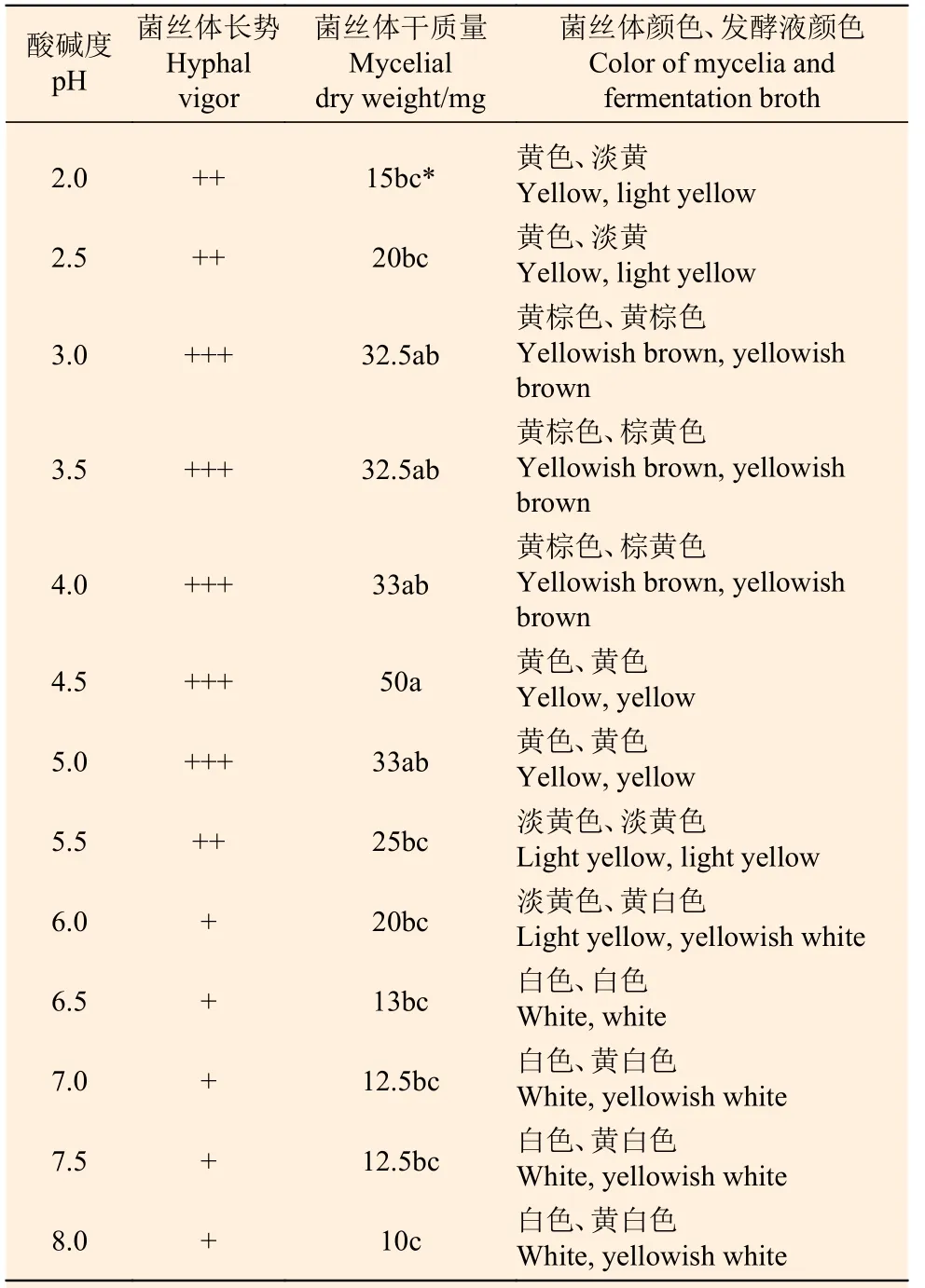
表5 酸碱度对Paxillus ammoniavirescens 菌丝体生长的影响Table 5 Effect of pH on mycelial growth of Paxillus ammoniavirescens
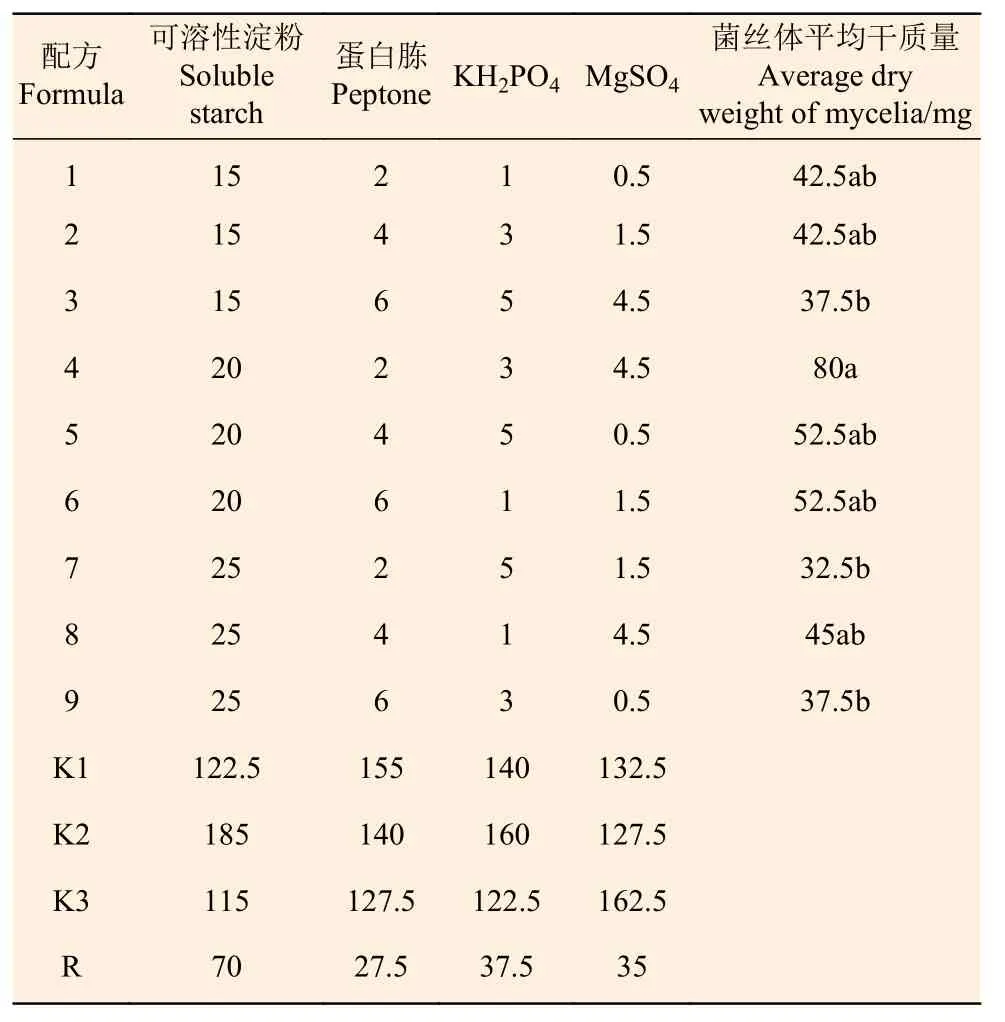
表6 不同碳源、氮源、无机盐用量对Paxillus ammoniavirescens 菌丝体生长的影响Table 6 Effect of different amount of carbon, nitrogen and inorganic salt on mycelial growth of Paxillus ammoniavirescens

图4 Paxillus ammoniavirescens 菌丝体在不同碳源、氮源和无机盐用量培养基中的生长情况Fig.4 The growth of Paxillus ammoniavirescens mycelia in liquid media with different amount of carbon, nitrogen and inorganic salt
2.7 菌丝体培养最适碳源、氮源及无机盐用量
由表6 可以看出,P.ammoniavirescens 菌丝体在不同碳源、氮源、无机盐用量的培养基中长势良好,菌丝体及发酵液颜色变化不明显(图4)。其中配方4 的菌丝体干质量最大,为80 mg,与配方1、2、5、6 和8 的菌丝体干质量差异不明显,与配方3、7 和9 的菌丝体干质量差异显著。由正交试验优化的菌丝体培养的最佳组合为:A2B1C2D3,即可溶性淀粉20 g,蛋白胨2 g,KH2PO43.0 g,MgSO44.5 g,水1 L,pH 4.5。由极差分析可知,各营养因素对菌丝体干质量影响的大小顺序为:可溶性淀粉>KH2PO4>MgSO4>蛋白胨。
3 讨论
通过rDNA ITS 序列测定和分析,证明试验菌株为P.ammoniavirescens。在欧洲,Paxillus 属可分为P.involutus complex 和P.rubicundulus,后者主要发生在湿地生境中,且只与桤木(Alnus spp.,Betulaceae)有关[32]。而P.involutus complex 种类则分布在更多样的生境中,并与多种树种有一定的联系。因此,寄主特异性是鉴别P.rubicundulus 的一种有效特征,但在P.involutus 复合种中进行种类鉴别仍然十分困难[21]。Fries[33]认为P.involutus存在着3 个相互兼容的类群,第一类子实体主要分布在针叶林和落叶林中(森林组),第二组和第三组主要分布在公园和花园区域(公园组)。然而,这些群体的子实体之间没有明显的形态学差异,因此,被称为P.involutus 同形种(隐蔽种)。不同作者对rDNA 的系统发育分析[1,11,21,31]证实了5 种不同的物种存在于P.involutus complex 中: P.involutus,P.ammoniavirescens, P.cuprinus, P.obscurosporus和P.vernalis Watling (1969)。其中,根据形态特征进行鉴别是极其困难的。
Hedh et al.[11]鉴 定EU078741,AY585915,AY585917 为P.validus,而Jargeat et al.[21]则鉴定是P.ammoniavirescens,Anderson & Parkin[28]鉴定AM084700 为 P.involutus,且 与 AY585915 有99.7%的相似度,在NCBI 中比对AY585915 也是P.involutus,即同一号菌株AY585915 曾被鉴定为3 个不同种,进一步说明在P.involutus 复合种中进行种类鉴别十分困难。
本研究发现,P.ammoniavirescens 在可溶性淀粉培养基上气生菌丝体生长旺盛,在葡萄糖、麦芽糖、甘露醇培养基上分泌较多褐色素,菌丝颜色较深,而在蔗糖、可溶性淀粉和玉米粉培养基上分泌褐色素较少,颜色浅。在氮源筛选中发现多数菌丝体在培养中后期有黄褐至黑褐色素形成,尤其在牛肉膏和硫酸铵培养基中分泌较多褐色素,说明培养基成分影响菌丝体的颜色和褐色素的形成。P.ammoniavirescens 菌丝体培养中后期气生菌丝旺盛,浓密、粗壮、分枝明显,初期灰褐色,随培养时间的延长而呈黄褐色,褐色素分泌严重,并有少许硬质颗粒(菌核)形成(图5)。P.ammoniavirescens 子实体受伤会变褐棕色,而菌丝体在固体培养基中分泌的褐色素可能与其有关,或许具有某种特殊的药用成分。
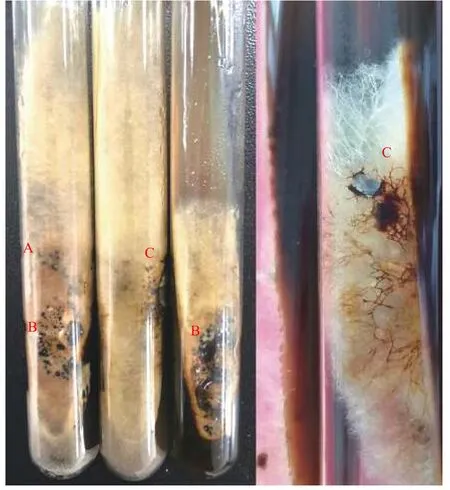
图5 Paxillus ammoniavirescens 培养中后期菌落特征Fig.5 Colony of Paxillus ammoniavirescens in the middle and late stage of culture
Jargeat 等[21]采用完全固态MP(麦芽浸粉、蛋白胨)培养基(C+,含有18 种无机盐和6 种抗生素)和仅含2.5 g·L-1葡萄糖作为碳源的MP 培养基(C-)于24 ℃条件下培养P.involutus、P.ammoniavirescens 和P.cuprinus 的菌丝体35 d,发现在C+培养基上3 种菌丝体均产生棕色色素,在基质中扩散,并在菌丝上形成串珠(硬质颗粒)。P.cuprinus 气生菌丝灰褐色,有褐色液滴,菌丝体日均生长速度为0.398~0.655 mm,在富含高碳量的培养基(葡萄糖、麦芽提取物、酪蛋白)中菌丝体更致密,由于色素产量高,培养基会产生棕色染色。P.involutus 在加富培养基中,色素生成少,无褐色液滴,菌丝日均生长速度为0.463~0.773 mm。而绝大多数P.ammoniavirescens 菌株生长迅速,在3~4 周内可覆盖整个培养基,在加富培养基和贫瘠培养基上均有浓密的棉絮状气生菌丝、褐色液滴和硬的颗粒(菌核)。菌丝体日均生长速度为0.587~0.950 mm。本研究中菌丝体日均生长速度均快于这3 个种,但与P.ammoniavirescens更接近,这与ITS 序列比对和系统发育关系显示的该野生菌株为P.ammoniavirescens 的分析结果相吻合。
4 结论
本研究通过ITS 序列比对及系统发育关系分析,证明该野生菌株为Paxillus ammoniavirescens。利用单因子试验筛选出了P.ammoniavirescens 菌丝体生长的适宜碳源为可溶性淀粉,适宜氮源为蛋白胨,最适培养温度为25 ℃,最适pH 为4.5。由正交试验优化的液体菌种培养的最佳配方为可溶性淀粉20 g、蛋白胨2 g、KH2PO43.0 g、MgSO44.5 g、水1 L。在此培养条件下可获得平均干质量为80 mg 的菌丝体,明显高于其他配方。菌丝体在固体和液体培养基中的颜色差异较大,在固体培养基中的颜色因碳氮源种类不同而不同,分泌褐色素的程度有差异;在液体培养基中无褐色素分泌,菌丝体和培养液均呈鲜黄色。该研究结果将为P.ammoniavirescens 种的菌丝体液体深层发酵培养、人工驯化栽培及药用成分开发利用提供理论基础,并可作为外生菌根菌在生物修复重金属污染、抗逆境胁迫等方面得以应用。

