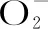桃胶多糖体内外抗氧化作用的研究
蔡延渠,董碧莲,陈利秋,朱盛山,李苑新,吴燕红
(广东药科大学新药研发中心,广东广州 510006)
近几年来,在大健康产业背景下,随着老龄化、城镇化及消费升级,正推动我国的保健食品和功能性食品快速发展。《“健康中国2030”规划纲要》的出台,意味着“健康中国”上升为国家战略,健康产业将成为国民经济支柱性产业[1]。
桃胶为蔷薇科植物桃(PrunuspersicaL. Batsch)或山桃(PrunusdavidianaCarr. Franch)等植物的树皮受损后分泌出来的半透明物质。其主要成分为多糖,含量高达80%以上[2],同时含有少量的蛋白质、氨基酸等,遇水可膨胀,有一定黏性。由于桃胶为天然产物、营养丰富,有清血降脂、滋补养颜及抗皱嫩肤等功效,同时具有韧滑、淡甜的特殊口感,逐渐受到广大消费者的喜爱,是保健食品开发的重要潜在资源。

1 材料与方法
1.1 材料与仪器
桃胶样品 采自贵州习水县,经广东药科大学李苑新副研究员鉴定为蔷薇科植物桃Prunuspersica(L.)Batsch分泌的桃胶树脂;SPF级昆明雄性小鼠60只 体重(20.0±2.0) g,购于广东省医学实验动物中心,生产许可证号:SYXK(粤)2018-0002;D-无水葡萄糖(批号110833-201707,含量99.9%) 中国食品药品检定研究院;维生素C(VC,批号 SLBN3833V) Sigma试剂有限公司;D-半乳糖 上海源叶生物有限公司;三羟甲基氨基甲烷(Thris)、1,1-二苯基-2-苦基肼(DPPH)、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 上海麦克林生化科技有限公司;总抗氧化能力(T-AOC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
UV-1700双光束紫外分光光度计 日本岛津公司;FreeZone2.5冷冻干燥机 美国Labconco公司;LB940多功能酶标仪 美国BioTek公司;TGL-20M高速冷冻离心机 长沙维尔康湘鹰离心机有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;BP-211D电子分析天平 德国Sartorius公司;pHS-3C pH计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 桃胶多糖制备 参考徐燕等[12]及任永升等[13]报道的方法,并进行适当改进。将桃胶浸胀、去杂、烘干,粉碎过60目筛,称取一定量粉末,以水为溶剂(以1%的NaOH溶液调节成pH为10.0),按料液比1∶100 (g/mL)、提取时间4 h、100 ℃提取3次,提取液3500 r/min离心15 min,滤液于75 ℃减压浓缩至适量,三氯乙酸除蛋白,再透过分子截流量为100000 Da的透析袋,透析液加入95%乙醇至溶液乙醇含量为85%,冰箱4 ℃静置过夜,取沉淀冷冻干燥,粉碎过100目筛,即得桃胶多糖。
1.2.2 桃胶多糖含量测定 参考蔡延渠等[2]报道的方法,采用苯酚-硫酸法,分别吸取0.2、0.4、0.6、0.8、1.0 mL的葡萄糖标准溶液(0.1019 mg/mL),加入纯水补足至1.0 mL,分别加入5%苯酚溶液1.0 mL,摇匀后加入浓硫酸溶液6.0 mL,90 ℃水浴25 min,取出冷却至室温,于紫外分光光度计490 nm处测定吸光度值(A),以葡萄糖质量浓度为横坐标(X)、A为纵坐标(Y)绘制标准曲线,得到回归方程。吸取1 mL桃胶多糖溶液,按以上操作反应后测定吸光度值,代入回归方程计算含量,结果以每克样品中所含葡萄糖当量的毫克数表示(mg/g)。
1.2.3 桃胶多糖清除自由基能力测定
1.2.3.1 对DPPH自由基清除率测定 参考程轩轩等[14]报道的方法,吸取不同质量浓度桃胶多糖溶液(5~10 mg/mL)及0.1 mmol/L的DPPH无水乙醇溶液各3 mL,避光反应30 min,于517 nm处测定吸光度值A1;另以等量样品溶液、无水乙醇混匀后测定A2;等量DPPH溶液、纯水混匀后测定A0;VC为阳性对照。通过式(1)计算清除率:
清除率(%)=[1-(A1-A2)/A0]×100
式(1)
1.2.3.2 对ABTS自由基清除率测定 参考包骐林等[15]报道的方法,将ABTS用过硫酸钾溶解配制成终浓度为7.2 mmol/L,室温避光反应12 h,即ABTS溶液,用前以PBS(pH=7.4)缓冲液稀释至734 nm处吸光度值A0为0.70±0.02。吸取2 mL不同质量浓度桃胶多糖溶液(0.1~0.6 mg/mL)和4 mL ABTS稀释液,涡旋30 s,室温避光反应10 min,于734 nm处测定吸光度值A1;VC为阳性对照。通过式(2)计算清除率:
清除率(%)=(A0-A1)/A0×100
庞庄水库上游没有排污口,点源污染基本不会发生,但也存在。如正在修建的太焦铁路工程,就出现过污水排入水体情况。
式(2)
1.2.3.3 对OH自由基清除率测定 参考段景峰等[16]报道的方法,吸取不同质量浓度桃胶多糖溶液(0.2~1.2) mg/mL、FeSO4溶液(6 mmol/L)及H2O2(6 mmol/L)溶液各2 mL,混匀静置10 min;再加入2 mL水杨酸溶液(6 mmol/L),静置30 min,于510 nm处测定吸光度值A1;另取等量纯水代替水杨酸测定吸光度值A2;以纯水代替桃胶多糖溶液作为空白对照测定吸光度值A0;VC为阳性对照。通过式(3)计算清除率:
清除率(%)=[1-(A1-A2)]/A0×100
式(3)
清除率(%)=[1-(A1-A2)]/A0×100
式(4)
1.2.4 总还原力测定 参考袁燕等[19]报道的方法,吸取不同质量浓度桃胶多糖溶液各1 mL,依次加入1%铁氰化钾溶液与磷酸缓冲液(pH=6.6)各2.5 mL,50 ℃水浴20 min,取出冷却;再加入10%三氯乙酸溶液2.5 mL,混匀,3500 r/min离心15 min,取上清液2.5 mL,加入0.1%三氯化铁溶液0.5 mL和纯水2.5 mL,20 min后于700 nm处测定吸光度值。另以纯水为空白、VC为阳性对照。
1.2.5 小鼠体内抗氧化实验 参照《保健食品检验与评价技术规范》[20]及郑飞等[21]报道的实验方法及条件进行。
1.2.5.1 剂量设计及给药 环境温度(20±2) ℃、相对湿度50%±10%,明暗周期各12 h,自由采食喝水。于实验环境条件适应性喂养3 d,随机分为6组,12只/组,分别为:空白组、模型组、桃胶多糖组(低剂量2 g/kg、中剂量4 g/kg、高剂量6 g/kg)和VC阳性对照组(0.1 g/kg)。按0.1 mL/10 g进行桃胶多糖组及VC阳性对照组灌胃给药,1 次/d;空白组及模型组给予等量蒸馏水。除空白组注射生理盐水外,其余组别每天均按1000 mg/kg剂量进行颈背部皮下注射D-半乳糖,连续45 d。每天观察小鼠体征、外观、活动等,每3 d称重1次以调整注射量和灌胃量。
1.2.5.2 样品处理 于实验末次给药后,禁食不禁水12 h,摘取眼球取血,3500 r/min低温(4 ℃)离心10 min,取血清于-20 ℃保存备用。小鼠颈椎脱臼处死,摘取肝脏,生理盐水冲洗干净,吸干表面水分,取适量肝脏及试剂盒中提取液于研钵中制成10%的组织匀浆,3500 r/min、4 ℃离心10 min,取上清液备用。
1.3 数据处理
2 结果与分析
2.1 桃胶多糖含量测定
根据葡萄糖质量浓度与吸光度值绘制标准曲线,得到线性回归方程:Y=0.0751 X+0.0005(R2=0.9994),代入计算得到桃胶多糖中所含葡萄糖当量为(968.50±8.15) mg/g。
2.2 桃胶多糖体外抗氧化能力评价
2.2.1 清除DPPH自由基能力 对DPPH自由基清除率变化进行曲线绘制(见图1),得到回归方程:桃胶多糖清除率Y=9.8200X-18.2470(R2=0.9837),IC50为6.95 mg/mL;VC清除率Y=4.8476X+33.6320(R2=0.9911),IC50为3.38 mg/mL。分析结果可知,在5~10 mg/mL范围内,随着浓度的增大,桃胶多糖对DPPH自由基的清除作用逐渐增强;DPPH自由基是很稳定的 N-中心自由基,与机体的许多功能障碍和疾病的发生密切相关,会损伤相邻的生物分子造成脂质过氧化[22]。因此推测其可能是破坏DPPH自由基中N-中心自由基的稳定性而起到清除作用。与VC相比,桃胶多糖作用较弱。
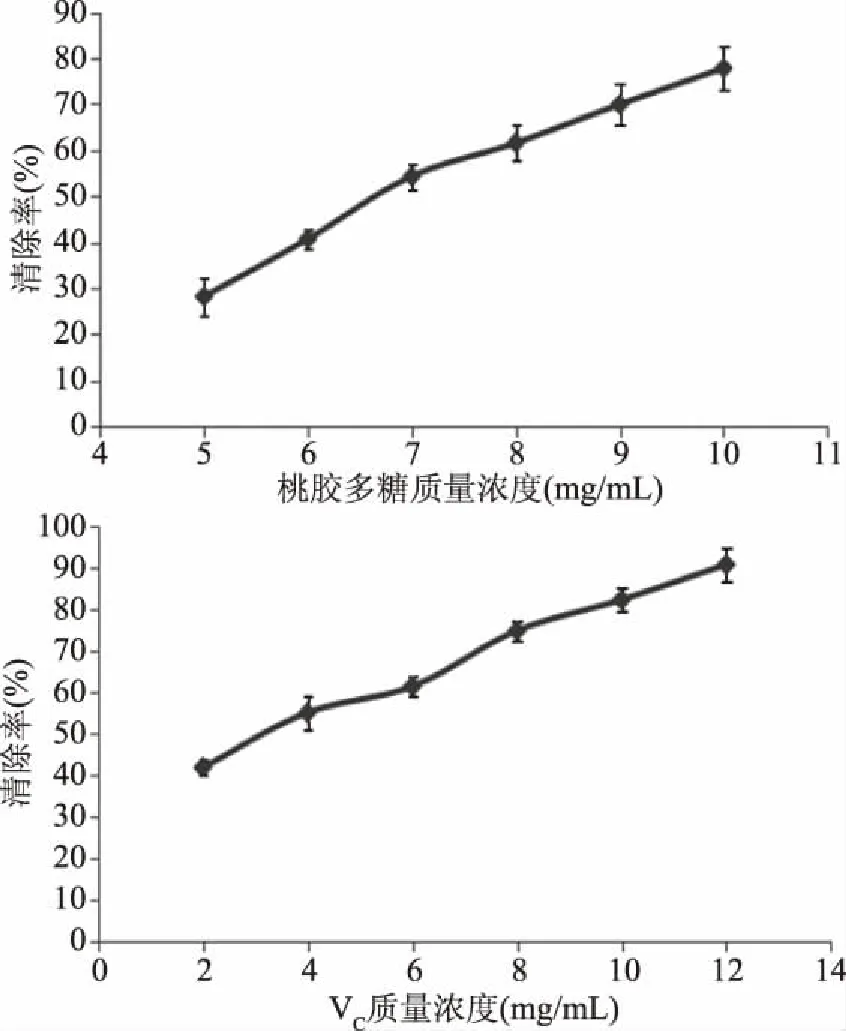
图1 桃胶多糖及VC对DPPH自由基清除作用 Fig.1 DPPH free radical-scavenging activities of peach gum polysaccharide and VC
2.2.2 清除ABTS自由基能力 对ABTS自由基清除率变化进行曲线绘制(见图2),得到回归方程:桃胶多糖清除率Y=66.5371X+12.4953(R2=0.9855),IC50为0.56 mg/mL;VC清除率Y=1351.0286X+27.2253(R2=0.9804),IC50为 0.017 mg/mL。分析结果可知,在0.1~0.6 mg/mL范围内,随着浓度的提高,桃胶多糖对ABTS自由基的清除作用逐渐增强;ABTS自由基较稳定,主要是其结构中N原子上有个成单电子,可与苯环形成p-π共轭,因此推测桃胶多糖能与ABTS自由基的成单电子进行配对,破坏p-π共轭体系,从而起到清除作用。与VC相比,桃胶多糖作用较弱。
图2 桃胶多糖及VC对ABTS自由基清除作用Fig.2 ABTS free radical scavenging activities of peach gum polysaccharide and VC
2.2.3 清除OH自由基能力 对OH自由基清除率变化进行曲线绘制(见图3),得到回归方程:桃胶多糖清除率Y=29.6571X+17.5067(R2=0.9880),IC50为1.10 mg/mL;VC清除率Y=84.9714X+21.5800(R2=0.9915),IC50为 0.33 mg/mL。分析结果可知,在0.2~1.2 mg/mL范围内,随着浓度的提高,桃胶多糖对OH自由基的清除作用逐渐增强;表明桃胶多糖能够清除OH自由基,阻止其降解DNA、细胞膜和多糖化合物,从而保护细胞完整性。与VC相比,桃胶多糖作用较弱。
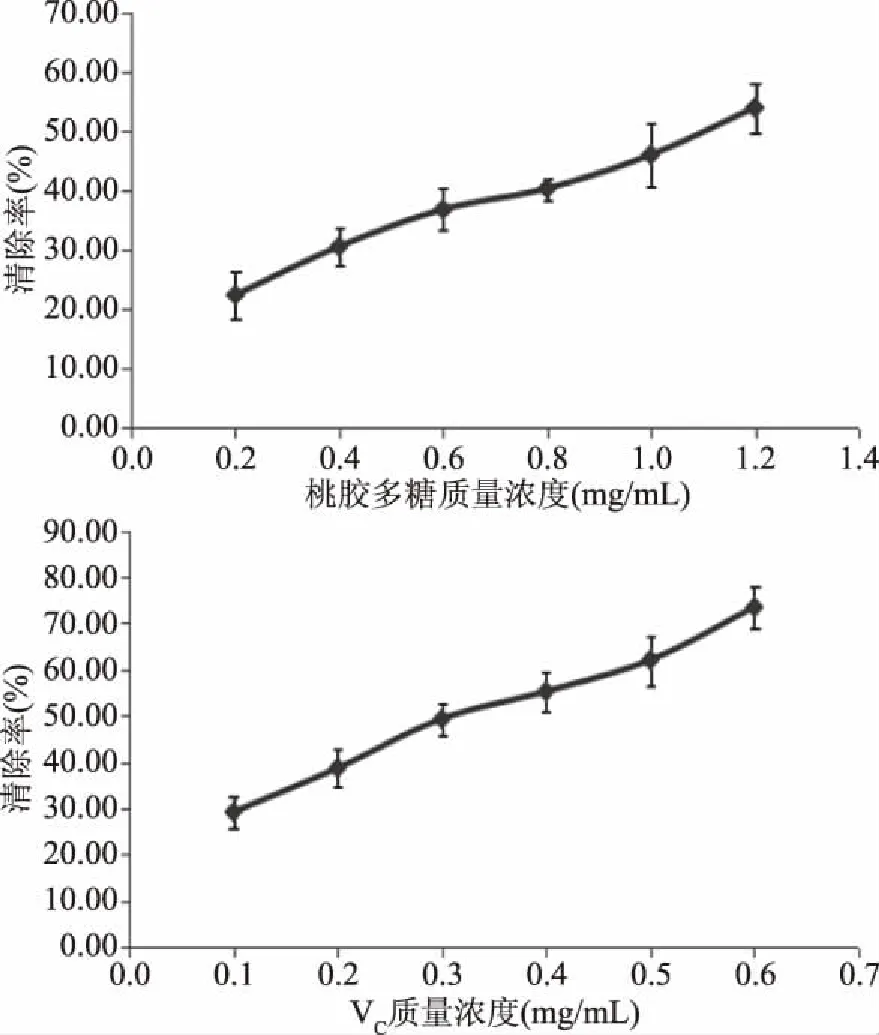
图3 桃胶多糖及VC对OH自由基清除作用Fig.3 ·OH scavenging activities of peach gum polysaccharide and VC

图4 桃胶多糖及VC对自由基清除能力 free radical scavenging activities of peach gum polysaccharide and VC

图5 桃胶多糖及VC的还原能力Fig.5 Reducing power of peach gum polysaccharide and VC
2.3 总还原能力评价
分析结果可知,在0.02~0.14 mg/mL范围内,桃胶多糖与VC的总还原能力均随浓度的增大而提高,表明桃胶具备将Fe3+还原成Fe2+形成Fe2+-TPTZ的能力,从而增强系统抗氧化能力。该作用机理可能为通过自身还原能力给出电子,破坏自由基链反应的电子供体,从而实现清除自由基的效果。两者相比,VC还原能力更强。
2.4 桃胶多糖体内抗氧化作用评价
D-半乳糖衰老模型常用于抗氧化活性的药效学评价。其中,T-AOC水平、SOD与GSH-Px活力是体内最重要的抗氧化指标,可有效清除体内自由基;MDA的含量高低能够代表细胞膜脂过氧化的程度,间接反映组织抗氧化能力的强弱。
2.4.1 对小鼠血清中MDA含量及T-AOC、SOD、GSH-Px活性的影响 桃胶多糖对小鼠血清中MDA含量及T-AOC、SOD、GSH-Px活性的影响具体见表1。分析结果可知:与空白组相比,模型组小鼠血清中MDA含量显著提高(P<0.05),T-AOC水平极显著降低(P<0.01),SOD及GSH-Px活性均显著降低(P<0.05),表明D-半乳糖可破坏小鼠的免疫系统,加速衰老;与模型组相比,VC阳性组的MDA含量显著降低(P<0.05),T-AOC水平与SOD活性均极显著提高(P<0.01),GSH-Px活性显著提高(P<0.05);与模型组相比,桃胶多糖均可显著或极显著降低MDA含量以及提高T-AOC水平、SOD与GSH-Px活性(P<0.05或P<0.01),且随着剂量的增加,效果变显著。表明桃胶多糖对D-半乳糖引起致衰小鼠的SOD、GSH-Px活性具有修复作用,且提高其总抗氧化能力,可较好改善衰老小鼠的氧化应激受损情况;此外,能够增强小鼠组织的抗氧化能力,减少细胞膜脂过氧化损伤。

表1 桃胶多糖对小鼠血清中MDA含量及T-AOC、SOD及GSH-Px活性的影响Table 1 Effects of peach gum polysaccharide on MDA content and activities of T-AOC,SOD and GSH-Px in mouse
2.4.2 对小鼠肝脏中MDA含量及T-AOC、SOD、GSH-Px活性的影响 桃胶多糖对小鼠肝脏中MDA含量及T-AOC、SOD、GSH-Px活性的影响具体见表2。分析结果可知:与空白组相比,模型组小鼠肝脏中MDA含量显著提高(P<0.05),T-AOC水平、SOD及GSH-Px活性均极显著降低(P<0.01), 表明D-半乳糖可成功建立小鼠衰老模型;与模型组相比,VC阳性组的MDA含量显著降低、T-AOC水平及GSH-Px活性显著提高(P<0.05),SOD活性极显著升高(P<0.01);与模型组相比,中高剂量的桃胶多糖均可显著或极显著降低MDA含量以及提高T-AOC水平、SOD与GSH-Px活性(P<0.05或P<0.01),且作用强弱与其浓度高低具有一定的正相关性。表明桃胶多糖能够缓解D-半乳糖致衰小鼠模型的脂质过氧化程度,减少超氧阴离子等自由基在小鼠体内的积累,起到保护机体细胞、修复机体损伤的作用。

表2 桃胶多糖对小鼠肝脏中MDA含量及T-AOC、SOD及GSH-Px活性的影响Table 2 Effects of peach gum polysaccharide on MDA content and activities of T-AOC,SOD and GSH-Px in mouse
3 讨论与结论