2014—2018年沈阳地区手足口病病原分布及流行特征
齐 特,黄郁晶,吉耀华,王 博,苗 野,刘 超,吴 昊,阮 强
(中国医科大学附属盛京医院病毒研究室,辽宁 沈阳 110000)
手足口病(hand, foot and mouth disease, HFMD)是由肠道病毒(enterovirus, EV)感染引起的一种常见传染病,在我国传染病法定报告管理中属于丙类传染病[1]。HFMD是一种全球性疾病,在我国各地全年均有发生。HFMD高发于夏秋季节,以婴幼儿及儿童感染为主,多发于5岁以下儿童,尤其是3岁以下的儿童。HFMD传染性强,播散速度快,隐性感染率高,易导致暴发流行[2-4]。引起HFMD的主要肠道病毒及血清型包括柯萨奇病毒(coxsackie virus, CV)A组4~7、9、10、16型和B组1~3、5型,埃可病毒(echovirus)部分血清型、肠道病毒71型(enterovirus 71, EV-71)等。其中以CV-A16和EV-71最常见,且肠道病毒各型之间无交叉免疫力[5]。HFMD的临床症状主要表现为发热,手、足、口、臀等部位出疹,可伴有咳嗽、流涕、食欲不振等症状,典型皮疹表现为斑丘疹、丘疹和疱疹,皮疹周围有炎性红晕,疱疹内液体较少,不疼不痒,部分病例仅表现为皮疹或疱疹性咽峡炎,个别病例可无皮疹。HFMD患儿中,大部分病程短,预后良好;部分可并发心肌炎、无菌性脑膜炎、急性迟缓性麻痹、神经源性肺水肿及循环衰竭等,甚至威胁生命[5-6]。
沈阳作为东北地区的中心城市,人口密集,易发生HFMD流行。手足口病患儿年龄普遍偏小,家长对患儿高度紧张、重视。为保障广大儿童的身体健康,避免不必要的医疗纠纷,HFMD防控及辅助临床诊断提供参考资料,本文对2014—2018年中国医科大学附属盛京医院就诊的疑似HFMD患儿进行了肠道病毒检测,对HFMD病原体布及流行特征进行分析。
1 对象与方法
1.1 研究对象 2014—2018年中国医科大学附属盛京医院就诊临床诊断为HFMD的患儿。
1.2 诊断标准 手足口病诊断标准参照《手足口病诊疗指南(2018版)》[5],在临床诊断的基础上,肠道病毒(CV-A16、EV-71等)特异性核酸检查阳性即可确诊。
1.3 试剂与仪器 检测试剂为浙江默乐生物科技公司的肠道病毒核酸检测试剂盒,可定性检测EV-71型、CV-A16型及肠道病毒通用型(包括CV-A2、4、5、7、9、10型和CV-B1、2、3、4、5型等)。核酸提取仪器为天隆科技公司的NP968核酸提取仪,检测仪器为宏石医疗科技公司的SLAN-96P实时荧光PCR仪。
1.4 检测方法
1.4.1 标本的采集及处理 临床科室常规采集所有疑似HFMD患儿咽拭子进行HFMD 肠道病毒核酸检测。检测时,向已采集的咽拭子标本中加入1 mL无菌生理盐水,充分震荡混匀。核酸提取步骤参照浙江默乐公司的肠道病毒核酸检测试剂盒及天隆公司NP968核酸提取仪的说明书,提取获得的RNA保存于4℃冰箱备用。暂时不能检测的临床标本需于-20℃保存,保存期不得>3 d。
1.4.2 扩增体系及条件 取聚合酶链反应(PCR)管,按照反应体系配置表依次加入逆转录PCR(RT-PCR)反应液、Taq酶、逆转录(reverse transcription, RT)酶、EV引物和探针、待测标本RNA各5 μL,共计25 μL,同时设置阴性对照、阳性对照。扩增条件为:45℃ 15 min,1个循环;95℃ 2 min,1个循环;94℃ 10 s,58℃ 40 s,40个循环。
1.4.3 结果判读 结果呈典型的S型扩增曲线,且EV-71型、CV-A16型及肠道病毒通用型Ct值分别小于35.29、35.86和35.62,结果为阳性;Ct值分别大于38.46、38.64和38.46,结果为阴性;Ct值分别在35.29≤Ct≤38.46、35.86≤Ct≤38.64和35.62≤Ct≤38.46范围内,结果为可疑阳性。
1.5 统计学方法 应用Excel 2010建立数据库,应用SPSS 19.0对结果进行统计分析。计数资料用例数或百分率描述,比较采用χ2检验,P≤0.05表示差异具有统计学意义。
2 结果
2.1 感染人群分布 共接诊临床诊断为HFMD患儿25 571例,其中男患儿14 780例,女患儿10 791例,男女比例为1.37∶1;患儿年龄为28 d~14岁,平均年龄为2.99岁。临床诊断为HFMD患儿中,肠道病毒阳性检出率为67.51%(17 263例),其中男患儿阳性检出率为69.72%(10 305例),女患儿阳性检出率为64.48%(6 958例),男女患儿阳性检出率比较,差异有统计学意义(χ2=78.167,P<0.001);肠道病毒阳性男女比例为1.48∶1。各个年龄组不同性别阳性患儿所占病例数的比例各不相同,男患儿所占比例均高于女患儿,见图1。
在0~、1~、2~、3~、4~、5~、≥6岁6岁年龄组中,肠道病毒检出阳性比率分别为5.56%(959例)、20.40%(3 522例)、20.51%(3 540例)、24.53%(4 235例)、14.38%(2 483例)、7.21%(1 244例)和7.41%(1 280例),呈单峰状分布,3~岁年龄组的阳性比率最高,<6岁的HFMD阳性患儿共15 983例,占肠道病毒检出阳性患儿数的92.59%。
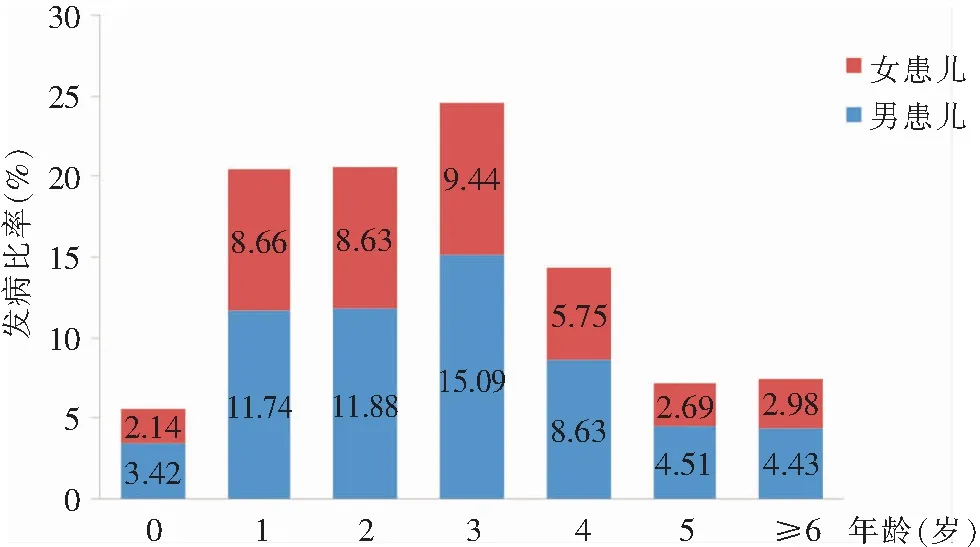
图1 不同性别阳性HFMD患儿在各年龄组中的分布
2.2 流行时间分布 五年期间每年不同月份HFMD患儿比例各不相同,呈动态变化,但每年的7、8月份均是HFMD的高发期,最高占比为29.94%~52.30%,季节分布明显,变化趋势呈现单峰型。见图2。
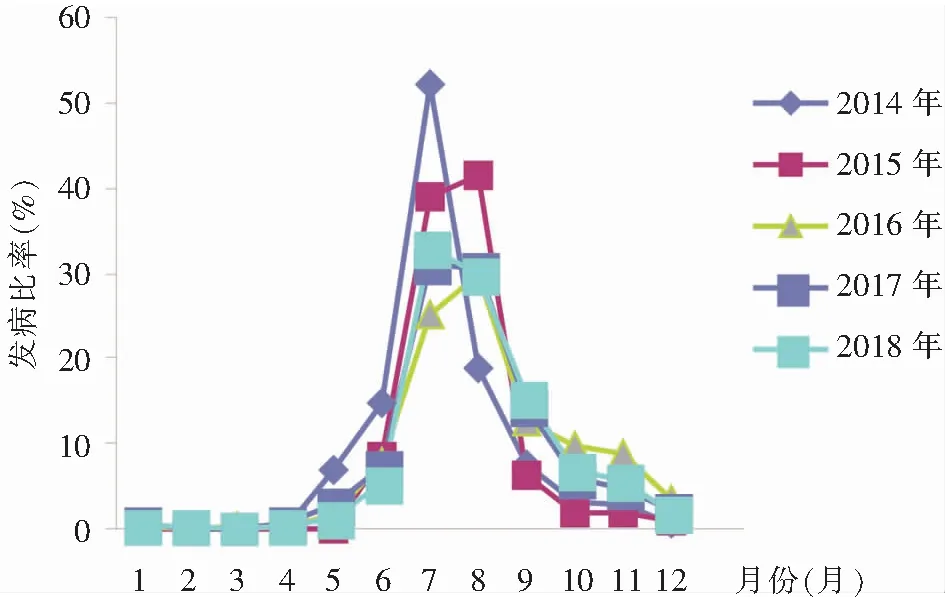
图2 HFMD发病月份分布
2.3 HFMD病原体分布 17 263例HFMD肠道病毒检测阳性患儿中,EV-71、CV-A16及其他肠道病毒检测阳性比率分别为12.71%、24.38%和62.91%;每年三种(类)肠道病毒阳性比例各不相同,呈动态变化,不同年份HFMD患儿中各种(类)肠道病毒阳性比例比较,差异有统计学意义(χ2=5 417.868,P<0.001)。见表1、图3。

表1 2014—2018年HFMD肠道病毒检测阳性患儿不同肠道病毒构成比

图3 2014—2018年HFMD肠道病毒检测阳性患儿不同肠道病毒构成比
2.4 重症HFMD患儿病毒病原分布 17 263例HFMD肠道病毒检测阳性患儿中,33例临床确诊为重症HFMD,重症率为0.19%,无死亡病例。重症HFMD患儿中,男患儿23例,重症率为0.22%(23/10 305),女患儿10例,重症率为0.14%(10/6 958),两者重症率比较,差异无统计学意义(χ2=1.375,P>0.05);CV-A16阳性5例(15.15%),其他肠道病毒阳性28例(84.85%),无EV-71阳性重症HFMD。CV-A16与其他肠道病毒在重症HFMD患儿中病原体构成比比较,差异有统计学意义(χ2=32.061,P≤0.05)。在0~、1~、2~、3~、4~、5~、≥6岁年龄组肠道病毒检测阳性患儿中,重症率分别为0.21%(2/959)、0.40%(14/3 522)、0.14%(5/3 540)、0.12%(5/4 235)、0.20%(5/2 483)、0.08%(1/1 244)和0.08%(1/1 280),各年龄组重症率比较,差异无统计学意义(χ2=11.194,P>0.05)。
3 讨论
HFMD是一种儿童期急性传染病,1957年在新西兰首次出现了该病。60多年来,全球很多国家都出现过较大规模的HFMD流行,已成为常见的儿童健康问题。20世纪90年代后期以来,在东南亚和东亚地区的婴幼儿中多次流行[7]。HFMD常见于6岁以下儿童,尤其是婴幼儿,传染源主要是患者及病毒携带者[8]。该病主要由小RNA病毒科肠道病毒属引起,其中以EV-71和CV-A16型最常见。2010年以来,HFMD发病人数连续五年位居我国传染病首位,死亡人数位居丙类传染病首位,严重威胁儿童的生命健康[9]。早期的实验室诊断对于HFMD患儿的及时治疗,以及预后改善尤其重要。
本组研究结果显示,沈阳地区2014—2018年临床诊断HFMD患儿男女比例为1.37∶1,HFMD肠道病毒检测阳性患儿中,男女患儿比例为1.48∶1,且疑似病例中男患儿的阳性检出率高于女性患儿(χ2=78.167,P<0.05),表明在HFMD患儿中男孩居多。李平等[10]研究报道,海口市HFMD男孩发病率高于女孩发病率。男孩发病多可能与男孩子更加活泼好动,且相对不注意个人卫生有关。而袁翊等[11]报道,四川内江地区HFMD患病人群性别差异无统计学意义。地域不同,风俗文化与教育等方面差异可能造成不同地区男女患病率不一致。
从年龄分布上,0~岁年龄组HFMD患儿肠道病毒检测阳性比例最低,低于1~岁组患儿,除与0~岁年龄组幼儿接触传染源概率较低以外,也可能与来自母体的低滴度肠道病毒中和抗体的保护作用有关[12]。≥6岁年龄组肠道病毒检测阳性比例较低,可能是因为随着年龄增长,具有肠道病毒特异性免疫的儿童群体比例增加,个体免疫力不断增强所致[13]。HFMD肠道病毒检测阳性患儿中,<6岁者占92.59%,其中3~岁年龄组占比最高(24.53%),是HFMD的高发年龄段。<6岁的孩子活动能力以及对外界的探索欲望不断增强,多数有吃手习惯,卫生意识较差,没有形成经常洗手的好习惯,容易感染肠道病毒,儿童之间密切接触,病毒污染手、玩具和餐具等更容易造成交叉感染,同时从母体获得的肠道病毒中和抗体消失[13],使<6岁的儿童成为HFMD肠道病毒的易感人群。
从流行时间分布上看,2014—2018年HFMD患儿主要发病月份是每年的7、8月份,季节分布明显,全年变化趋势呈现单峰状,与部分研究[10,14-15]显示的HFMD发病季节也呈现单峰状分布相同,但不同于四川内江[11]和昆明[16]季节分布(呈现双峰状)。HFMD的发病情况与气候因素有很明显的相关性,气温越高,湿度越大,HFMD的发病率越高[17]。沈阳地区属于温带大陆性气候,每年的7、8月份是高温、高湿时期, 符合HFMD高发期的气候特点;9月份气温开始下降,雨水减少,发病率也随之下降。HFMD具有明显的流行季节性特点,各个地区因为气候差异,发病月份也随之不同。
沈阳地区2014—2018年引起HFMD的病毒病原分布各不相同,具有本地区独特的流行特征。从时间上来看,同一病原在不同年份感染儿童中的构成比存在差异。EV-71在2014、2017年HFMD肠道病毒检测阳性患儿中构成比分别是27.02%和37.93%,是主要流行病毒病原,而在其他三年均不足5%;CV-A16在2014年和2016年HFMD肠道病毒检测阳性患儿中构成比分别为38.03%、46.04%,是主要流行病毒病原,在其他三年均不足15%;其他肠道病毒在2015、2018年优势明显,构成比分别为85.29%、85.12%,在2016、2017年占50%左右,而在2014年仅占34.95%;同一病原在不同年份的构成比呈动态变化。综合五年检测结果,HFMD的病原构成呈现复杂化和多样化的特点,优势病原体交替出现。海口地区在2014—2016年以EV-71为主[10],济南地区在2014—2016年以CV-A16为主,而2015年以其他肠道病毒为主[15]。气候不同、疫苗接种情况差异等均可能造成各地区之间HFMD病毒病原体构成的不同。易感儿童感染一种病原体之后机体产生特异的保护性抗体,各病原体之间没有交叉免疫,在下一年度,该病原体的流行强度会减弱,其他病原体感染相对增强,成为流行的优势病原。同一地区肠道病毒病原体构成会因为群体免疫状态的差异而呈现出随机化和多样化的特点。
本研究结果显示,2014—2018年收治的33例重症HFMD患儿中,感染其他肠道病毒的患儿占重症总数的84.85%,无EV-71感染引起的重症HFMD。而荆门、大连、辽阳地区[18-20]在同时期内重症HFMD患儿都以EV-71感染为主。不同地区引发HFMD的优势病原体有所差异,可能与该地区HFMD的病原流行特征有关。有报道重症HFMD好发于免疫力相对不足的低年龄段婴幼儿[21],由于家长及临床医护人员对EV-71在低年龄段儿童中引起HFMD的高度重视,患儿病情加重的概率降低;同时随着EV-71灭活疫苗的广泛应用,EV-71在重症HFMD中的病原体构成比低于其他肠道病毒,形成了沈阳地区重症HFMD患儿主要是以其他肠道病毒感染为主的特征。
HFMD的病原体构成呈现复杂化和多样化的特点,优势病原交替出现,因此,对HFMD病原学的监控有利于更加清楚地了解该地区的病原体构成及优势病原,为HFMD的预防和治疗提供参考依据。鉴于其他肠道病毒检出率一直高居不下,需要重视对除EV-71和 CV-A16以外的其他肠道病毒型别的监测,研制多价HFMD疫苗,为我国乃至全球的HFMD防控做出贡献。

