细粒棘球绦虫肌动蛋白基因的克隆表达※
高瑞雪,李超群,张耀刚,李凤辉,赵 婧,姜博璠,张发斌*
(1.青海大学医学院,青海西宁810001;2.青海省包虫病研究重点实验室,青海西宁810001)
近年来,利用基因工程技术分析细粒棘球绦虫的有效成分,寻找特异性高的抗原分子成为细粒棘球蚴病早期诊断的研究热点[1-2]。细粒棘球绦虫肌动蛋白基因是一种用患者血清从细粒棘球蚴原头节蛋白中筛选出的抗原性蛋白[3,4]。本研究拟通过克隆表达细粒棘球绦虫肌动蛋白基因获得纯化蛋白。
1 材料与方法
1.1 材料
cDNA由青海省包虫病研究重点实验室提供。实验所需的表达载体PET28a-SUMO,限制性内切酶BamHI、Xhol,镍柱(1mL),兔抗His标签抗体IgG,羊抗兔抗体IgG由上海生物工程有限公司提供。DNA凝胶回收试剂盒、T4连接酶、质粒提取试剂盒由天根生物技术有限公司提供。
1.2 方法
1.2.1 EgACT基因的合成
在GenBank数据库中获取EgACT基因编码序列,经全序列合成、密码子优化后合成目的基因。合成产物经1%琼脂凝胶电泳后在紫外光下切取目的基因,并用DNA凝胶回收试剂盒纯化回收DNA。
1.2.2 重组质粒的构建[5]
依据参考文献方法回收产物与原核表达质粒pET28a-SUMO,采用限制性内切酶 BamHI、Xhol进行双酶切。以8μL酶切目的片段(液)、4μL酶切载体 pET28a、2μL 10×T4 DNAligase Buffer、1μL T4 DNAligase(5u/μL)加ddH2O 至20μL,在22℃下连接1 h,获得重组质粒,取10μL连接产物转入top10感受态中,筛选出阳性克隆物,送上海生物工程有限公司进行测序鉴定。
1.2.3 重组蛋白的表达和纯化[6]
依据参考文献方法诱导表达,取重组质粒转入Rosetta(DE3)感受态,在涂板筛选单菌落,接种于含卡那霉素和氯霉素的LB液体培养基中(37℃,220rpm气浴恒温振荡器)培养过夜。将培养的菌液按1:100比例接种于同样含有卡那霉素和氯霉素的LB液体培养基中(37℃,220rpm气浴恒温振荡器)培养,当OD值约为0.6时,吸出1 mL未经诱导的培养液保存(4℃)。使用时加入IPTG至终浓度为0.5 mM后诱导过夜(20℃),离心(12000r/min,5min)收集细菌菌体,在冰浴状态下经过超声裂解收集沉淀,沉淀在破碎Buffer中经超声裂解获得上清液,采用镍琼脂糖凝胶亲和层析法进行蛋白纯化、去除杂蛋白,将所得组分透析过夜(1×PBS,2mM DTT,pH7.4),透析结束后用PEG20000浓缩、滤膜(0.22μm)过滤后分装、保存(-80℃)。
1.2.4 纯化蛋白表达的检测
配置12%的分离胶和5%的浓缩胶,对纯化后的蛋白进行电泳,用考马斯亮蓝染色20 min,脱色,检测蛋白表达情况。
1.2.5 纯化蛋白浓度的测定
采用SK3071非干扰型蛋白定量试剂盒测定纯化蛋白EgACT蛋白浓度。
2 结果
2.1 重组质粒pET28a-SUMO-EgACT鉴定结果
重组质粒双酶切鉴定显示,大小约5000 bp和1100 bp,符合预期,表达载体构建成功(图1)。

图1 重组质粒pET28a-SUMO-EgACT酶切鉴定图Figure 1 Themap of recombinant p lasm id pET28a-SUMO-EgACT digestion identification
2.2 重组蛋白诱导表达及纯化结果
诱导表达结果表明,EgACT蛋白在20℃和37℃沉积物中具有可见带(图2)。利用镍琼脂凝胶亲和色谱法进行蛋白质纯化,EgACT蛋白在500 mM咪唑浓度时,被大量洗脱下来(图3)。

图2 pET28a-SUMO-EgACT表达产物的SDS-PAGE分析图Figure 2 Expression products of pET-28a-SUMO-EgACT w ith SDS-PAGE analysis
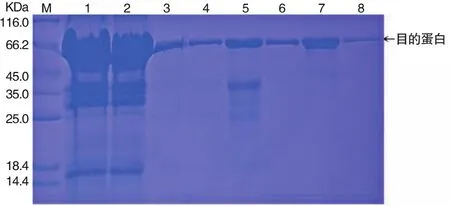
图3 镍琼脂糖亲和层析SDS-PAGE分析图Figure 3 NickelSepharose Affinity Chrom atography w ith SDS-PAGE Analysis
2.3 重组蛋白最终纯化SDS-PAGE分析结果
SDS-PAGE分析显示,EgACT在约60 kD处出现明显特异条带,与理论值一致,获得纯度较高的纯化目的蛋白(图4)。

图4 重组蛋白EgACT的SDS-PAGE分析图Figure 4 Recom binant protein EgACTanalyzed w ith SDS-PAGE
2.4 重组蛋白EgACT蛋白浓度测定结果
使用SK3071非干扰型蛋白定量试剂盒测量EgACT蛋白浓度:1.27 mg/mL(图 5,表 1)。

图5 蛋白浓度标准曲线图Figure 5 Standard curve of protein concentration

表1 纯化蛋白浓度测定结果表Table 1.Results of purified protein concentration measurement
3 讨论
细粒棘球蚴病,又称囊性包虫病。由于棘球蚴病感染早期无任何临床症状,所以在临床上很难做到早发现、早治疗。因此,近年来,探索高灵敏性、高特异性的早期诊断指标成为防治包虫病的迫切期待。随着基因工程技术及免疫学技术等的日益发展,为包虫病的早期诊断研究提供了发展平台,进而为实现包虫病早期诊断提供了可能。
细粒棘球蚴病作为一种严重的人畜共患病,其感染分两个阶段。一是以幼虫形式或包虫囊肿形式在中间宿主(如人类或家畜、野生草食类动物)的内脏中发育;二是成虫在终宿主(如犬类)的小肠中生长。在这些发育阶段,寄生虫的细胞形态和生理特性发生着显著变化[7]。肌动蛋白作为细胞分化和增殖过程中的关键分子之一,在所有真核细胞中都发现了肌动蛋白基因[8],在细粒棘球绦虫基因组中也发现了几个肌动蛋白基因[9]。原头蚴蛋白质中细胞骨架蛋白占据了重要部分,可维持细胞形态结构并与细胞运动有关。其中肌动蛋白作为细胞骨架蛋白的重要组分,是微丝的结构蛋白,参与细胞形态的维持、运动调节及细胞与各组分之间的相互作用[10,11]。在肌细胞中,细胞的运动离不开肌动蛋白和肌球蛋白的共同作用。
基于以上性质,虫体的运动可能与肌动蛋白有关[12]。基于以上推测,将EgACT作为免疫抗原。
通过上述设计,成功构建了PET28a-EgACT重组质粒,获得了纯化蛋白。后续将继续对肌动蛋白对于细粒棘球蚴病的免疫学特性进行分析,构建免疫动物模型,了解EgACT刺激机体产生抗体的能力。

