神经元线粒体转录因子A对缺血性大鼠脑卒中的作用※
程 艳,张 涛,苏小明,满 竹,马艳艳,李建华,张耀刚,田美媛,侯 静,黄登亮
(1.青海大学,西宁810016;2.青海大学附属医院中心实验室,西宁810001)
国内外学者从多方面研究脑卒中发病机制,发现线粒体参与缺血性脑卒中发病的各环节,线粒体作为有氧呼吸和ATP产生的主要场所,是细胞内耗氧量最大的细胞器,其功能与细胞多种生命活动密切相关,如ROS的产生、细胞的凋亡等。当ROS在线粒体中积累时损伤线粒体DNA(mitochondrial DNA,mtDNA)。有学者发现线粒体转录因子A(mitochondrial transcription factor
A,TFAM)是由核基因编码的线粒体核心功能调控因子之一,可调控mtDNA的转录、复制、修复;TFAM是线粒体代谢的主要调控点,可以抑制细胞凋亡,减少ROS的产生,对mtDNA的损伤修复起重要作用[1]。但目前对TFAM在脑卒中的作用研究不足,本研究通过线栓法建立缺血性大鼠脑卒中模型,观察TFAM与脑卒中线粒体生物学功能的相关性。
1 材料与方法
1.1 实验材料
1.1.1 动物
54只健康雄性SD大鼠(250~280g)由南京市江宁区青龙山动物繁殖场提供(许可证号:3201111979),随机分为正常组(NORMAL)、假手术组(SHAM)、大脑中动脉阻塞组(MCAO),每组18只。后两组在组内再分为2、6、12 h三个时间点组。
1.1.2 主要仪器和试剂
3激光12色流式细胞仪(BD),动物饲养IVC系统(TECNIPLAST),普通纯水仪(PC210EUBPM1),超纯水仪(CLXXUVFM2),超低温冰箱(EXF60086V),超微量核酸蛋白测定仪(Nanodrop2000C),荧光实时定量PCR仪(ROCHE Light,Cycler
480),立体动物手术显微镜(OLYMPUS),PCR梯度仪(Mastercycle nexux,GSX1);SYBRGreen(Roch,04913850001),Trizol(TaKaRa,9109),TTC(Biottopped,298964),蛋白酶抑制剂PMSF(BOSTER,AR1179),Anti-NeuN(abcam,ab177487),TFAM抗体(santa,166965);RNA反转录试剂盒(TransGen,AT311),PI+AnixV-FITC凋亡检测试剂盒(BD,556547),JC-1试剂盒(BD,551302);TFAM和β-actin引物(Shanghai Sangon
company)。
1.2 实验方法
1.2.1 大鼠造模
大鼠术前一日禁食不禁水,参照文献[2]改良线栓法制成MCAO模型:用10%的水合氯醛(3mL/kg)行腹腔注射麻醉,仰卧固定,在立体显微镜下分离右侧颈总动脉、迷走神经、颈内动脉,结扎颈总动脉后在颈总动脉处挂线,用动脉夹夹闭颈内动脉远心端后,距动脉分叉4
mm处剪一斜型切口,将线栓由颈总动脉插人颈内动脉,取下动脉夹,插入深度约(18.5±0.5)mm,稍遇阻力即停,固定线栓,剪断栓尾,依次缝合皮下及皮肤各层,用碘伏消毒后返笼,给予正常饮食(水)。术中及术后注意保暖。SHAM组只分离血管和神经后缝合。术后清醒后对MCAO组及SHAM组大鼠参考Zea Longa[3]等制定的4级评分法进行神经功能损伤评分,0分:未出现神经损伤症状;1分:不能伸展对侧前爪;2分:向一侧转圈或追尾;3分:向对侧倾倒;4分:不能行走,意识丧失。1~3分大鼠纳入实验,0、4分及死亡大鼠排除在外。
1.2.2 神经元TFAM mRNA表达取在-80℃冰箱保存的大鼠脑组织标本约0.2
g,在液氮中快速研磨成粉末,根据Trizol说明书提取脑组织RNA,测浓度及纯度,根据反转录试剂盒说明在冰上将其反转录成cDNA。取2μL作为模板进行 qPCR反应,TFAM上游引物:5′-TGACGAGT-TCTGCCGTTTGC-3′,TFAM 下游引物:5′-AACCCGCACGAAACTGTCAC-3′;内参 β-actin 上游引物:5′-CACTTTCTACAATGAGCTGCG-3′,内参 β-actin 下游引物:5′-CTGGATGGCTACGTACATGG-3′。 qPCR 数值分析采用2-ΔΔCT分析法,用Graph pad8.0软件分析并做图。
1.2.3 神经元TFAM蛋白表达
取100mg置-80℃冰箱保存的脑组织,在液氮中快速研磨成粉末状,加入0.5 mL RIPA(含PMSF)充分裂解脑组织提取蛋白,用Bradford法测其浓度。各组取等量蛋白行SDS-PAGE电泳,湿转至PVDF膜,用含5%脱脂牛奶的PBST溶液封闭PVDF膜,用山羊抗小鼠TFAM抗体(1:200)与封闭后的PVDF膜在室温下孵育2 h;用 PBST 洗膜,用二抗(1:5000)在室温下孵育PVDF膜2 h;用PBST洗膜后采用ECL法显色。利用图像处理软件Image J对蛋白电泳图行灰度分析,并以两者的比值作为目的蛋白的相对定量值。
1.2.4 流式细胞悬液的制备及神经元线粒体膜电位、凋亡的检测
将大鼠麻醉后快速断头取脑,在冰上于HBSS缓冲液中快速剥除脑膜、血管膜,取右侧新鲜缺血侧脑组织0.1 g,在含有HBSS的溶液中充分研磨,制成单细胞悬液,离心(1000r/min)10 min,弃上清液,裂解红细胞,调细胞浓度至2×106个/mL。按照说明用Anti-NeuN一抗和山羊抗兔FITC标记神经元后,按照线粒体膜电位(JC-1)和凋亡试剂盒说明书要求孵育相关抗体,上机检测。
1.3 统计学方法
采用SPSS19.0统计软件进行分析;结果用均数±标准差(±s)表示,多组间比较采用单因素方差分析,多重两两比较采用LSD检验,检验水准α=0.05。
2 结果
2.1 各组神经元TFAM的mRNA表达分析
通过荧光染料法qPCR检测大鼠脑组织中的TFAM mRNA水平,利用各组检测数据进行定量分析(表1)。由定量结果可知,与NORMAL组相比,2h SHAM组的TFAM mRNA水平显著下降,随后逐渐上升,在12 h组中恢复至NORMAL组水平;相对于NORMAL组,SHAM组中TFAM mRNA水平的变化反映了麻醉及手术创伤本身对大鼠脑组织TFAM mRNA水平的影响,该影响随大鼠术后恢复而逐渐消失。MACO组与SHAM组的对比可以反映缺血性脑卒中(右侧颈总动脉阻断大脑中动脉血流)对大鼠脑组织中TFAM mRNA水平的影响,实验结果显示TFAM mRNA水平在缺血2 h时显著上调(P<0.05),随缺血时间延长而下降,缺血12 h组与6 h组无明显差异,在12 h时显著低于NORMAL组和SHAM组(P<0.05)。以上结果表明,脑卒中早期,脑组织中的TFAM mRNA水平上调,但随脑卒中时间延长而下调至低于正常的水平。
表1 大鼠脑PCR的TFAM 2-ΔΔCT 值Table 1 The value of TFAM 2-ΔΔCT of PCR in rats(±s)

表1 大鼠脑PCR的TFAM 2-ΔΔCT 值Table 1 The value of TFAM 2-ΔΔCT of PCR in rats(±s)
☆:与NORMAL组比较,P<0.05;★:与SHAM 2 h组比较,P<0.05;*:与SHAM 6 h组比较,P<0.05;▼:与 SHAM 12 h组比较,P<0.05;Δ:与 MCAO 2 h组比较,P<0.05
Group n TFAM 2-ΔΔCT NORMAL 6 1.02±0.22 2h 6 1.15±0.50★*MCAO 6h 6 0.17±0.08☆▼Δ MCAO 12h 6 0.23±0.09☆▼Δ SHAM 2h 6 0.10±0.06☆▼Δ SHAM 6h 6 0.21±0.18☆Δ SHAM 12h 6 1.14±0.72★*MCAO F 10.069 P-0.000-
2.2 各组神经元TFAM蛋白表达分析
通过Western Blot检测TFAM和β-actin蛋白水平(图2)的灰度值,将TFAM蛋白灰度值根据其对应β-actin蛋白灰度值进行标准化并定量分析。分析结果表明(表2),与NORMAL相比,SHAM组大鼠脑组织中TFAM蛋白水平受麻醉和手术创伤的影响先降低,而后恢复到正常水平,这与上述TFAMmRNA水平的变化趋势一致;与SHAM组相比,脑卒中2h的MACO组大鼠脑组织中TFAM蛋白水平显著上调(P<0.05),并在脑卒中12 h时继续上调(P<0.05),显著高于NORMAL组(P<0.05)和SHAM组的TFAM蛋白水平,表明在脑卒中早期(2h),脑组织中的TFAM蛋白水平上调,并随脑卒中时间延长(12h)而继续上调。

图1 各组大鼠脑组织中的TFAM蛋白水平Figure 1 Levels of TFAM protein in brain tissues of each group of rats
表2 大鼠脑TFAM蛋白灰度值Table 2 Gray scale of brain TFAM protein in rats(±s)
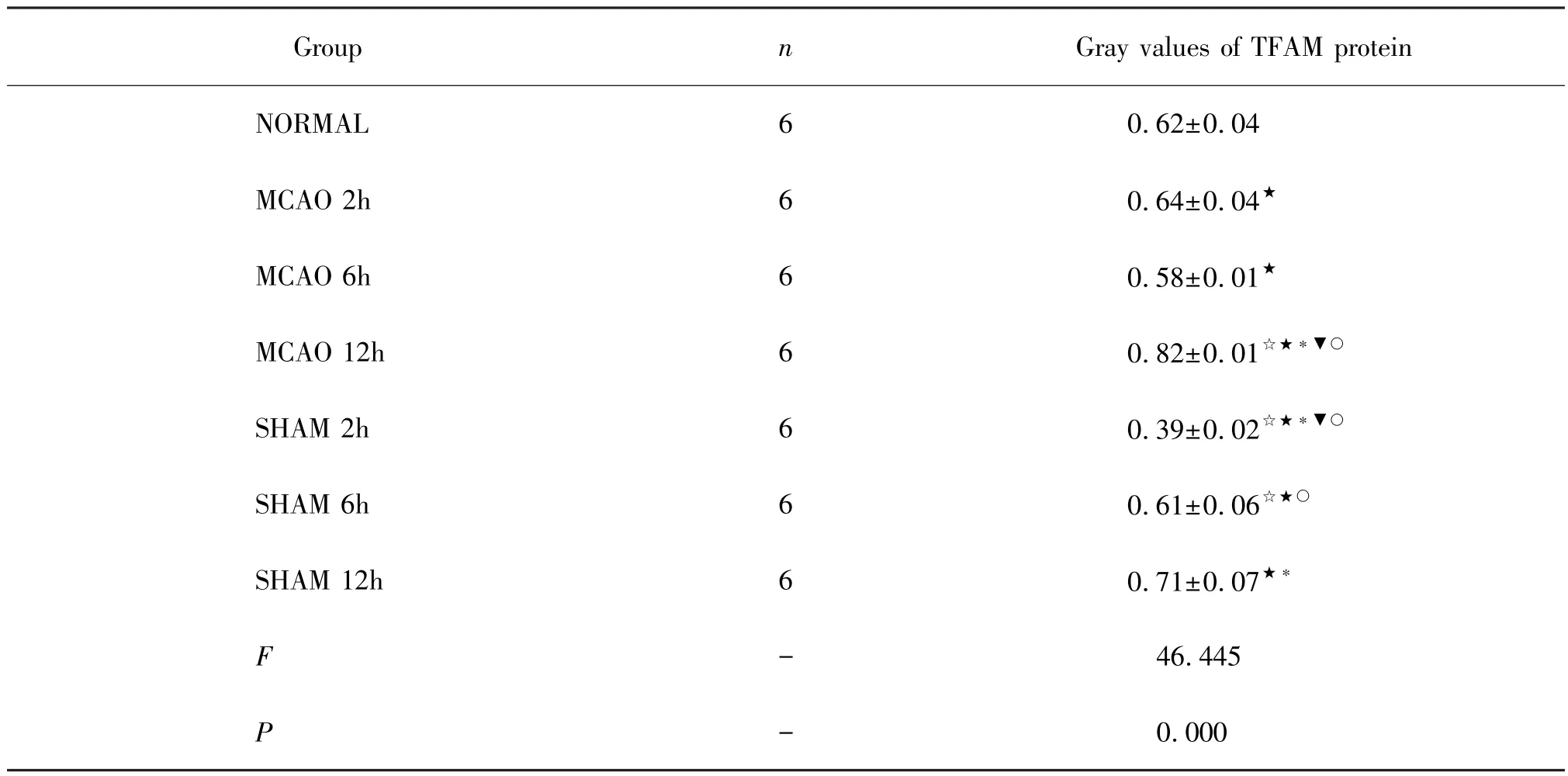
表2 大鼠脑TFAM蛋白灰度值Table 2 Gray scale of brain TFAM protein in rats(±s)
☆:与NORMAL组比较,P<0.05;★:与SHAM 2 h组比较,P<0.05;*:与SHAM 6 h组比较,P<0.05;○:与 SHAM 12 h组比较,P<0.05;▼:与 MCAO 2 h组比较,P<0.05
Group n Gray values of TFAM protein NORMAL 6 0.62±0.04 MCAO 2h 6 0.64±0.04★MCAO 6h 6 0.58±0.01★MCAO 12h 6 0.82±0.01☆★*▼○2h 6 0.39±0.02☆★*▼○SHAM 6h 6 0.61±0.06☆★○SHAM 12h 6 0.71±0.07★*F-46.445 SHAM P -0.000
2.3 各组神经元线粒体膜电位及凋亡分析
通过流式细胞术检测各组大鼠的脑皮层神经元线粒体膜电位,P4门中标记的是线粒体膜电位降低的细胞(图2);根据流式细胞术检测结果,将各组中线粒体膜电位降低的神经元进行定量分析,与NORMAL组相比,SHAM 2 h组神经元线粒体膜电位显著下降,与SHAM 6 h组、SHAM 2 h组相比有显著差异,SHAM 12 h组中线粒体膜电位有所恢复,表明手术本身因素(如麻醉和创伤)对脑皮层神经元的线粒体膜电位有影响;与SHAM组相比,MACO 2h组神经元线粒体膜电位显著低于SHAM组(P<0.05);MACO 6h组神经元线粒体膜电位有所恢复,SHAM组神经元线粒体膜电位低于MACO组(P<0.05);MACO 12h组和SHAM 6h、SHAM 12h组神经元线粒体膜电位相比无显著差异(表3)。

图2 各组神经元线粒体膜电位检测图Figure 2 Detection ofm itochondrialmembrane potential of nerve cells in each group
表3 线粒体膜电位JC-1单体Table 3 M itochondrial JC-1 monomer(±s)

表3 线粒体膜电位JC-1单体Table 3 M itochondrial JC-1 monomer(±s)
*:与NORMAL组比较,P<0.05;△:与SHAM 2 h组比较,P<0.05;★:与 SHAM 6 h组比较,P<0.05;▼:与 SHAM 12 h组比较,P<0.05;#:与 MCAO 2 h组比较,P<0.05;☆:与 MCAO 6 h组比较,P<0.05
Group n JC-1monomer NORMAL 5 15.62±1.22 2h 5 65.52±2.15*△▼★☆MCAO 6h 5 26.88±1.27*△▼#★MCAO 12h 5 38.40±2.38*△#☆SHAM 2h 5 50.16±1.51*▼#MCAO 6h 5 43.90±1.96*△★☆SHAM 12h 5 39.34±1.08△☆F-347.448 SHAM P -0.000
在用PI+AnnexinV-FITC检测细胞凋亡的实验中,PI标记阴性而AnnexinV-FITC标记阳性,阳性者是早期凋亡的细胞,在流式细胞术检测中,是位于Q4门中的细胞(图3);在对NORMAL、SHAM和MACO三个组的大鼠皮层神经元进行流式细胞术检测之后,将各组凋亡早期的细胞进行统计并做定量分析(表4)。SHAM 2h组和MACO组的细胞凋亡水平有差异,且均显著高于NORMAL组细胞凋亡水平(P<0.05);SHAM 6h组和MACO组的细胞凋亡水平降低且低于NORMAL组,但SHAM组和MACO组无差异;与6 h相比,SHAM 12h组和MACO组的细胞凋亡水平升高(P<0.05),MACO组水平显著低于SHAM组(P<0.05)。

图3 流式检测大鼠皮层神经元凋亡图Figure 3 Detection of the apop tosis of cortical neurons by Flow cytom etry in rats
表4 大鼠脑神经元凋亡数Table 4 The number of brain neuron apoptosis in rats(±s)

表4 大鼠脑神经元凋亡数Table 4 The number of brain neuron apoptosis in rats(±s)
*:与NORMAL组比较,P<0.05;△:与SHAM 2 h组比较,P<0.05;☆:与 SHAM 6 h组比较,P<0.05;▼:与 SHAM 12 h组比较,P<0.05;#:与 MCAO 2 h组比较,P<0.05;▯:与MCAO 6 h组比较,P<0.05
Group n The number of neuron apoptosis NORMAL 5 71.04±1.69 2h 5 86.28±3.31*△☆▼▯MCAO 6h 5 46.88±2.54*△▼#MCAO 12h 5 56.76±1.72*△☆▼#▯SHAM 2h 5 80.94±0.94*☆#SHAM 6h 5 46.36±1.40*△▯SHAM 12h 5 74.08±0.84☆△F-271.080 MCAO P -0.000
3 讨论
局部脑组织缺血、缺氧,使神经元线粒体能量产生减少,活性氧的产生增加,钙内流,内源性凋亡通路激活,致神经元受损[4]。本次研究也发现模型组线粒体膜电位较对照组低,早期凋亡参与发病过程,进一步阐释了线粒体功能障碍与脑卒中发病相关。脑缺血2 h起对神经元线粒体膜电位产生影响,直到线粒体膜电位在6 h时逐渐恢复并接近正常水平,这说明脑缺血引起的神经元线粒体膜电位降低要早于脑组织坏死发生,这也与神经元在脑缺血2 h时就已经发生早期凋亡的结果相一致。活性氧的大量产生致细胞线粒体DNA、蛋白质空间结构发生严重损伤[5]。本研究显示,在脑缺血6 h时脑组织坏死明显,可能是脑缺血后6 h时神经元TFAM降低的主要原因。有研究表明在心肌细胞缺血缺氧时,TFAM能够抑制线粒体ROS的产生而使mtDNA免受损伤[6]。此外发现过表达TFAM可抑制心肌梗死后mtDNA拷贝数及细胞凋亡水平,促进线粒体的生物合成[7,8]。研究者建立过表达TFAM转基因(Tg)小鼠模型,对野生型(WT)和TFAM-Tg小鼠均行20 min双侧颈总动脉闭塞,过表达TFAM小鼠海马CA1区细胞色素C阳性神经元数量明显少于WT小鼠,TUNEL神经元数量显著低于WT小鼠,表明TFAM过表达可能是通过减少线粒体的通透性改变来减少迟发性神经元的死亡,其机制不明[9]。而在本研究中,脑缺血2 h线粒体膜电位的降低引起了神经元的早期凋亡,TFAM可能维持了线粒体的完整性,但并没有阻止线粒体膜电位降低及神经元的早期凋亡,而该过程可能有其他通路参与。
线粒体作为细胞内重要有氧呼吸和产能的细胞器,对缺氧极其敏感,大量活性氧释放到细胞质中,使mtDNA受到损伤(形态改变)[10]。TFAM是核基因编码后转移到线粒体内的一种小分子肽,是mtDNA转录、复制的重要激活因子,维持mtDNA完整性,可抑制细胞凋亡[11]。大鼠脑缺血6 h后开始出现明显的组织坏死,但神经元在脑梗发生2 h时就已发生凋亡而且程度明显大于SHAM及NORMAL组,直到6 h时凋亡发生率逐渐降到最低值,这也可能与6 h时脑组织开始坏死有关。在12h时SHAM组凋亡水平接近NORMAL组,而MCAO组神经元的凋亡都低于SHAM及NORMAL组,这可能与手术后对脑组织造成持续性损伤有关。有学者发现,细胞发生氧化应激时,PGC-1α表达上调使TFAM的表达增加,从而致TFAM与mtDNA的亲和力增加,进而维持mtDNA的稳定性,促进其修复。然而,随着氧化损伤的进一步加重致细胞核DNA损伤,使TFAM的表达量减少[12]。研究结果显示,脑卒中2 h时,可能因细胞的应激作用使TFAM的表达增高,但不能抑制线粒体膜电位的下降及细胞的早期凋亡。随着神经元损伤加重,在缺血6 h时TFAM的表达渐趋稳定,膜电位也逐渐接近正常水平,细胞凋亡率降低。
缺氧使线粒体能量障碍,引起MPTP开放,使线粒体膜电位降低[13]。本研究也显示MCAO模型组线粒体膜电位较两对照组低。在发生缺氧及其他应激损伤时,内膜通透性会发生改变,基质内的Ca2+和炎症因子等进入胞质,引起细胞调亡[14]。目前有研究还发现,抑制大鼠脑缺血线粒体凋亡和动力相关蛋白1的激活、改善线粒体功能障碍和凋亡可抑制H2O2诱导的神经元凋亡[15];促进线粒体生成生物合成,维持其结构和功能的稳定,可以降低受损神经元的凋亡,有利于脑功能的恢复[16]。ROS可以和MPTP上二硫键结合调控MPTP而降低线粒体膜电位[17]。TFAM在线粒体的生物学合成中起重要作用,除了参与mtDNA的转录、复制,还参与mtDNA的合成后修饰和校对,其含量的变化引起线粒体膜电位的改变[18,19]。本实验结果显示随着脑缺血时间延长,TFAM的表达降低,MCAO组线粒体膜电位均较对照组低,这也阐明了线粒体膜电位与脑缺血后神经元损伤之间的相关性。TFAM缺失会导致线粒体功能的紊乱,因而与线粒体疾病、神经退行性疾病和衰老等密切相关[20,21],所以增加TFAM的量可能起到一定的神经保护作用。
综上所述,脑缺血2 h时,在神经细胞尚未出现损伤的情况下,TFAM可能通过调节线粒体数量和功能而起一定作用,但不能阻止线粒体膜电位的降低和神经元的早期凋亡。脑缺血6 h后,由于神经元损伤加重影响了TFAM转录,随着TFAM表达量渐趋稳定,线粒体膜电位下降率和凋亡率降低。

