牛乳源大肠杆菌生物被膜形成及抗生素的作用
李 芬,范玉堂,王丽娟,王宁宁,张 娟,王 妍,李勤凡
(1.新疆农业大学 动物医学学院,乌鲁木齐 830052;2.西北农林科技大学 动物医学院,陕西杨凌 712100)
奶牛乳房炎是影响全球乳业发展的重要疾病之一,每年给养殖业造成极大的经济损失[1]。在中国奶牛养殖中,大肠杆菌(Escherichiacoli)是引起奶牛乳房炎最重要的病原菌之一[2]。目前国内主要使用抗生素治疗奶牛乳房炎,但抗生素的不合理使用导致病原菌产生耐药性,给治疗增加了难度[3]。随着对大肠杆菌耐药机制的研究,发现细菌耐药与生物被膜(Biofilms,BF)的形成紧密相关[4]。
大肠杆菌易附着于物体表面形成BF[5],BF的形成影响细菌对抗生素的敏感性,使细菌出现耐药[6]。此外,BF对抗生素具有很强的抵抗性,一经形成就很难被彻底清除,易导致反复感染[7]。因此,如何有效突破大肠杆菌BF的保护作用杀灭细菌,对于治疗产BF的大肠杆菌引起的感染非常重要。
本试验对陕西关中地区分离的35株大肠杆菌进行BF形成能力鉴定、药物敏感性及抗生素对BF干预作用的检测,旨在了解奶牛乳房炎大肠杆菌BF的形成对耐药性的影响及抗生素对BF形成的影响,为合理选择药物控制大肠杆菌BF的形成提供资料。
1 材料与方法
1.1 材 料
1.1.1 菌株及来源 35株大肠杆菌从陕西省杨凌区、华阴市、宝鸡市3 个规模化奶牛场乳房炎奶牛的乳样中分离鉴定,保存于西北农林科技大学动医学院生物毒素实验室,检测其BF阳性的菌株数、BF的成分和BF的形成能力及抗生素对BF形成的作用[8]。
1.1.2 主要试剂及仪器 刚果红、考马斯亮蓝均为Sigma公司产品;Spark多功能酶标仪为瑞士帝肯有限公司产品,荧光显微镜为Olympus 公司产品。
1.2 方 法
1.2.1 BF阳性菌检测 复苏待测菌株后,接种于LB肉汤中,37 ℃培养过夜,转接于刚果红琼脂固体培养基,37 ℃培养48 h后观察菌落颜色,黑色菌落为BF阳性菌,红色菌落为BF阴性菌[9]。
1.2.2 BF中卷曲菌毛及胞外纤维素的检测 参照文献[10],用刚果红考马斯亮蓝固体培养基检测菌株BF的成分,取5 μL 1.5×108CFU/mL的菌液滴加到含30 mg/mL考马斯亮蓝和40 mg/mL刚果红的无盐LB固体培养基中央, 28 ℃培养72 h后观察菌落形态、颜色。
1.2.3 菌株BF形成能力检测 参照文献[11]的方法将BF阳性菌株接种至LB肉汤中,37 ℃培养过夜,将菌液浓度调至1.5×108CFU/mL,于96孔板中每孔加入200 μL LB肉汤和10 μL菌液,空白对照组加入210 μL LB肉汤,每株菌做5个重复,37 ℃连续培养48 h;经甲醇固定,结晶紫染色,冰乙酸脱色后,测定其OD570值。
结果判定:以空白对照组的2倍OD值作为临界值(ODC),根据OD570值将BF形成能力强弱分为以下几类:OD≤ODC,不能形成BF(-);ODC
根据试验结果筛选1株强成膜能力的菌株进行后续试验。
1.2.4 浮游菌最小抑菌质量浓度和最小杀菌质量浓度的测定 以大肠杆菌ATCC 25922作为质控菌,按照微量肉汤稀释法测定头孢噻呋、链霉素、四环素、环丙沙星、庆大霉素、青霉素这6 种抗生素的最小抑菌质量浓度(MIC)及最小杀菌质量浓度(MBC),结果判定参照CLSI(2015)标准[12]。
1.2.5 BF菌最小抑菌质量浓度和最小杀菌质量浓度的测定 试验菌株在96 孔板上培养48 h 形成BF后,用无菌PBS轻柔漂洗除去浮游菌,用微量肉汤二倍稀释法倍比稀释各个抗生素,使得各个抗生素终质量浓度依次为1.25、2.5、5、…、2 560 μg/mL,取200 μL不同质量浓度的抗生素分别加入到具有BF的96孔板中,每个质量浓度3 个重复,对照组加等量MH肉汤。结果判定:测定OD600值,培养24 h后再次测定OD600值,当培养前后的OD600值相近时判定为BF的最小抑菌质量浓度(MBIC);将高于BF菌最小抑菌质量浓度孔中的混合液混匀,依次吸取100 μL 混合液,分别均匀涂布于LB 琼脂培养基中,培养24 h后测定的OD600值判定为BF菌最小杀菌质量浓度(MBBC)。
1.2.6 不同质量浓度抗生素对被膜态大肠杆菌形成的抑制作用 根据上述所测得的最小抑菌质量浓度,将头孢噻呋、链霉素、四环素、环丙沙星、庆大霉素、青霉素这6 种抗生素配制成1/2 MIC、MIC、2 MIC、4 MIC、8 MIC的质量浓度,96 孔板每孔加入100 μL稀释好的菌液和100 μL配制好的不同质量浓度抗生素,空白对照组加入200 μL菌液,37 ℃培养24 h后,参照结晶紫染色法进行处理,测定其OD570值。抑制率=(空白对照组OD值-试验组OD值)/空白对照组OD值×100%。
1.2.7 不同质量浓度抗生素对被膜态大肠杆菌BF的清除作用 在96 孔板中培养试验菌株形成BF后,弃去残存培养液,用无菌PBS轻柔漂洗除去浮游菌,分别取200 μL质量浓度为1/2 MIC、MIC、2 MIC、4 MIC、8 MIC的头孢噻呋、链霉素、四环素、环丙沙星、庆大霉素、青霉素加入到具有BF的96孔板中,同时加入等量MH肉汤作为对照,每组3 个重复,37 ℃培养24 h,参照结晶紫染色法处理,测定其OD570值,计算清除率。清除 率=(空白对照组OD值-试验组OD值)/空白对照组OD值×100%。
2 结果与分析
2.1 BF的形成能力检测
结果表明,试验株中有19株为BF阳性菌(54.29%),16株为BF阴性菌(45.71%)(图1)。BF阳性菌中有6株(31.58%)BF形成能力强,10株(52.63%)BF形成能力中等,3株(15.79%)BF形成能力弱。
2.2 BF中卷曲菌毛及胞外纤维素的检测
19株BF阳性菌在刚果红考马斯亮蓝固体培养基上可以形成4种颜色的菌落,其中红色粗糙干燥型12株(63.16%),表示BF同时含有卷曲菌毛和胞外纤维素;棕色干燥粗糙型1株 (5.26%),表示BF含有卷曲菌毛;粉色干燥粗糙型2株(10.53%),表示BF只含胞外纤维素;白色光滑型4株(21.05%),表示BF不含胞外纤维素和卷曲菌毛;此外,BF同时含有卷曲菌毛和胞外纤维素的红色粗糙干燥型的菌株成膜能力最强(图2)。
2.3 BF形成前后的耐药性
通过对大肠杆菌BF的形成时间测定,发现该形成是个动态过程,72 h内BF形成量先增加后减少,48 h时BF形成量最大,因此BF形成的最佳培养时间为48 h。
由表1可知,BF形成前,大肠杆菌对环丙沙星及头孢噻呋这2种抗生素较敏感,对其余几种抗生素显示不同程度耐药;BF形成后,大肠杆菌对这6种抗生素的最小抑菌质量浓度及最小杀菌质量浓度分别提高4~16倍、8~64倍。
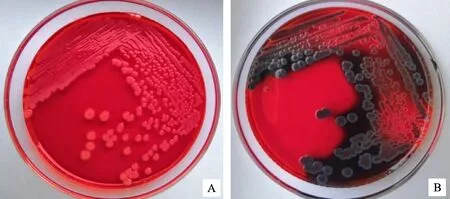
A.BF阴性菌; B.BF阳性菌

A. 红色干燥粗糙型; B. 棕色干燥粗糙型; C. 粉色干燥粗糙型; D. 白色光滑型
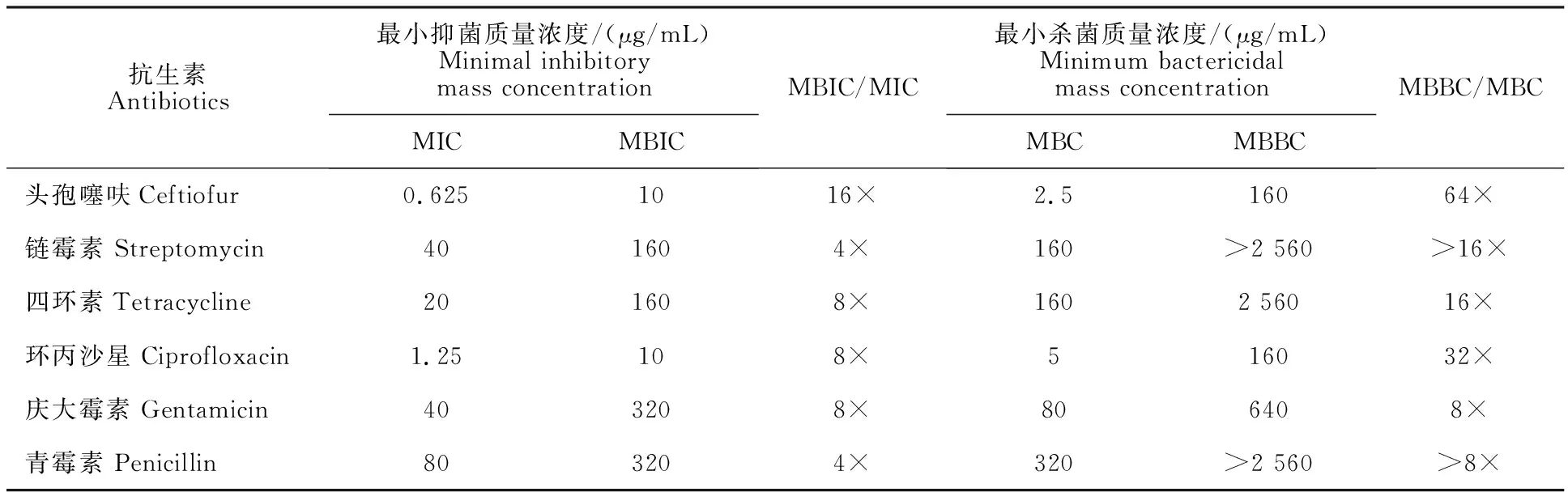
表1 大肠杆菌BF形成前后耐药性的变化Table 1 Changes of drug resistance before and after BF formation in E. coli
2.4 不同质量浓度抗生素对被膜态大肠杆菌形成BF的抑制作用
抗生素质量浓度越大对BF形成的抑制率越高;在抗生素质量浓度小于MIC时,只有环丙沙星的抑制作用较明显,其余5种抗生素的抑制作用均不明显;当抗生素质量浓度大于MIC时,所有抗生素对BF的形成均产生明显的抑制作用,其中头孢噻呋及环丙沙星的抑制效果较好,链霉素和青霉素的效果较差(图3)。
2.5 不同质量浓度抗生素对被膜态大肠杆菌BF的清除作用
抗生素质量浓度越大对BF的清除率越高;抗生素质量浓度为MIC时,环丙沙星和头孢噻呋对BF的清除效果较好,青霉素和链霉素的清除效果较差(图4)。
2.6 抗生素对被膜态大肠杆菌的杀灭效果
荧光染料PI可以进入死菌内发出红色荧光,从图5可以看出,环丙沙星、头孢噻呋组的死菌数多,青霉素和链霉素组中的死菌数最少。说明环丙沙星、头孢噻呋对被膜态大肠杆菌的杀灭效果较好。

图3 不同抗生素对被膜态大肠杆菌的抑制作用Fig.3 Inhibition effect of different antibiotics on biofilm of E. coli

图4 不同抗生素对被膜态大肠杆菌的清除效果Fig.4 Clear effect of different antibiotics on biofilm of E.coli
3 讨 论
奶牛乳房炎是全球范围内最常见且位居奶牛四大疾病之首的疾病[13]。大肠杆菌是常见的成膜致病菌,作为引起奶牛乳房炎的重要病原菌严重阻碍畜牧业的健康发展[14]。临床上抗生素大多是针对浮游微生物的,然而环境中大肠杆菌主要以集落或者BF的形式存在,常规剂量很难起到有效作用[15-16]。
本研究对从患乳房炎的奶牛样中分离的35株大肠杆菌BF检测发现,BF阳性率为 54.29%,以强、中成膜能力为主(84.21%)。大肠杆菌BF的检出率和成膜能力可能与宿主、地域、疾病类型以及用药种类等有关。夏琦琦等[17]从水貂肠道中分离的54株致病性大肠杆菌BF阳性率为 90.70%,以强成膜能力为主(81.50%);喻华英等[18]从犊牛粪便中分离的 60株大肠杆菌BF阳性率为15.0%,以中等成膜能力为主,仅有1株BF呈强阳性。卷曲菌毛和胞外纤维素是影响细菌在接触面附着和BF形成能力的两个重要表面成分,在BF形成过程中发挥特定的作用[19]。本研究对19株菌的BF成分卷曲菌毛和胞外纤维素进行检测,发现63.16%的菌株BF同时含有卷曲菌毛和胞外纤维素,且这部分菌株BF的形成能力较强。

A. 对照组; B. 链霉素组; C. 头孢噻呋组; D. 四环素组; E. 庆大霉素组; F. 青霉素组; G. 环丙沙星组
BF是导致大肠杆菌耐药性增加的一个重要因素,BF的形成可降低其对抗生素的敏感性[3]。Tremblay等[20]研究发现,BF形成后,被膜菌较浮游菌的耐药性提高4~2 048倍。本研究选取临床上治疗乳房炎常用的头孢噻呋、链霉素、青霉素、环丙沙星、庆大霉素和四环素这6种抗生素作为试验药物,检测大肠杆菌BF形成前后的耐药性,发现大肠杆菌BF形成后6种抗生素的最小抑菌质量浓度和最小杀菌质量浓度分别提高4~16倍、8~64倍。
细菌BF给医疗、环境卫生以及养殖业等许多领域带来严重的危害,因此研究有效抑制BF形成的方法很有必要。本研究选择临床常用的6种抗生素研究其对BF的抑制作用发现,随抗生素质量浓度的增大,对BF形成的抑制率越高,其中环丙沙星抑制效果较好,可以控制BF的早期形成,这与环丙沙星等喹诺酮类的渗透性较强有关[21]。
本研究同时进行6种抗生素对BF的清除效果和对BF内细菌的杀灭作用研究,发现环丙沙星对BF内细菌的杀灭效果和BF的清除效果最好,在质量浓度为MIC时清除率达50%以上,这与相关文献中报道的相对高质量浓度环丙沙星可以破坏BF的结果一致[22]。本研究中,即使环丙沙星质量浓度达到4 MIC时,对BF的清除率也仅为64.9%,因此要想彻底清除BF,可以其他参考文献报道的方法考虑联合用药[23-24]。

