重庆卷丹病毒检测与脱毒方法研究
符勇耀,杨利平,高海洪,徐文姬,雷美艳,王安祥
(1.长江师范学院 现代农业与生物工程学院,重庆 408100; 2重庆市药物种植研究所,重庆 408435)
卷丹(LiliumlancifoliumThunb.,2n=3x=36)又名宜兴百合、虎皮百合,是百合属(LiliumL.)多年生球根类植物,在中国分布范围极广[1]。作为自然存在的三倍体,卷丹不仅食药用价值高,还是重要的花卉之一,深受广大消费者喜爱。湖南龙山、江苏宜兴和安徽霍山是中国卷丹的主产区[1-2]。在重庆地区海拔1000m左右山地生长广泛,具有独特的地理和气候条件,近年来,在重庆南川、黔江和秀山等区县大面积引种湖南卷丹,种植面积已达0.16万hm2,年产量约3万t,初步形成产业规模。然而,卷丹在栽培过程中多采用无性繁殖,造成病毒不断累积,使植株发生病毒病,严重危害其产量和品质。目前已报道侵染百合的病毒达19种以上,其中最主要的病毒为百合斑驳病毒(Lilymottlevirus, LMoV)、黄瓜花叶病毒(Cucumbermosaicvirus,CMV)和百合无症病毒(Lilysymptomlessvirus, LSV)[3-4]等。这3种病毒通常以其中2种或3种同时侵染百合植株,给百合生产造成严重问题[5-7]。利用化学药剂或生物制剂难以对病毒病进行有效防治,直接利用百合脱毒苗已成为控制病毒病的重要措施[4, 8-9]。因此,建立一种针对卷丹的脱毒快繁技术,对其产业发展具有重要意义。
目前百合脱毒技术主要以百合微茎尖培养为主,并结合其他处理方式。王超等[10]通过对5种百合脱毒研究发现,即使以0.3~0.5mm 最适脱毒长度的茎尖进行培养,CMV脱毒率不足65%,而LSV不足50%,且成活率为57.62%。高慧卿等[11]将百合组培苗65℃高温预处理30min后,剥取0.2~0.5mm茎尖进行脱毒培养,CMV和LSV的脱毒率分别为46.88%和74.65%,但平均成活率不到60%。孙明伟等[12]研究发现剥取0.4~0.7mm茎尖进行培养,脱毒率为61%,存活率达76%。周晓波等[13]将卷丹珠芽置于38℃高温条件处理20d后,剥取0.4~0.6mm茎尖,接种在添加5~10mg/L病毒唑的芽诱导培养基中,脱毒率可达90%,但成活率仅为60%左右。上述方法中剥离的茎尖均小于0.8mm,茎尖不易剥取,需要借助解剖镜等仪器设备,操作复杂,易污染且再生率低。
病毒易于通过维管系统移动,而茎尖维管系统尚未发育完善,通常剥取茎尖越小,其脱毒率越高,但成苗率越低;反之,其成活率虽然提高,但脱毒率较低。因此,克服两者的矛盾,便可以打破百合脱毒生产的瓶颈,如此既提高茎尖再生率,又提高脱毒率。本研究以含病毒的湖南卷丹珠芽为材料,通过高低温交替处理结合2次茎尖培养 (1.0~1.5mm),运用RT-PCR方法对脱毒效果进行检测,构建一种操作简便、高效的卷丹脱毒快繁方法。研究结果将促进百合脱毒育苗工作的推广应用,为重庆地区卷丹产业发展提供技术保障。
1 材料与方法
1.1 试验材料
试验材料为优质卷丹种球,引自湖南郴州。种植于重庆市南川区三泉镇,采集种植2 a后的卷丹珠芽备用。
1.2 脱毒试验方法
1.2.1 病毒引物设计 百合常见病毒CMV、LMoV、LSV和百合X病毒(Lily virus X,LVX)检测引物参照陈进等[14]的引物序列。引物由华大基因重庆分公司合成。
1.2.2 病毒PCR检测 以引种2 a后发生分球的卷丹珠芽或经过脱毒的组培苗为材料,利用植物RNA小量提取试剂盒(R4151, TIANGEN)提取总RNA,经过电泳检测,采用植物cDNA快速反转录试剂盒(KR116, TIANGEN)合成第一链cDNA。反转录反应包括总RNA 2 μg,5×g DNA Buffer 2 μL,RNase-Free ddH2O 补至10 μL,42 ℃孵育5 min,冰上放置;然后添加10×King RT Buffer 2 μL,FastKing RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNase-Free ddH2O 5 μL,反应程序为42 ℃孵育30 min, 70 ℃灭活5 min。PCR反应选用大连宝生物公司产品(RR001, TAKARA),PCR反应总体积为20 μL,包括:第一链cDNA 1 μL,10×Buffer(含20 mmol/L Mg2+)2 μL,2.5 mmol/L dNTP 2 μL,10 μmol/L正反向引物各0.5 μL,5 U/μLTaqDNA聚合酶0.2 μL,13.8 μL ddH2O。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共38个循环; 72 ℃延伸10 min;12 ℃保存。取5 μL PCR产物进行15 g/L琼脂糖凝胶电泳,利用BioRad凝胶成像仪分析结果。
1.2.3 高低温交替处理 以病毒检测阳性的卷丹珠芽为材料,在自来水下冲洗珠芽表面污垢,用洗衣粉泡10 min,并冲洗1~2 h,晾干。将处理好的珠芽置于4 ℃低温处理3~4 d,之后再置于38 ℃高温处理3~4 d,如此交替处理持续24~ 32 d。期间光照度为6 000~ 7 000 lx,光照时间为12 h/d,喷洒38 ℃无菌水保持珠芽湿度。
1.2.4 第一次茎尖培养 将经过高低温交替处理的珠芽剥去最外层,用洗衣粉泡10 min,并在流水下冲洗1~2 h,置于无菌操作台紫外照射15 min,用75%乙醇浸泡40 s,0.2%升汞溶液处理12 min,再用无菌水冲洗3~5遍。用灭菌滤纸吸干水分,利用解剖刀、镊子和解剖针剥取1 mm左右(<1.5 mm)的茎尖,以1瓶1颗的规格接种于MS+1.5 mg/L 6-BA+0.2 mg/L NAA+10 mg/L病毒唑的固体培养基(不含蔗糖)中暗培养7 d,然后转入温度为(25±2) ℃,光照度6 000~ 7 000 lx,12 h/d光照环境培养60 d,随机选取50个样本进行病毒检测并统计结果。
1.2.5 第二次茎尖培养 将经过1次茎尖培养诱导的不定芽继续剥取1 mm左右(<1.5 mm)茎尖,以1瓶3颗的规格接种于固体MS+1.5 mg/L 6-BA+0.2 mg/L NAA+10 mg/L病毒 唑+30 g/L蔗糖的培养基暗培养7 d,然后转入(25±2) ℃、光照度6 000~7 000 lx和12 h/d光照环境中继续培养60 d。随机选取50个样本进行脱毒检测,并统计结果。
1.3 脱毒苗快繁方法
1.3.1 鳞片不同部位的芽分化培养基筛选 将脱毒苗外层鳞片横切为上下两部分,将上部分、下部分和整块鳞片分别接种于含不同质量浓度 6-BA(0.5、1、1.5、2 mg/L)和NAA(0.05、0.2 mg/L)配比的MS基本培养基中,每瓶放3个,每个质量浓度梯度接种10瓶。培养条件为温度 (25±2) ℃,湿度60%~70%环境下暗培养7 d,转至光照度6 000~7 000 lx,光照时间12~14 h/d的环境中培养45~60 d。统计鳞片不同部位的出芽总数、出芽率和出芽系数等。
1.3.2 增殖培养基筛选及生根培养 将诱导出的不定芽接种到含0.3 mg/L NAA和不同质量浓度6-BA(0.5、1.5、2.5 mg/L)的MS或1/2MS培养基,每瓶培养基放5个,每个质量浓度梯度接种10瓶。培养条件为温度(25±2) ℃、湿度 60%~70%,光照度为6 000~7 000 lx、12~14 h/d。培养60 d后统计不定芽总数和增殖系数。将不定芽接种于含不同蔗糖质量浓度(0~100 g/L)的MS+0.5 mg/L 6-BA+0.2 mg/L NAA培养基培养,直至生根,统计生根情况。
1.4 数据统计分析
使用Excel 2013和SPSS 17.0软件对数据进行统计分析。采用Duncan’s法进行差异显著性检验 (P<0.05)。
2 结果与分析
2.1 珠芽获取与含病毒检测
从湖南郴州引种的卷丹在重庆南川区种植 2 a后种球发生明显退化,表现为3~6个球的分球现象,同时地上部分植株表现出病毒症状,如花瓣扭曲,子房和花柱畸形等(图1)。收集退化植株珠芽材料,以正常卷丹珠芽为对照,通过反转录RT-PCR对百合病毒CMV、LSV、LMoV和LVX进行检测。结果(表1)表明,正常卷丹珠芽中未检出百合病毒,而退化珠芽中主要含LSV和LMoV病毒,其中LSV检出率为66.7%,LMoV检出率为46.2%,混合带毒率为46.2%,未检出CMV和LVX病毒。说明重庆南川区引种卷丹主要感染病毒为LSV和LMoV病毒。

A.正常卷丹花部形态;B.退化卷丹花部畸形

表1 卷丹珠芽病毒检出率Table 1 Detection rate of virus in bulbils of L.lancifolium
2.2 一次茎尖培养脱毒效果
将卷丹珠芽通过紫外灭菌和表面消毒剂处理后,剥取1 mm左右(<1.5 mm)茎尖生长点接种于含病毒唑的芽分化培养基,15 d后发现,茎尖开始膨大变绿,30 d后茎尖开始生成小苗。统计结果表明(表2),1 mm左右(<1.5 mm)珠芽茎尖生长点成苗率平均为90.28%。随机选取50个脱毒幼苗,通过RT-PCR分析表明(图2-A和图2-B),LSV和LMoV病毒均被部分脱除,LSV脱毒率为52%,而LMoV脱毒率为44%(表3)。综上所述,剥取1 mm左右(<1.5 mm)茎尖培养,虽然成苗率较高但脱毒效果较差。1次茎尖培养脱毒苗需再次脱毒,以达到较为理想的脱毒效果。

表2 1.0~1.5 mm茎尖成苗率Table 2 Survival rate of 1.0-1.5 mm shoot tip

A.第一次茎尖培养后LSV脱毒验证电泳图。M.DNA 分子标记; 1~12.LSV验证结果;B.第1次茎尖培养后LMoV脱毒验证电泳图。M.DNA 分子标记; 1~12.LMoV验证结果;C.第二次茎尖培养后LSV脱毒验证电泳图。M.DNA 分子标记; 1~12.LSV验证结果。D.第二次茎尖培养后LMoV脱毒验证电泳图。M.DNA 分子标记; 1~12.LMoV验证结果

表3 茎尖培养脱毒率Table 3 Detoxification rate of shoot tip culture
2.3 2次茎尖培养脱毒效果
以1次茎尖培养60 d幼苗为材料,继续剥取1 mm左右(<1.5 mm)茎尖生长点接种于含病毒唑的芽分化培养基,培养直至获得脱毒幼苗。结果表明(表2),1 mm左右(<1.5 mm)小鳞茎茎尖继代的成苗率平均为90.68%,且污染幼苗数明显低于第一次珠芽茎尖污染幼苗数。随机选取50个脱毒幼苗,通过RT-PCR分析表明(图2-C和图2-D),LSV病毒和LMoV病毒绝大部分已被脱除。统计结果显示(表3),LSV脱毒率为88%,而LMoV脱毒率为86%,相比第一次茎尖脱毒培养,脱毒效果提高了将近1倍。
2.4 脱毒苗的组培快繁
2.4.1 不定芽诱导培养 将经过2次茎尖脱毒培养的外层小鳞片,用刀片从1/2处将其分为上、下两部分,转接到含不同激素浓度配比的芽分化培养基中,45 d时统计各处理丛生芽生长情况(图3)。结果表明(表4),不同激素含量对外层鳞片上部的诱导有显著差异,其中A2、A5的诱导率为24.45%和23.33%,而A4、A6均超过40%,A6诱导率最高,达47.78%。A4诱导的不定芽最多,诱导系数为2.88。激素对下部外层鳞片的诱导结果显示(表5),A6的芽诱导率最高,达到91.11%,而A1芽诱导率最低,为64.45%。诱导效果最好为A4,不仅诱导率达85.56%,且诱导系数为最高,为6.35。与上部分鳞片诱导结果相比,下部分鳞片诱导效果明显更优。激素对整瓣鳞片不定芽诱导结果如表6,诱导效果最佳的仍是A4,不定芽诱导率为87.78%,诱导系数为 3.70;较差为A2和A6配比,A2的芽诱导率最低,为57.78%,而A6的芽诱导系数最低,为 1.95。因此,下部鳞片受激素诱导不定芽效果最佳,其次是整瓣鳞片,最差为上部鳞片。
2.4.2 增殖继代培养及生根诱导 将外层鳞片诱导的丛生芽,切分成单个芽体,转接到不同培养基中继代培养,培养15 d后开始出现分化小芽,30 d分化的小芽鳞片逐渐增多、增大,分化芽的数量也增多(图3-g),其中B4、B5、B6在培养30 d

a-d: 一次茎尖脱毒培养.a.高低温交替处理后的珠芽; b.1.0~1.5 mm茎尖培养; c.培养30 d茎尖; d.培养60 d茎尖.e-f: 鳞片的快繁体系.e.下部鳞片诱导培养; f.45~60 d丛生不定芽; g.不定芽增值继代30 d; h.生根培养45 d

表4 激素对上部鳞片不定芽的诱导Table 4 Induction of adventitious buds in upper part of scales by phytohormones
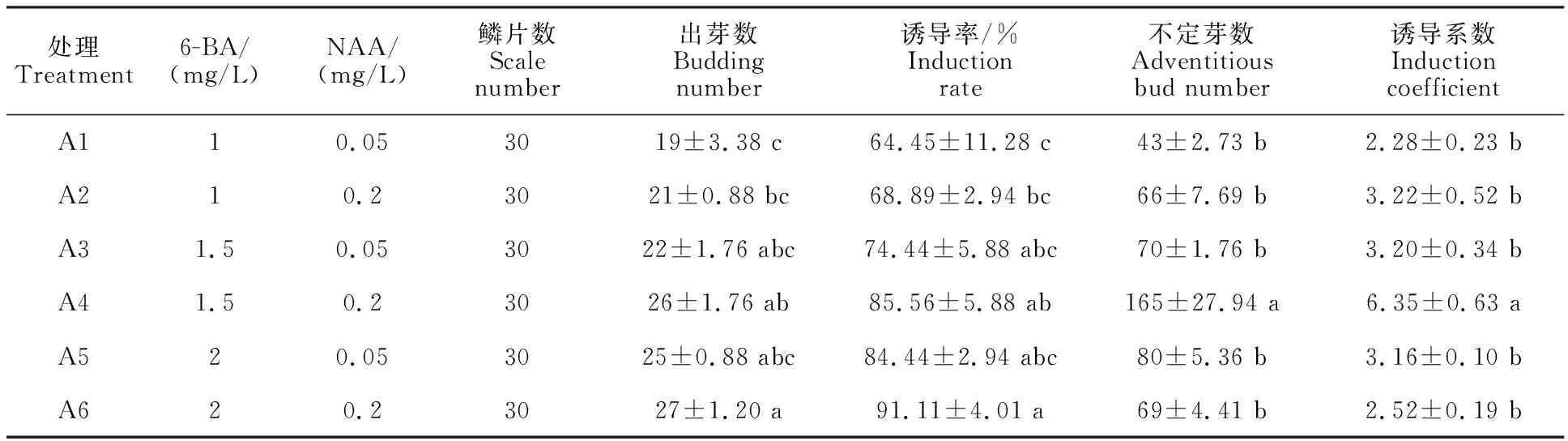
表5 激素对下部鳞片不定芽的诱导Table 5 Induction of adventitious buds in lower part of scales by phytohormones

表6 激素对整瓣鳞片不定芽的诱导Table 6 Induction of adventitious buds in whole scales by phytohormones
时已出根。结果显示(表7),B1、B2、B3增殖效果明显优于B4、B5、B6,说明1/2MS培养基不利于芽增殖分化,但能促进根提前形成。在NAA浓度一致时,高质量浓度6-BA促进不定芽增殖,其中B3(MS+NAA 0.3 mg/L+6-BA 2.5 mg/L+蔗糖30 g/L)增值倍数最大,增殖系数为3.39。将增殖无菌苗鳞片接种到含不同蔗糖浓度的生根培养基,结果表明(表8),在C3(含50 g/L蔗糖)中效果最优,培养20 d开始出现生根,45 d后生根率达到98.72%(图3-h)。
3 讨 论
卷丹是重庆地区百合主栽品种,种植卷丹已成为不少区县脱贫致富的重要经济手段。由于卷丹栽培方式多为无性自繁且技术含量不高,使引种的优良种球在种植2~3 a后发生明显退化现象。研究表明,病毒病是影响卷丹生产的瓶颈问题[13,15-17]。为促进重庆地区扶贫和卷丹产业发展,课题组于2015年和2016年先后从湖南引进优良的卷丹种球进行栽培。通过RT-PCR分析表明,在重庆南川区引种的卷丹主要感染LSV和LMoV,导致其鳞茎和花部品质下降。前人研究发现CMV、LMoV和LSV 3种病毒往往以其中2种或2种以上同时侵染百合,并且以CMV和LSV或者LMoV和LSV为常见[18-20],本研究发现与后者相似。对退化卷丹的病毒检测分析表明,LSV病毒的检出率(66.7%)明显高于LMoV病毒(46.2%),并且所有检出LMoV病毒的卷丹中均能检测到LSV病毒,因此推测正常卷丹在被LSV感染后,被其他病毒(如LMoV)感染的机率会显著增加。在实际生产中,非专业技术人员很难掌握传统剥取0.3~0.5 mm最适茎尖技术。因此,基于应用为主要目的,构建一套操作简便且脱毒效果优良的百合脱毒技术显得非常紧迫。

表7 激素和培养基对不定芽的增殖效果Table 7 Proliferation respone of phytohormone and media to adventitious bud

表8 蔗糖对生根的诱导Table 8 Response of sucrose content to rooting induction
在第一次茎尖脱毒培养中,尽管选择最优消毒方案[1],但茎尖污染率仍然偏高,平均为 23.33%,推测可能珠芽中含有部分内生真菌。在2次茎尖脱毒培养中,以无菌组培苗为材料,污染率显著降低,平均为10.83%。从脱毒效果来看,1次珠芽茎尖脱毒培养,LSV脱毒率(52%)高于LMoV脱毒率(44%)。而经过2次茎尖脱毒培养后,两者的脱毒效果相当,均高于85%。经过2次茎尖脱毒培养后,脱毒效果均大幅度提升,与郑丽娜等[21]发现单纯通过茎尖培养,2次茎尖培养比1次茎尖培养脱毒效果更好的结论一致。与利用小于0.8 mm的茎尖脱毒相比[14, 22],本研究利用高低温交叉处理结合2次剥取1 mm左右 (<1.5 mm)茎尖脱毒培养,获得了理想的脱毒效果(脱毒率> 85%)。该方法打破了一般认为茎尖大于1.0 mm达不到脱毒效果的认识,为百合脱毒方法的改进提供了新的思路。经过2次茎尖脱毒处理,虽然耗时长,但剥取茎尖可在肉眼下直接操作,降低设备需求及操作技能,降低污染率;同时选择较大茎尖,明显提高茎尖存活率(未污染的茎尖存活率达90%)。该方法有利于卷丹脱毒苗的工厂化生产,由于试验只针对LSV、LMoV 2种病毒进行测试,其他病毒是否也能达到相同效果有待研究。
卷丹的组培快繁主要以种球鳞片、珠芽鳞片或小鳞茎为材料[1,15,23-24]。本研究尝试以无菌小鳞茎外层鳞片为材料,通过比较不同部位不定芽诱导效果发现:下部鳞片>整瓣鳞片>上部鳞片,其中,下部鳞片不定芽诱导系数可达6.35,与付娜等[25]发现百合单瓣珠芽基部在组培时不定芽诱导数最多的结果一致。本试验发现,上部鳞片诱导产生不定芽主要位于横切伤口处,其余位置并未有不定芽产生,表明影响鳞片诱导的因素除激素配比外,还包含切口位置及大小。下部鳞片诱导出的不定芽除了在切口处,其周边都有不定芽产生。这可能是下部鳞片产生更多不定芽的原因。在以整瓣鳞片为外植体的诱导过程中,不定芽的发生位点也主要位于基部。另外,本研究获得不定芽的增殖随着6-BA质量浓度升高而随之增加,最优增殖培养基为MS+2.5 mg/L 6-BA+ 0.3 mg/L NAA+30 g/L蔗糖,增殖倍数达 3.39,与周晓波等[15]的研究结果相似,高质量浓度6-BA有利于不定芽发生。在生根培养过程中发现,卷丹在常规继代培养基只要添加一定量的(30~100 g/L)蔗糖便可以生根,但是在50 g/L时生根效果最佳。如果低于30 g/L或者不添加蔗糖,生根率就很低,这与前人的研究有所不同[15,26],前期结果主要强调NAA和活性炭对百合生根的影响,而本试验首次发现C源对卷丹生根具有重要作用。另外,减少大量元素(如利用1/2MS代替MS培养基)促进根的提前形成。
4 结 论
在重庆南川区引种的湖南卷丹主要感染病毒为百合斑驳病毒(LMoV)和百合无症病毒(LSV)。以卷丹珠芽为材料,通过高温(38 ℃)和低温(4 ℃)的交替处理,结合2次茎尖脱毒培养能有效去除百合LSV和LMoV病毒,脱毒率超过85%以上;剥取的茎尖长度为1.0~1.5 mm,对仪器要求不高、容易操作,且茎尖更容易存活,存活率达90%。进一步利用无毒幼苗的外层鳞片下部进行组培快繁,提高了不定芽诱导系数和增殖系数,最佳芽诱导培养基为MS+1.5 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖,芽诱导系数为6.35,最佳芽增殖培养基为MS+ 2.5 mg/L 6-BA + 0.3 mg/L NAA + 30 g/L蔗糖,增殖系数为3.39。鳞片在含50 g/L蔗糖的生根培养基中诱导效果最优,生根率为98.72%。本研究获取大量优质脱毒幼苗,方法简便、高效,为重庆地区卷丹产业发展奠定基础。

