一种初步判断细菌类微生物在土壤中定殖能力的方法
吴 翔,唐 亚,甘炳成*,彭卫红,谢丽源,谭 昊,陈 影,贾定洪,黄忠乾,谭 伟,唐 杰,何晓兰
(1.四川省农业科学院土壤肥料研究所,农业农村部西南区域农业微生物资源利用科学观测实验站,农业农村部西南山地农业环境重点实验室,四川 成都 610066;2.四川大学建筑与环境学院,四川 成都 610065)
目前,农业生产过程中化学肥料的施用给环境带来的负面影响越来越受到人们重视,而微生物类肥料和农药制品因为其环境友好性被认为是其最佳的替代品或补充品。因此,功能微生物在农业领域的研究越来越多,在大量的研究工作中筛选获得的各类农用功能微生物中细菌类占有重要的比例,它们成为研究重点的原因不仅因为在如促生[1-2]、抗病[3-5]等功能方面效果明显,也因为其生长速度快,培养条件要求低。
从筛选获得到生产应用,功能微生物的定殖能力对其应用潜力具有决定性作用,甚至有学者基于定殖能力来筛选功能微生物[6],可见定殖能力对于功能菌株的重要性。决定功能微生物在植物根际定殖能力的影响因素较多[7],对于在营养丰富的培养条件下分离、筛选所得的功能微生物,判断它们在复杂的环境中的定殖能力是功能微生物从研发走向应用的必经之路。土壤是农用功能微生物的主要应用环境,目前检测判断该类功能微生物定殖能力的方法有盆栽[3,6,8]、田间试验[9]等,将功能微生物应用于土壤,再通过分析定殖载体中功能微生物的数量来判断其定殖能力的大小[10]。这种方法准确,但是操作繁琐、所需时间长,不仅包括采集样品、分离培养和对应菌株的鉴定确认等程序,还包括微生物施入载体的试验设计、场地选择、环境条件分析等其它的配套设施投入和相关数据的分析检测。因此,简便、准确地判断功能微生物在土壤中定殖能力的方法,不仅可以减少繁琐的操作程序和功能微生物的研究开支,更能反向指导在研究过程中筛选出在应用时可能具有强环境适应潜力的菌株,缩短功能微生物从研发到应用的时间,对促进微生物制品在农业的应用推广,进而推进生态环境良好健康发展具有重要的意义。因此,选择一个简便、准确的方法判断功能微生物在土壤中的生存能力的研究显得尤为重要。
1 材料与方法
1.1 供试菌株和抗生素药敏片
本研究所用9株菌株为前期筛选所得对烟草生长具有促进作用的功能微生物,分别编号1~9号,其中菌株中5、6、7号3株为放线菌,其余为细菌,它们分别是1号:Bacillus tequilensis,2号:Enterobacter asburiae,3号:Enterobacter xiangfangensis,4号:Klebsiella variicola,5号:Streptomyces pratensis,6 号:Streptomyces albidoflavus,7 号:Streptomyces. microflavus,8号:Pseudomonas aeruginosa,9号:Bacillus flexus。使用的药敏试纸(北京)种类及含量见表1。
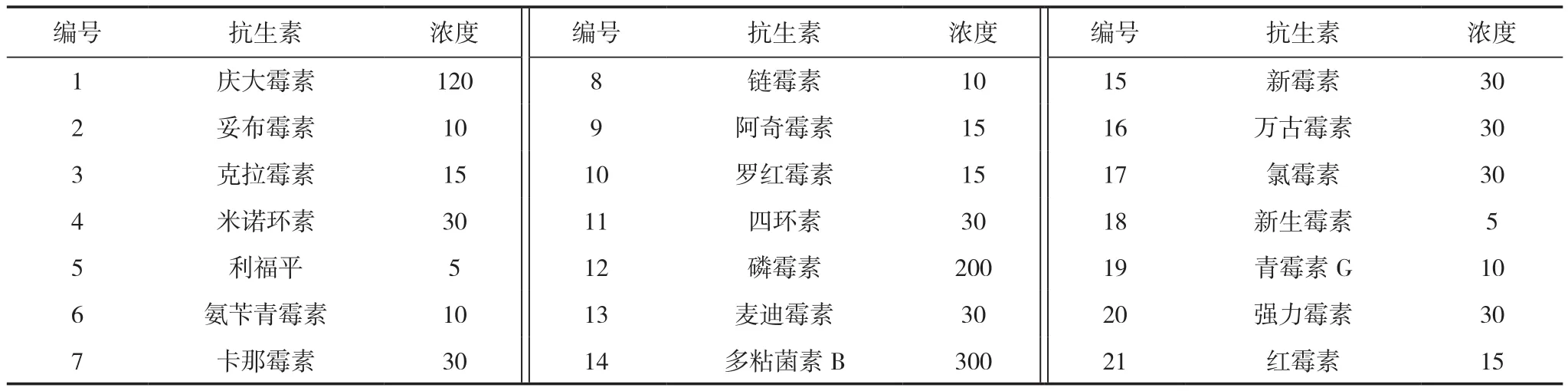
表1 21种抗生素药敏片种类和浓度 (μ g/片)
1.2 培养基
细菌培养基为牛肉膏蛋白胨培养基,放线菌培养基为高氏一号[11],混合发酵培养液:胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH值7.4。
1.3 抗生素药敏片在菌株平板上产生抑菌圈直径的分级
将供试9株微生物菌株分别于对应培养基琼脂平皿上进行平板涂布,再将21种抗生素药敏片贴于琼脂表面,静置5 min后翻转平皿,倒置30℃培养24~48 h后,测量并记录抑菌圈直径,计算其平均值[12]。每种抗生素3个重复,以不接菌的混合发酵培养液为空白对照(CK)。
根据21种抗生素药敏片对待测菌株的抑菌圈直径对其进行分级:直径为0 cm的为Ⅰ级,0 cm<D≤1 cm为 Ⅱ 级,1 cm<D≤ 2 cm为 Ⅲ级,2 cm<D≤ 3 cm为Ⅳ级,3 cm<D≤ 4 cm为Ⅴ级,4 cm<D≤5 cm为Ⅵ级,…,并统计该菌株抑菌圈直径在各个级别的数量。根据统计结果,计算待测菌株对抗生素的敏感值,计算公式如下。
抗生素敏感值=1×Ⅰ级范围的数量+2×Ⅱ级范围的数量+…+N×N级范围的数量
1.4 利福平标记菌株
为了准确从盆栽土壤中检出待测菌株,参考张冬冬等[13]的方法对各菌株进行标记。在培养基中加入浓度为50 μ g/mL的利福平,并按照50 μ g/mL的含量阶梯式递增浓度,驯化9株菌具有抗300 μ g/mL利福平的能力,将各驯化后的菌株分别编号为 1′~ 9′号。
对各菌株的抗300 μ g/mL利福平的标记结果进行验证检测,检测方法为:将1′~9′号驯化菌分别与去掉各自出发菌株的1~9号菌进行混合液体发酵,各组合为CK(全为出发菌,无驯化菌)、1R~9R号共计10组,各组合中包括的菌株如表2。用接种环挑取10组发酵好的摇瓶菌液在含300 μ g/mL利福平培养基划线分离,通过检测平板中分离所得菌株的形态特征等判断其是否为各组合中的驯化菌验证标记结果。
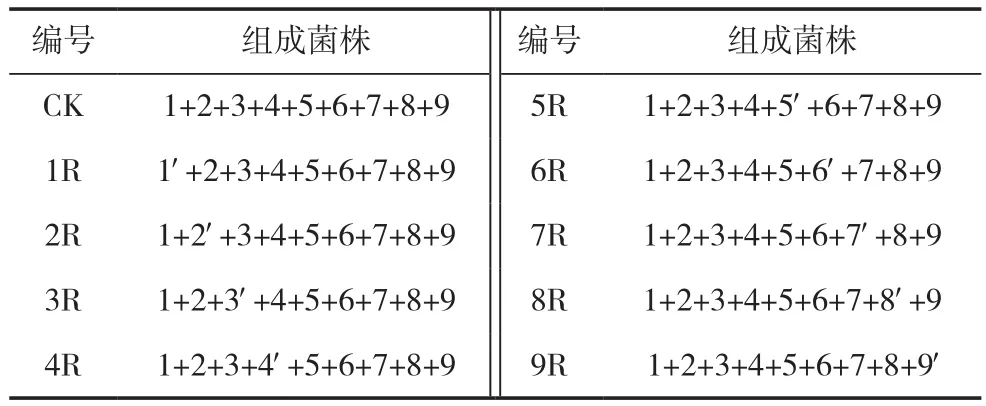
表2 各组合中包括的菌株说明
1.5 盆栽试验检测菌株在土壤中的定殖能力
将10 kg于121℃高压灭菌3 h的土壤分别装入盆中,并与500 mL浓度为1.0×108cfu/mL的1′~9′号菌液混合,以相同量不接菌的培养液为对照,栽培烟草植株,每个菌液处理5个重复。在烟草的整个生长期中,分别在种植后的第2、25、40、65 d采集各个处理中的土壤样品,在含300 μ g/mL利福平培养基中采用稀释平板涂布法计数其中的菌落含量。根据不同时期检出驯化菌株的含量判断菌株在土壤中定殖能力,并分析其定殖能力与抗生素敏感值的关系。
2 结果与分析
2.1 抗生素药敏片在菌株平板上产生抑菌圈直径的分级
以5号放线菌为例展示的药敏片试验结果如图1所示。21种抗生素药敏片对CK及9个菌株抑菌圈直径的大小如表3所示,由表3可知,没有接入菌株的CK中放置21种药敏片均无抑菌圈产生;各种药敏片在含有9个菌株的平皿中产生的抑菌圈无明显规律,最大抑菌圈是米诺环素对7号菌株产生的,达到4.37 cm;1~4号菌株药敏片对其无抑菌圈的个数均大于等于10个,并且均无达到3 cm的抑菌圈产生;7号和9号菌株没有无抑菌圈产生的药敏片种类。根据21种药敏片对各菌株产生的抑菌圈大小统计的抗生素敏感性分级情况及依据公式计算的敏感值如表4所示,敏感值最大的是7号菌株,最小的是4号菌株,分别是93 和 29,各菌株敏感值的排序为 7>8>9>5>6>3>1>2>4。

图1 药敏片试验(以5号菌为例)
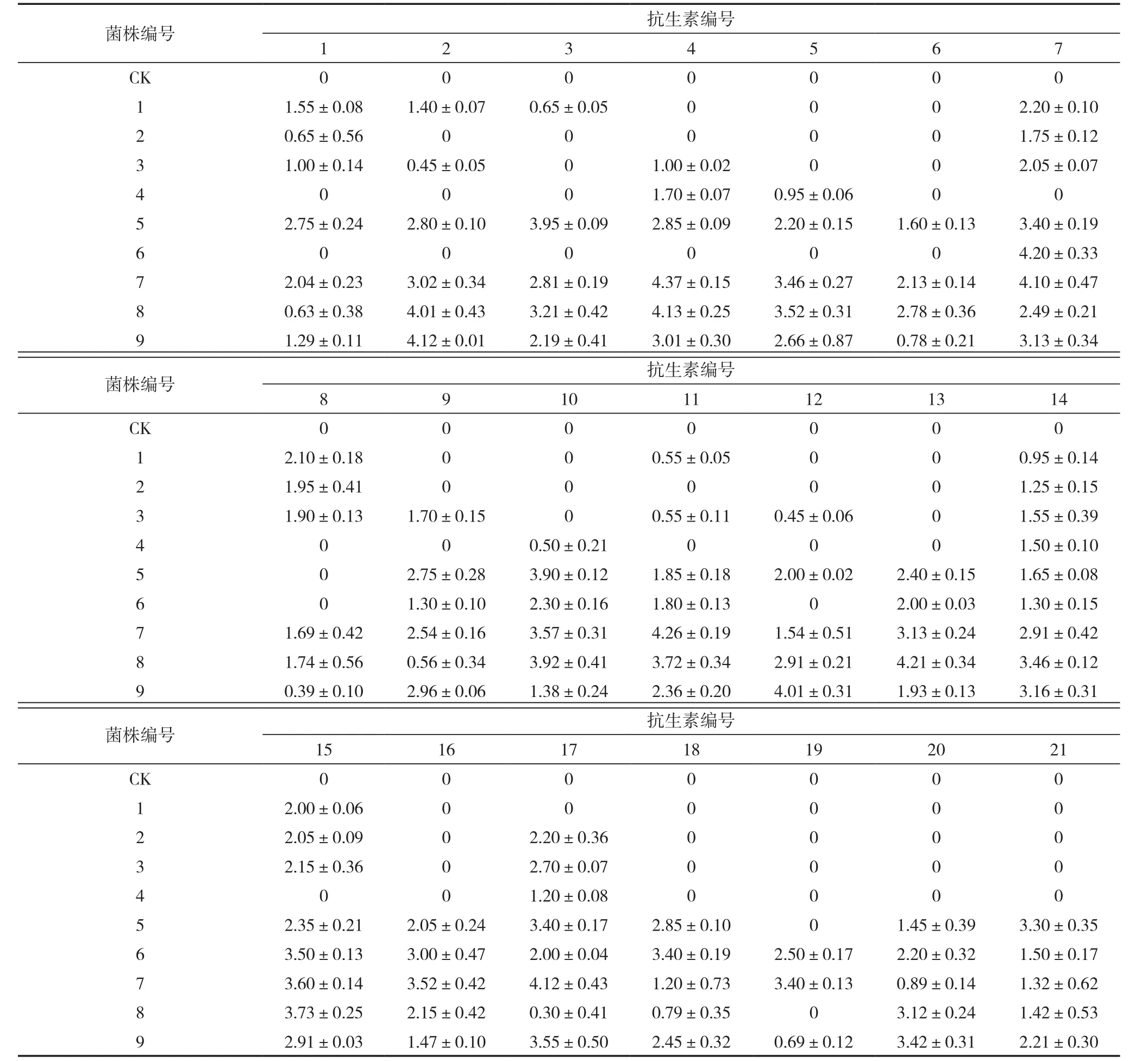
表3 菌株对抗生素敏感性测试结果 (cm)
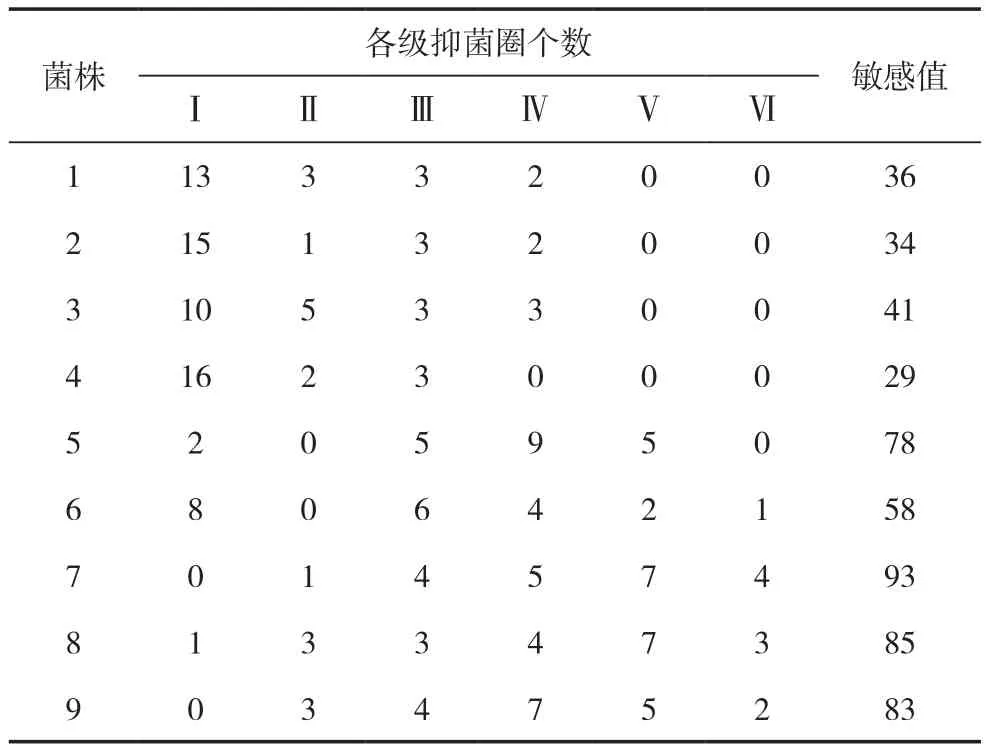
表4 各菌株抗生素敏感性分级及敏感值计算结果
2.2 利福平标记结果
利用含300 μ g/mL利福平培养基划线检测10个发酵组合液中各驯化菌株标记结果的试验结果表明:对照组合菌液在该平皿上无菌株生长,而1 R~9 R发酵组合中均有纯菌落生长,根据其形态特征等方法进行对比,长出菌株分别为1′~9′号。从而证明9株驯化菌在众多菌同时存在的情况下,可以在含300 μ g/mL利福平培养基中单独分离出,具有排它性,可以将含300 μ g/mL利福平的培养基作为驯化菌株的计数培养基。
2.3 盆栽测定菌株在土壤中的定殖能力
由表5可知,采集的4次样品中,1′、2′、3′、4′、5′、6′号随着时间推移其菌落数量都有所增加,而7′号、8′号的菌落则在第2次已经无检出,并且第1次检测结果菌落数量8′号>7′号,9′号在第3次无菌落检出。由检测结果可知,在整个样品菌落分析所反应出的各菌株的定殖能力从大到小都表现出了以下排序:4>2>1>3>6>5>9>8>7,这个排序和2.1中分析所得各菌株的敏感值大小所反映出的各菌株的定殖能力的排序刚好相反。由此证明用抗生素对菌株的抑菌圈直径分级方法和敏感值计算方法判断菌株在土壤中的定殖能力具有可行性,并且抗生素敏感值和其在土壤中的适应定殖能力呈负相关。
另外,从分析结果中可以得知,当菌株抗生素敏感值为83时(9′号),其定殖能力较敏感值为78(5′号)的菌株下降很多,并且在接入土壤40 d后9′号失去定殖能力,而当菌株抗生素敏感值为85时(8′号),菌株在第1次样品分析时期定殖能力已显得极差,仅有29 cfu/g。由此判断,当菌株抗生素敏感值小于85时,菌株在土壤中有一定的定殖能力,而当菌株抗生素敏感值大于85时,菌株基本失去在土壤中的定殖能力。
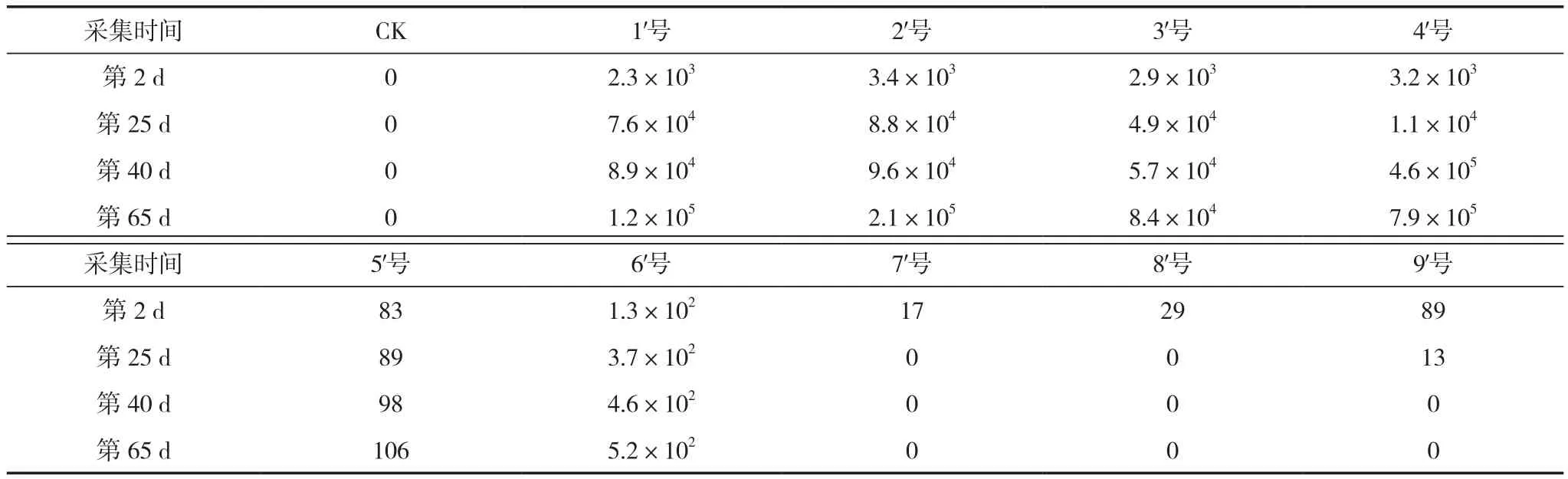
表5 各菌株4次采集样品中在含300 μg/mL利福平培养基的菌落数量 (个/g)
3 结论与讨论
抗生素被较广泛的应用于医学、农业、畜牧业等行业中,这些抗生素未被有效利用则会通过直接、循环等方式进入包括土壤的环境中,另外,土壤中的微生物种类极为丰富,其中的放线菌可以产生绝大多数目前已知的抗生素种类[14],这些抗生素对环境微生物群落进化施加选择压力[15],必然也影响寄入土壤中的功能菌株的定殖。本研究通过试验获得一种初步判断细菌类微生物在土壤中定殖能力的方法,该方法基于21种抗生素对菌株的抑菌情况进行抑菌圈直径分级,利用公式计算菌株敏感值,通过盆栽试验证明菌株的敏感值与其在土壤中的定殖能力呈负相关。证明可以通过计算细菌类微生物的敏感值的方法来判断菌株在土壤中的定殖能力。本研究中通过公式计算敏感值大于85时,功能菌株在土壤中的定殖能力已较差,但确定定殖能力从有到无时敏感值的值,需要更多的试验来验证。
定殖能力作为农用功能微生物投入生产应用前重要的评价指标,其重要作用不言而喻。国内外不少学者就功能菌株的定殖能力作了不少研究,但关于菌株定殖环境的研究较少,如Donald等[16]认为可以通过检测菌株在土壤中产生的信号因子来判断其在土壤中的定殖能力;董丽红等[17]通过测定枯草芽孢杆菌NCD-2对5个不同棉花品种的根系分泌物的趋化作用,发现根系分泌物中氨基酸对NCD-2具有趋化性的影响;其它更多的研究集中于分析作者筛选所得的特定功能菌株的定殖能力,如Ameen等[18]研究发现贝莱斯芽孢杆菌菌株FZB42在番茄根际定殖过程中,生物膜的形成起决定作用;Melent’ev等[19]的研究发现土壤温度较低不利于抗病细菌在小麦根际的定殖,而土壤含水量与其定殖能力的强弱无关;娄海博等[20]研究发现,拮抗青枯病的荧光假单胞菌SN15-2在施入番茄根际后的前20 d定殖数量减少,20 d后基本稳定,60 d时,在干土中的定殖数量可达3.67×105cfu/g。而这些已有的研究中,没有对功能菌株在土壤中定殖能力简便的判断方法,本研究对应用于土壤的功能细菌类微生物的定殖潜力提出了新的评价方法,对农业领域生物肥料、生物农药等在应用时筛选环境适应能力强的菌株具有重要的指导意义。

