白叶枯病菌效应子XopN在拥有OsSWEET11同源基因的水稻品种上发挥毒性作用
李丽 莫旭艳 李甜甜 张丽媛, 董汉松, ,
(1山东农业大学 植物保护学院,山东 泰安 271018;2南京农业大学 植物保护学院,南京 210095;3作物生物学国家重点实验室,山东 泰安 271018;*通信联系人,E-mail: lyZhang@sdau.edu.cn)
水稻白叶枯病是水稻上最重要的细菌性病害,发生于热带和温带水稻产区[1]。最近半个世纪,水稻白叶枯病主要在中国、日本等东亚国家,菲律宾等东南亚国家或地区、美国等北美国家、澳大利亚等大洋洲国家以及非洲西部国家或地区造成持续危害[1],常年引起的农田水稻产量损失高达10%~50%[1-3]。水稻白叶枯病菌学名叫“水稻黄单胞菌水稻致病变种(Xanthomonas oryzae pv. oryzae,Xoo)”,属于只有活动细胞而无休眠态芽孢的革兰氏阴性细菌,是植物病理学研究使用的一种模式病原菌[4,5]。Xoo从水稻叶片上的气孔或者伤口侵入水稻叶片,在叶片薄壁细胞间隙繁殖,扩展进入木质部,在繁殖与扩展过程中陆续发挥致病作用[5-7]。同包括黄单胞菌在内的其他革兰氏阴性植物病原细菌一样,Xoo的一个关键致病机制是通过Ⅲ型(typeⅢ, T3)分泌系统分泌效应子(effectors)[3-6,9-13]。T3效应子通过植物识别因子的介导,从细菌细胞转运到植物细胞[10-12],在寄主植物感病品种(cultivars or varieties)上发挥毒性(virulence, vir)亦即致病作用(pathogenicity, pth),诱发病害[5,9-14],而在寄主植物抗病品种或非寄主植物上行使无毒功能(avirulence,avr),激发抗病性,经常伴随过敏反应(hypersensitive response, HR)[11]。HR属于抗病防卫反应,表现为植物器官在受侵染的部位快速发生细胞死亡,抑制病菌生长繁殖与扩展蔓延,保护植物免受进一步侵害[14]。
与植物病原黄单胞菌其他种类一样,Xoo通过T3分泌系统分泌类似于转录激活子效应子(transcription-activator-like effectors, TALEs)和non-TALE蛋白质共近40种效应子[2,15]。TALEs包括冠名为Pth和Avr的蛋白质,non-TALEs主要是“黄单胞菌细胞外蛋白质(Xanthomonas outer proteins,Xops)”[2]。TALEs通过调控它们在植物体内的靶标基因SWEET的表达而发挥致病作用的机制已得到深入研究[5,16-19],其中了解最清楚的是PthXo1操纵水稻OsSWEET11 (异名Xa13)基因表达的分子机制与结构基础以及OsSWEET蛋白质作为糖分运输载体的生化机理[3,9-13,16-19],但关于Xops的功能机制却了解较少。从不同种类黄单胞菌鉴定出的Xops现已多达30种以上[15],但病理功能得到研究的只有7种(XopD、XopN、XopQ、XopR、XopX、XopZ、XopAO1),而且来自不同种类而非同一种细菌,寄主植物也是多种而非一种[20-25]。例如,在侵染番茄的过程中,辣椒斑点病菌(X. campestrispv. vesicatoria,Xcv)分泌的XopD发挥毒性作用,抑制番茄水杨酸与茉莉酸介导的防卫反应基因表达[20]。同时,XopD通过拟泛素化作用来削弱乙烯介导的转录因子SIERF4编码基因的表达,并抑制SIERF4蛋白质产生[21]。水杨酸和乙烯/茉莉酸信号传导对植物抗病性的调控作用通常相反[26],Xcv侵染番茄而分泌的XopD同时抑制这三种激素信号传导,机制尚不明确。木薯萎焉病菌(X. axonopodispv.manihotis)产生至少17种Xops,其中XopX、XopZ、XopAO1对病菌的完全毒性起决定作用,XopN与XopQ毒性功能冗余,XopR和XopAO1抑制木薯抗病免疫反应[23]。可见,对不同病菌产生的不同Xops进行全面研究阐释,尚需时日。
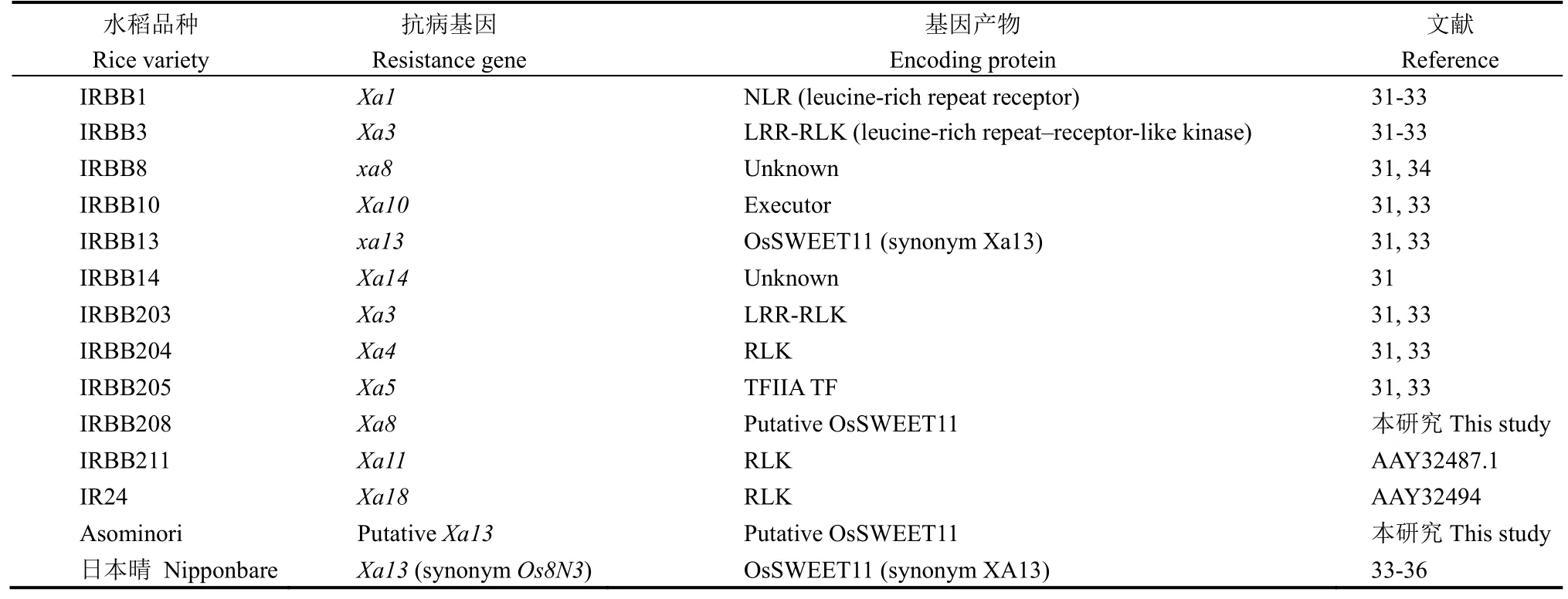
表1 供试水稻品种中白叶枯病的抗病基因及基因表达产物Table 1. Xoo-relevant resistance gene and encoding proteins in the tested rice varieties.
较之上述Xops,XopN病理功能得到较好的研究。XopN有分子接头的结构特征,可能通过结合植物免疫反应因子而发挥毒性作用[27],互作的抗病免疫因子已知有14-3-3蛋白质家族成员[25]。在侵染过程中,Xcv产生的XopN与番茄14-3-3蛋白质TFT1结合,从而抑制TFT1对病原物模式分子触发的免疫反应(pattern-triggered immunity, PTI)的调控能力[25]。此外,XopN对甘蓝褐腐病菌(X. campestrispv.campestris)[28]、水稻条斑病菌(X. oryzaepv.orizicola)[29]和Xoo[30]毒性的贡献也得到确认。XopN决定Xoo菌株KXO85对水稻感病品种Dongjin的毒性,与水稻抗病相关蛋白质VOZ2互作,调控病菌毒性[30]。这些研究提出了一个问题,即XopN的病理功能是否因水稻品种对病菌的抗感性(susceptibilities)而异?作者使用Xoo标准菌株PXO99A和水稻不同品种进行研究,试图解答这个问题。目前对PXO99A产生的XopN的认知,仅限于它是一种Ⅲ型效应子,病理功能还有待揭示[3,15]。本研究主要测定了PXO99A对水稻14个品种的毒性,分析了XopN基因敲除和回补对病菌毒性的影响,以及病菌毒性与水稻OsSWEET11基因诱导表达的关系。结果表明,XopN是一个有限广谱性(pluripotent)效应子。
1 材料与方法
1.1 试验材料
1.1.1 供试植物
病菌毒性测定使用了14个水稻品种(表1),各含至少1个抗性基因[31],基因产物性质不同[32-35],植物HR测定使用本氏烟(Nicotiana benthamiana)。两种植物均在装有植物培养基质(PINOSTR substrate)的花盆内培育,烟草种子播种后10 d移栽,水稻采用催芽的方式培育。催芽和幼苗培育均使用26℃~28℃植物培育室(12 h光照/12 h黑暗)。
1.1.2 供试菌株与质粒
供试细菌菌株、质粒载体或重组载体有从专业公司购买的,也有参与本研究的师生先后在南京农业大学(南京)和山东农业大学(泰安)构建的(表2)。
1.2 实验方法
1.2.1 病菌XopN基因敲除
构建基因敲除载体所用引物依据 NCBI(National Center Biotechnology Information)上PXO99A的全基因组序列,设计XopN上游序列(F1,996 bp)和下游序列(F2, 794 bp)的引物(表 3),由金斯瑞生物公司合成。以PXO99A基因组DNA为模板,用ExTaq酶扩增XopN基因的上游片段F1和下游片段F2。将扩增好的F1、F2片段用TA克隆连接到pMD19-Ts载体上,挑选阳性克隆送测序。用同种方法将扩增好的卡那霉素(Kan)基因连接到载体 pMD20-T上,挑选阳性克隆送测序。挑选测序正确的片段,利用对应的酶切位点将 F1、F2片段从载体pMD19-Ts上酶切下来,凝胶回收正确的F1、F2片段,连接到pMD20-T(带有正确的Kan片段)载体上,构建XopN的敲除重组载体pMD20-T::F1::Kan::F2。制备PXO99A感受态细胞,将敲除重组载体电转PXO99A感受态细胞。转化的细菌接到NA培养基上,放入28℃培养箱进行培养。待长出单菌落,将单菌落分别对应,点在含有氨苄霉素和卡那霉素的NA培养基上,再放入28℃培养箱,培养2 d,对单菌落进行PCR扩增,为验证目的基因敲除效果。另外,本实验室此前使用上述类似方法对XopQ进行敲除,获得突变菌株ΔXopQ[33]。

表2 供试菌株与质粒Table 2. Bacterial strains and plasmid vectors used and created in this study.

表3 用于病菌XopN基因敲除和回补的PCR引物相关信息Table 3. Information of primers used in PCR protocols for Xoo XopN knockout and complementation.
1.2.2ΔXopN突变体遗传回补
根据诺唯赞公司的一步法克隆试剂盒(One Step Cloning Kit)使用说明书设计引物(表 3),以PXO99A的DNA为模板,通过PCR扩增XopN全长(表3)。用限制性内切酶HindⅢ分别将扩增好的XopN片段和 pHMI载体进行酶切,将酶切后的产物纯化后进行重组反应。反应体系包括 5×CE Ⅱ缓冲液4 μL,线性化克隆载体50~200 μg,插入扩增片段产物20~200 ng,ExnaseTMⅡ 2 μL,加dd H2O至20 μL。反应后转化至大肠杆菌DH5α感受态细胞中,涂板,待长出单菌落后挑选单菌落,进行菌落PCR鉴定,将菌落PCR鉴定为阳性克隆的单菌落再用 Hind Ⅲ酶进行酶切鉴定。将验证成功的回补载体送测序鉴定。将测序正确的pHMI::XopN回补载体,电转入ΔXopN感受态细胞中,菌液涂布于含有卡那霉素的NA培养基上,在28℃条件下培养3 d,将长出的单菌落摇菌提取基因组,用作模板,使用XopN基因的特异引物,通过PCR进行验证,PCR结果为阳性的即为ΔXopN突变体回补菌株。
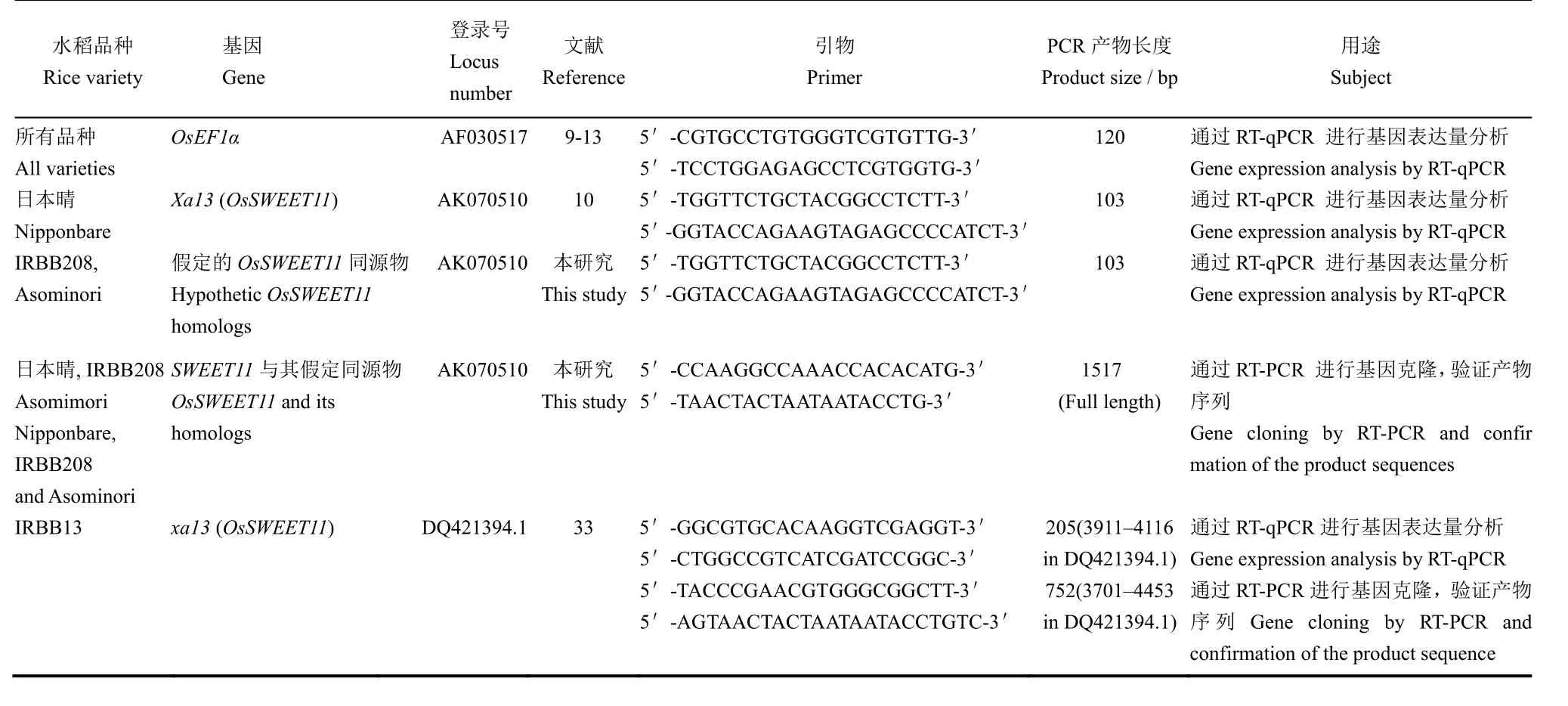
表4 水稻基因及其RT-PCR与RT-qPCR分析所用引物信息Table 4. Information on rice genes and their primers used for RT-PCR and RT-qPCR analyses.
1.2.3 细菌繁殖量测定
将 PXO99A、ΔXopN和ΔXopQ细菌储备物移入营养肉汤(nutrient broth, NB)培养液,活化培养至OD600=1,各取20 μL菌液转入新的NB培养液,28 ℃下振荡培养,在10~24 h期间每隔2 h取样,测定不同菌株 NB培养物的 OD600值,然后通过Excel制作细菌生长曲线。
1.2.4 接种实验
接种采取两种通用方法,即剪叶和注射[9-14]。使用剪叶接种法时,剪刀先用OD600为0.5的菌悬液蘸一下,立即剪切水稻叶片尖端约3 mm的部分。使用一个月龄的水稻苗,每个菌株接种6株幼苗,各选取心叶下方的2张完全展开叶片进行接种。接种3 d后,取样测定细菌繁殖量,14 d后测量病斑长度。注射法接种使用 14日龄的水稻苗,每个菌株接种6株稻苗,各注射6张叶片,3 d后测定叶片含菌量。无论剪叶还是注射接种,叶片含菌量测定都是采用细菌回收的方法。每株稻苗取3张叶片,用酒精棉球表面消毒后,用经过灭菌的打孔器(0.5 cm×0.5 cm, 0.19625 cm2)取叶圆片,叶圆片再用灭菌的剪刀剪碎,叶片碎片置于3 mL灭菌水中,借助研棒用力研磨。含菌的叶片组织研磨物悬浮液经10倍系列稀释后,各取10 μL,涂布在含相应抗生素的NB琼脂(NB agar, NA)培养基平板上,28℃下培养3~5 d,计数菌落形成单位(colony formation unit,cfu)。
1.2.5 水稻基因克隆和表达分析
根据已知信息(表3),从水稻不同品种克隆抗病(感病)基因,包括 IRBB13的隐性抗病基因 xa13(OsSWEET11)[33]、日本晴显性感病基因 Xa13(OsSWEET11)[35]、IRBB208和Asominori可能含有的OsSWEET11同源基因。水稻这4个品种30日龄幼苗所有叶片均剪叶接种,分别接种 PXO99A、ΔXopN和ΔXopN/XopN。一部分幼苗立即取样,另一部分幼苗到24 h再取样,均剪取全部叶片,立即提取RNA,两次提取的RNA依次用于基因克隆和表达分析。采用RT-PCR克隆的方法,使用不同引物(表4),从水稻上述品种克隆相应的抗病(感病)基因。RT-PCR产物经过测序和BLAST比对,确认基因或同源物。通过实时定量RT-PCR (RT-qPCR)来测定基因表达水平[10]。
1.2.6 烟草HR测定
通过NA培养活化PXO99A、ΔXopN、ΔXopN/XopN细菌,挑选单菌落移入NB培养液,于28 ℃培养箱中振荡培养 16~18 h。收集培养液,离心沉淀菌体,菌体用纯水悬浮,重复离心1次,沉淀的菌体再用纯水悬浮,稀释菌悬液至 OD600=0.5。选取5~6叶期的本氏烟,用一次性注射器吸取细菌悬浮液,在叶片侧脉之间约中心点注入叶肉细胞间隙。到12 h,用台盼蓝染色法[37]显示叶片细胞过敏性死亡(microscopic HR, micro-HR)情况,并于12~36 h观察HR。
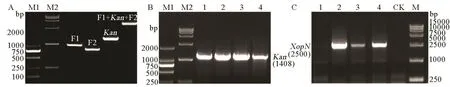
图1 PXO99A的XopN基因敲除Fig. 1. XopN gene knockout from PXO99A.
1.3 数据分析
所有实验至少重复3次,即包括至少3个生物学重复,结果一致时予以使用。对定量分析获得的实验数据,使用IBM SPSS19.0软件中文指导书[38]和配套的软件包进行三项统计分析。一、使用Levene方差齐性检验来检验方差整齐性。二、使用Kolmogorov-Smirnov检验和P-P图,确认数据的正态分布。三、差异显著性测定,又有两种。1)成对数据比较,例如比较病菌野生型与突变菌株诱发的病斑长度,通过方差分析(analysis of variance,ANOVA)和F测验(Fisher’s test),估计差异显著性。2)多重比较,例如比较野生型、突变体、遗传回补的菌株诱发的病斑长度,通过ANOVA和邓肯新复极差测验(Duncan’s multiple-range test),估计差异显著性。统计分析的材料单元根据测定的项目而有不同,只有病斑长度以叶片为单位[39],水稻基因表达和细菌繁殖测定则以每个样品为单位,计为生物学重复数。
2 结果与分析
2.1 XopN敲除成功
为了研究 XopN基因的病理功能,必须把它从PXO99A敲除,获得ΔXopN突变体,对突变体进行遗传回补,获得回补菌株,然后比较野生型、突变体和回补菌株对水稻的毒性。因此,我们首先构建了 XopN的敲除载体 pMD20-T::F1::Kan::F2。PCR扩增与测序验证表明构建验证成功,重组载体所含XopN基因上游片段F1为996 bp,下游片段F2为794 bp,Kan基因为1408 bp(图1-A)。用电击转化的方法,将构建好的ΔXopN敲除重组载体转入PXO99A感受态细胞,转化的细菌经过3 d培养,长出单菌落。然后,将单菌落分别对应点在含有氨苄青霉素和卡那霉素的NA培养基上。若该菌落在含氨苄青霉素的平板上不能生长但能够在含卡那霉素的平板上生长,则该菌落可能是XopN敲除突变体。根据这一原理,初步筛选出了XopN敲除突变体菌株。对初选菌株做了进一步分子鉴定,挑取单菌落进行震荡培养,从培养物提取基因组DNA用作模板进行PCR扩增,分别扩增Kan基因和XopN基因,挑选了4个转化子,均具有Kan基因(图1-B),其中转化子1不含XopN基因(图1-C),说明它是敲除了XopN的PXO99A突变体ΔXopN。
2.2 ΔXopN突变体回补成功
为了后续试验能够充分说明XopN基因的病理功能,构建了ΔXopN突变体的遗传回补载体pHMI::XopN。用此载体转化大肠工程菌株DH5α的感受态细胞,转化后的细菌经过培养长出单菌落。这样的单菌落用来进行菌落PCR和酶切验证,结果表明回补载体pHMI::XopN构建成功(图2-A)。将构建成功的pHMI::XopN质粒电转入ΔXopN敲除突变体感受态,涂布在含有链霉素和壮观霉素的NA培养基上进行培养,3 d后长出单菌落。从这种单菌落提取DNA,通过PCR扩增XopN基因进行验证。结果见图 2-B。其中,转化子 1、2、3含有 XopN基因,基因扩增效果与阳性对照(control)相当。转化子1、2、3就是ΔXopN突变体的回补菌株,记做ΔXopN/XopN。
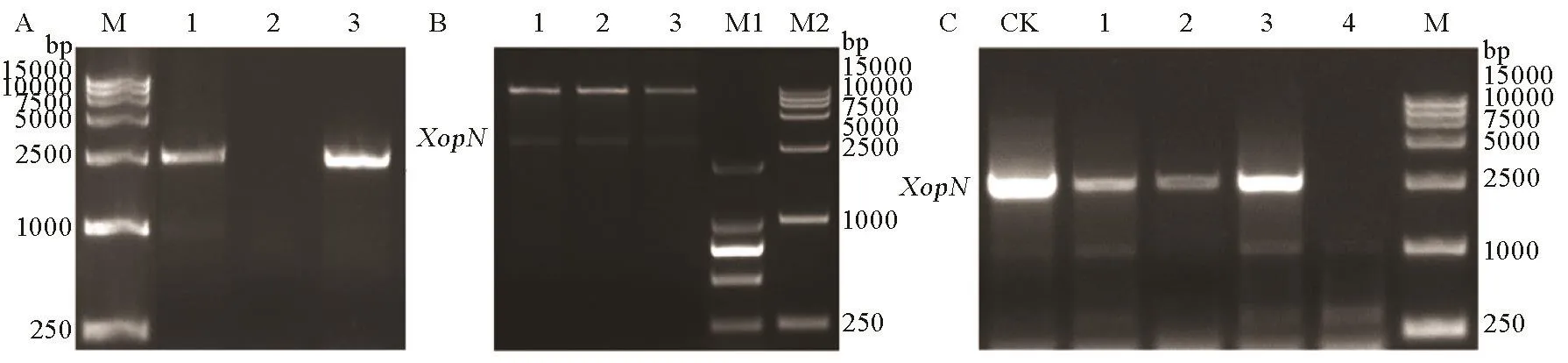
图2 突变体ΔXopN遗传回补效果验证Fig. 2. Genetic complementation of the ΔXopN mutant.
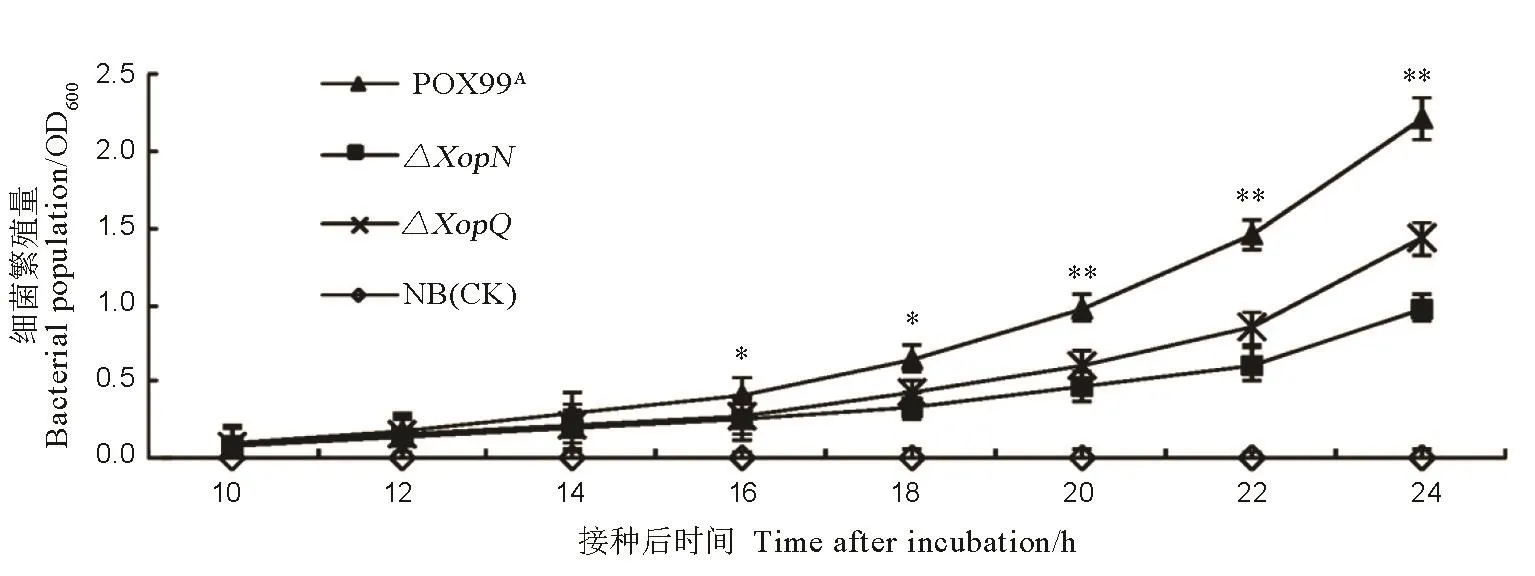
图3 Xoo不同菌株在NB液体培养基中的生长曲线Fig. 3. Bacterial population of the indicated Xoo strains in NB medium.
2.3 XopN影响细菌繁殖
为了探讨XopN敲除是否影响细菌在培养基上繁殖的能力,我们把 Xoo野生型菌株 PXO99A和XopN敲除突变体ΔXopN在NB液体培养上进行培养,于10~24 h内每隔2 h做一次细菌繁殖量测定。已知XopQ与XopN一样,也是PXO99A的一个效应因子,较之 PXO99A,XopQ敲除突变体ΔXopQ的繁殖量大为降低[24,33]。因此,我们对ΔXopQ做了同步测定。以NB培养液为对照,不同菌株在NB培养液中细菌繁殖量的变化曲线见于图 3。图上显示,从14 h起,突变体菌株ΔXopN、ΔXopQ的繁殖速度慢于野生型PXO99A,ΔXopN比ΔXopQ繁殖速度更慢,到24 h相差约10倍。这说明,XopN和XopQ对细菌繁殖速度都有影响,比较来看,XopN的影响更大一些。
2.4 对水稻14个品种的测试表明XopN决定病菌在其中4个品种上的毒性水平
根据本实验室[9-13,31,36]和世界同行[32-35]的相关研究,我们选出14个水稻品种(表1),即IRBB1、IRBB3、IRBB8、IRBB10、IRBB13、IRBB14、IR24、IRBB203、IRBB204、IRBB205、IRBB208、IRBB211、Asominori、日本晴(Nipponbare),用来评估 XopN毒性功能的专化性程度。通过接种实验,采取两项通用的指标[9-14,20-25]测评Xoo不同菌株对水稻不同品种的毒性:一是水稻叶片白叶枯症状严重程度;二是细菌在水稻叶片内的繁殖量。
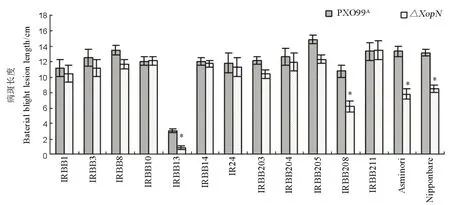
图4 用XopN与PXO99A剪叶接种水稻不同品种引起的白叶枯病斑长度Fig. 4. Lesion Length of leaf blight caused by the Xoo strains in different rice varieties.
首先,我们用野生型菌株PXO99A和ΔXopN突变体的细菌悬浮液(OD600=0.5)分别对上述 14个水稻品种的30日龄幼苗进行剪叶接种,14 d后(两周) 观察白叶枯病症状,测量病斑长度,用以评价病情严重度。结果显示,PXO99A对13个水稻品种均有很强的毒性,引起的白叶枯病斑长度平均都超过10 cm,仅对 IRBB13毒性微弱(图 4),该品种叶片病斑长度平均只有3.1 cm。PXO99A和ΔXopN在水稻10个品种上毒性相近(图 4),引起的叶片病斑长度无显著差别(ANOVA和F测验)。但是,在IRBB13、IRBB208、Asominori、日本晴这4个水稻品种上,PXO99A毒性明显高于ΔXopN突变体(图4)。亦即,较之PXO99A,ΔXopN毒性大为减弱,在这4个水稻品种叶片上引起的病斑长度显著缩短(ANOVA和 F 测验,P < 0.05)。
为了确认XopN的病理功能,我们选择水稻品种IR24(XopN基因敲除对菌株在水稻叶片上的致病性不起作用)和 IRBB208(XopN发挥作用)进行重复接种,验证了ΔXopN遗传回补的效果。我们制备了PXO99A、ΔXopN突变体及其回补菌株ΔXopN/XopN的菌悬液,循例采用剪叶接种法,对这两个水稻品种的30日龄幼苗分别予以接种,14 d后观察并记录病斑长度。结果显示,回补菌株ΔXopN/XopN能恢复 PXO99A对水稻 IR24、IRBB208的致病力(图5)。根据ANOVA和邓肯新复极差测验,PXO99A、ΔXopN、ΔXopN/XopN在IR24叶片上引起的病斑长度差异不显著,但在IRBB208上,较之PXO99A或ΔXopN /XopN,ΔXopN 引起的病斑长度显著(P <0.01)缩短(图5)。显而易见,用野生型XopN基因对ΔXopN进行遗传回补,达到了应有的效果。
植物体内细菌数量测定表明,XopN影响 Xoo在水稻叶片组织内的繁殖能力和种群数量。采取注射接种法,用PXO99A、ΔXopN、ΔXopN/XopN菌悬液分别接种IR24、IRBB208的14日龄幼苗的叶片,3 d后剪取接种的叶片,从中回收病菌并进行定量比较,结果见表 6。与病斑长度结果一致,ΔXopN突变体降低了IRBB208水稻叶片组织内的含菌量,但对 IR24水稻叶片内的含菌量没有显著影响,再次说明XopN对不同水稻品种的毒性存在差异。
为了在所有供试水稻品种上获得关于病菌毒性的完整资料,根据细菌毒性测评的上述第二个参数,我们又制备了PXO99A、ΔXopN、ΔXopN/XopN细菌悬浮液,分别用来注射接种上述 14个水稻品种14日龄幼苗的叶片,3 d后剪取接种的叶片,从中回收病菌并进行定量比较。结果显示,病菌3个菌株在水稻 10个品种叶片内繁殖量非常接近,只有IRBB13、IRBB208、Asominori和日本晴这4个水稻品种叶片内,PXO99A和ΔXopN/XopN充分繁殖,但ΔXopN的繁殖能力明显受抑,显著降低了其种群数量(图7)。无论与 PXO99A还是ΔXopN/XopN相比,ΔXopN在IRBB13、IRBB208、Asominori和日本晴幼苗叶片内的细菌数量都显著降低(ANOVA和邓肯新复极差测验,P < 0.01)。
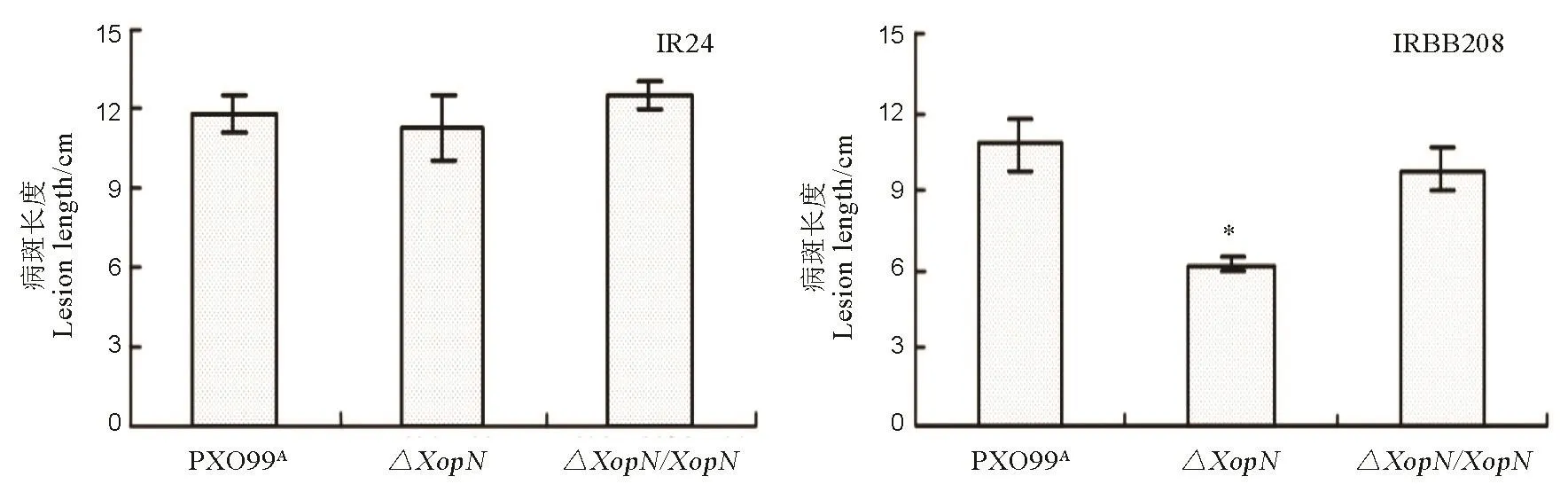
图5 PXO99A、ΔXopN、ΔXopN/XopN在水稻品种IR24和IRBB208上的白叶枯病病斑长度Fig. 5. Lesion length of leaf blight caused by the three Xoo strains in the two rice varieties.
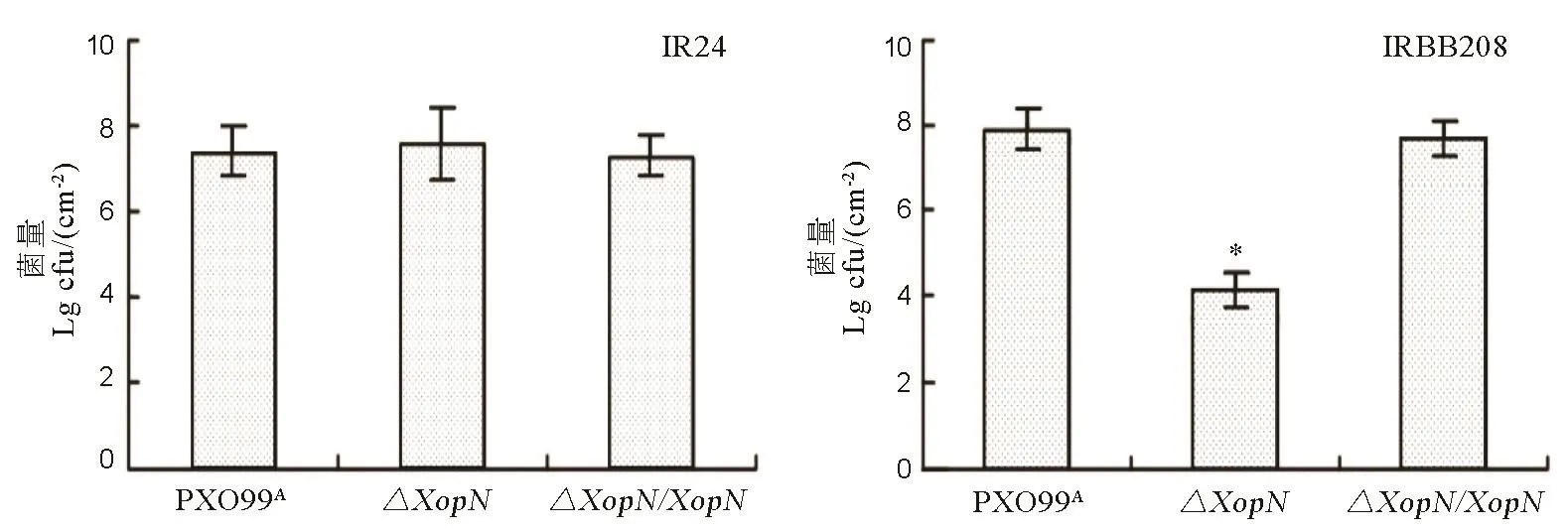
图6 PXO99A、ΔXopN和ΔXopN/XopN在水稻品种IR24和IRBB208叶片内的繁殖量Fig. 6. Bacterial population of PXO99A, ΔXopN and ΔXopN/XopN in leaves of IR24 and IRBB208.
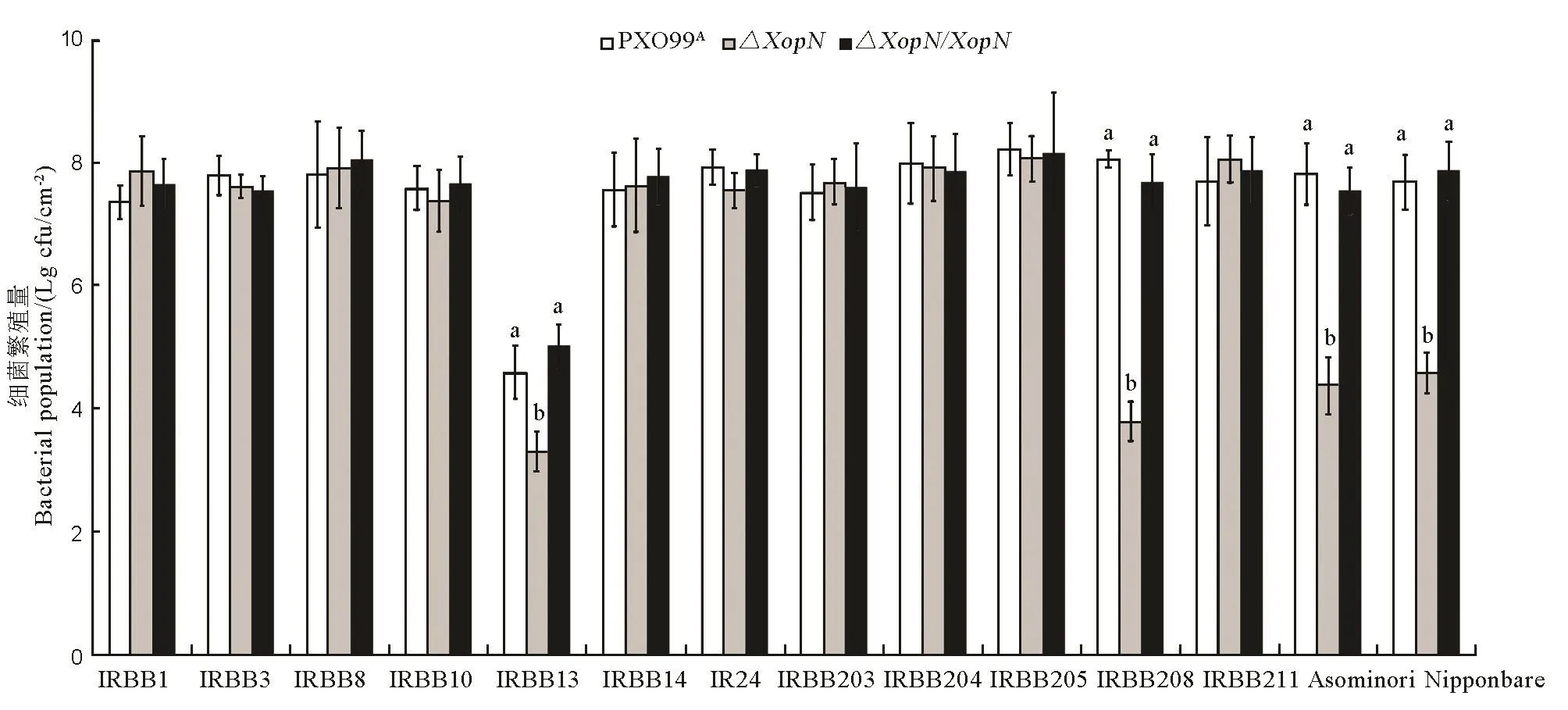
图7 PXO99A、ΔXopN和ΔXAopN/XopN在14个水稻品种体内的繁殖量Fig. 7. Populations of PXO99, ΔXopN and ΔXopN/XopN bacteria multiplied in leaves of the 14 rice varieties.
综合分析比较上述实验结果,可以明确看出,从水稻不同品种叶片内的Xoo繁殖量和叶片白叶枯病症状差别这两项评定病菌毒性的指标[9-14,20-25]来看,敲除XopN基因对Xoo毒性的影响因为水稻品种的不同而有很大差别。测定的 14个水稻品种仅有 4个(IRBB13、IRBB208、Asominori、日本晴)病理反应受病菌效应子XopN的影响,对Xoo的敏感性或对白叶枯病的感病性因为病菌XopN的敲除与否而有显著差别(P < 0.05)。换言之,XopN决定Xoo菌株PXO99A对这4个水稻品种的毒性水平。根据病菌繁殖量和引发白叶枯病的严重程度,在IRBB13上,PXO99A毒性水平较低,但XopN对病菌毒性的贡献很大,约占75%,而对其他3个水稻品种(IRBB208、Asominori、日本晴),PXO99A有很强的毒性,但XopN对病菌毒性的贡献却比较低(分别为43%、42%、31%)。显而易见,XopN是一个有限广谱性(pluripotent)[40]效应子。
2.5 XopN影响病菌诱导水稻OsSWEET11同源基因表达的能力
为了探讨XopN毒性功能这种有限广谱性的机制,我们考查了上述XopN发挥作用的4个水稻品种对白叶枯病抗感反应的遗传基础和分子机制(表1)。IRBB13对白叶枯病的抗性取决于隐性抗病基因xa13,该基因的编码产物是OsSWEET11/Xa13蛋白质[31,33]。相反,日本晴拥有显性的Xa13基因[35],即xa13的等位基因[32],Xa13编码的OsSWEET11/XA13/Os8N3与xa13编码的OsSWEET11/Xa13仅有三个氨基酸的差别[41],但决定日本晴对白叶枯病的感病性,即决定菌株PXO99A对日本晴的毒性[10,12,35]。我们通过接种实验和RT-qPCR分析发现,PXO99A对OsSWEET11/xa13在IRBB13叶片内的表达有显著(P<0.01)的抑制作用,却能大幅度提高OsSWEET11/Xa13在日本晴叶片内的表达水平(图8)。这种相反的影响在XopN基因敲除(ΔXopN)的情况下便不再发生,但在ΔXopN遗传回补(ΔXopN/XopN)以后,又重新出现(图8)。这说明XopN对病菌促进显性基因OsSWEET11/Xa13表达,抑制隐性基因OsSWEET11 /xa13表达起重要作用。
如前所述,与IRBB13和日本晴一样,IRBB208和Asominori对PXO99A的敏感性也受病菌 XopN控制(图 4~7)。但是,IRBB208和 Asominori是否拥有显性或隐性OsSWEET1基因,文献和网络数据库均无记录。由于PXO99A的毒性和XopN的影响在日本晴上与在IRBB208和Asominori上的效果相似(图 4和图 7),我们推测,IRBB208和 Asominori可能也含有显性基因OsSWEET1/Xa13,这一设想随即得到实验支持。根据日本晴 OsSWEET1/Xa13基因 cDNA序列(登录号 AK070510)设计可以扩增该基因 cDNA全长的一对引物(表 4)。这对引物用于RT-PCR,对IRBB208和Asominori在PXO99A接种前后分离的 RNA样本进行扩增,均能得到约为1500bp的产物。该产物经过回收、测序,测到的序列与OsSWEET1/Xa13基因cDNA序列完全相同。又根据 IRBB13隐性抗病基因 OsSWEET1/xa13的DNA 序列(登录号 DQ421394.1),选取最长的第 5个也是最后一个外显子(3701-4453bp),设计可以覆盖此区全长的一对引物(图 4)。这对引物用于RT-PCR,扩增来自IRBB208和Asominori的RNA样品,得到约为750 bp的产物。该产物经过回收、测序,测到的序列与OsSWEET1/xa13基因DNA序列第5个外显子序列完全相同。显而易见,IRBB208和 Asominori拥有 OsSWEET11同源基因。由于IRBB208和Asominori感病性同日本晴相近,但显著高于 IRBB13(图 4)。我们推测,IRBB208和Asominori的OsSWEET11同源基因属于显性感病基因。然后,我们发现,PXO99A接种 IRBB208和Asominori以后,大幅度提高了这两个水稻品种的OsSWEET11同源基因在各自叶片内的表达水平(图8)。这一作用在XopN基因敲除(ΔXopN)的情况下便不再发生,但在ΔXopN 遗传回补(ΔXopN/XopN)以后,又重新出现(图 8)。因此,对病菌促进OsSWEET11同源基因在IRBB208和Asominori叶片内表达的这一反应,XopN起重要作用。
2.6 XopN影响Xoo诱发烟草HR的能力
为了明确XopN是否影响Xoo诱发烟草HR的能力,我们将纯水制备的 PXO99A、ΔXopN、ΔXopN/XopN 3个菌株的细菌悬浮液分别注射烟草叶片,纯水注射叶片用作对照(control),在12~36 h期间观察烟草HR反应情况。到12 h,烟草叶片所有注射部位均未出现HR反应。到24 h,对照区域无HR反应,注射了PXO99A或ΔXopN/XopN菌悬液的部位已经出现明显的HR反应,而在注射接种ΔXopN菌悬液的区域,HR反应较微弱。36 h后,注射ΔXopN菌悬液的区域也出现了明显的HR反应(图9-A)。这说明XopN基因敲除延迟HR反应的发生。另外,烟草叶片用PXO99A菌悬液注射以后,在12 h之内出现了微敏反应,但用ΔXopN菌悬液注射的叶片,未见发生(图9-B),说明XopN影响病菌诱发烟草HR发生的程度。
3 讨论
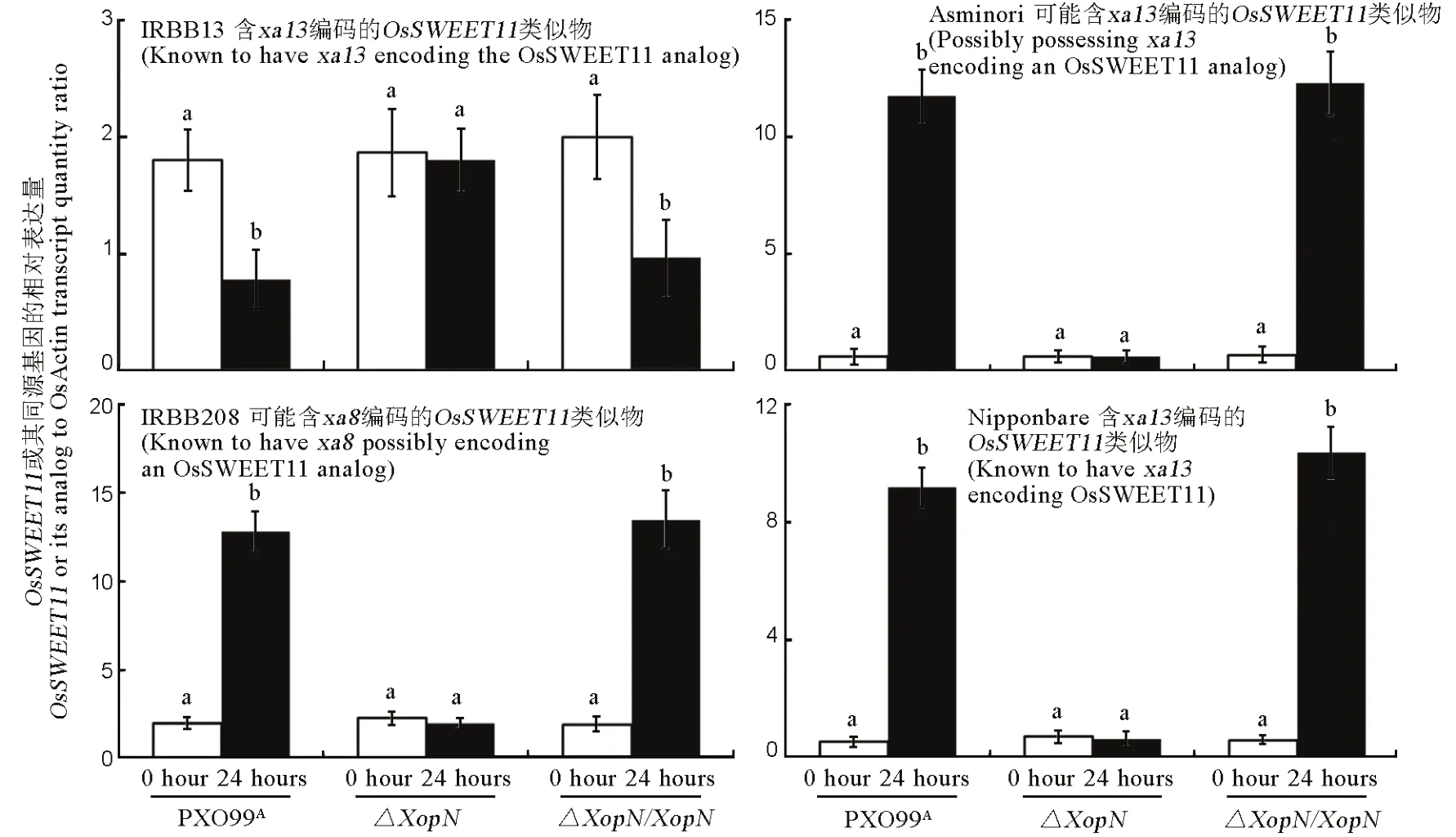
图8 XopN对OsSWEET11或其同源基因在水稻4个品种叶片内表达水平的影响Fig. 8. Effects of XopN on expression levels of OsSWEET11 or its analogs in leaves of the 4 rice varieties.
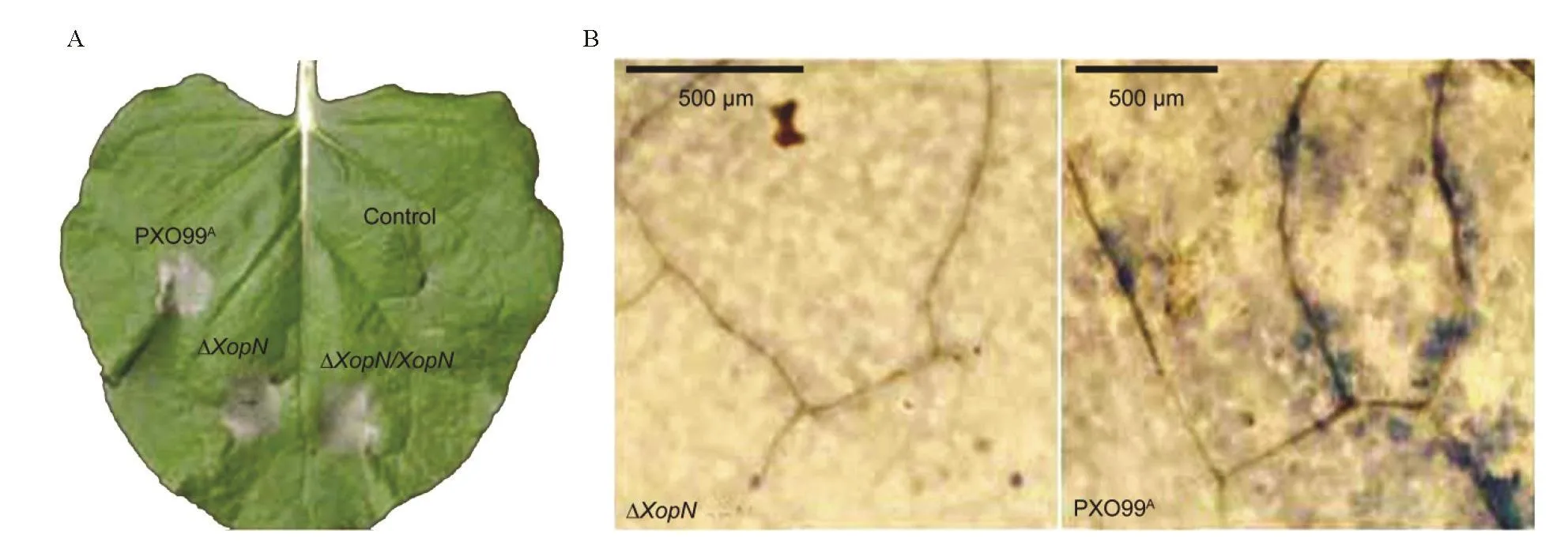
图9 XopN对Xoo诱发烟草叶片过敏反应的影响Fig. 9. Effect of XopN on the ability of Xoo to induce hypersensitive response in tobacco leaves.
在本研究之前,中国植物病理学学者宋从凤教授和美国同行学者杨兵教授通过合作,从Xoo菲律宾菌株PXO99A鉴定了18种Xop效应子[42],中国植物病理学学者冯家勋教授课题组又从水稻黄单胞菌水稻致病变种中国菌株13751鉴定出9种Xop[43],但是,病理功能得到研究的只有两种。一是XopZ,它在水稻品种IR24上具有毒性作用,通过原核表达获得的蛋白外施于本氏烟上以后,大幅度减少胼胝质在叶片表面的沉积量[42],说明XopZ能够抑制植物基本防卫反应[44]。二是XopR,它部分决定中国菌株13751对水稻品种特优63的低毒性,但不影响IR24的感病性[43]。另外,还有来自Xoo非洲菌株MAFF311018的XopR,病理功能通过拟南芥转基因的病理效应得到部分解析,在表达ZopR基因的拟南芥转基因系上,PTI受到抑制[45]。根据这些研究,联系上文引言部分援引关于不同病菌不同Xop在不同植物上病理功能的文献[20-25],我们对Xop效应子的了解还相当贫乏,既缺少不同Xop功能机制的知识,又亟需探讨不同水稻品种对特定Xop的病理反应,明确某一特定的Xop发挥毒性作用的专化性程度。
本研究解析了PXO99A对14个水稻品种的毒性和XopN所发挥的作用。根据病菌野生型菌株PXO99A、XopN敲除突变体ΔXopN和回补菌株ΔXopN/XopN在水稻叶片内的繁殖量和引起白叶枯症状的严重程度,XopN作为一个有限广谱性(pluripotent)效应子发挥作用,在水稻4个品种而非供试的所有14个品种上行使毒性功能,它也是Xoo培养繁殖的必要因子,对病菌在非寄主植物上诱发抗病防卫反应(HR)[44]还有增效作用。无独有偶,与病菌效应子功能对应的植物抗病或感病基因,例如OsSWEET1/Xa13,也表现出“有限多效(pluripotent)”的功能特征[9-13,40],既是水稻对白叶枯病感病性的决定因子[9-11,13,35],又参与花药和种子发育调控[46]。附带一笔,“多能性(multipotent)”、“亚全能性(pluripotent)”、“全能性(totipotent)”通常用来区分干细胞的发育潜能,从限于长成特定的而非全部的组织、器官,或限于某些生理过程,到产生所有胚胎细胞类型,再到产生所有胚胎和胚外细胞类型[47]。
推而广之,这些界定用于病菌效应子和植物抗病或感病基因或蛋白质也相当有意义[44]。正如本研究所指,XopN的毒性功能指向部分而非全部供试水稻品种。1)携带隐性抗病基因OsSWEET11/xa13的IRBB13[31,36],在这个水稻品种上,PXO99A显示弱毒性,但XopN对病菌毒性的贡献却高达70%以上。2)携带显性感病基因OsSWEET11/Xa13的日本晴,是典型的白叶枯病感病品种,在此水稻品种上,PXO99A有高毒性[33-36],而XopN对病菌毒性的贡献却只有30%左右。3)携带OsSWEET11/Xa13同源基因的IRBB208和Asominori,同源基因尚未发现进行功能测定,缺乏遗传和生理生化方面的实验证据,所以指称“同源基因”而非“显性感病基因”。对IRBB208和Asominori,PXO99A也显示高毒性,XopN对病菌毒性的贡献率在40%左右。这些结果简单而有趣,说明了XopN和OsSWEET11功能机制的复杂性。此处要义是,它们的功能机制有助于思考和解答POX99A的XopN为什么能在上述4个水稻品种上发挥毒性作用这一问题。
先看XopN,案例见于Xcv-番茄互作体系。在侵染番茄的过程中,Xcv分泌的XopN定位于番茄细胞膜与细胞质界面,与番茄非典型性受体型激酶TARK1互作[48]。在酵母细胞中,这个XopN还能同番茄14-3-3蛋白质的4个同源异构体(TFT1、TFT3、TFT5、TFT6)发生互作[48]。在番茄细胞内,TFT1是XopN的靶标,二者相结合,而TFT1又能结合TARK1,形成的TARK1/TFT1复合体可能为XopN发挥毒性功能提供合适的平台结构[25]。在此之前,XopN经由病菌T3分泌途径而运输,到达细菌-植物细胞界面,但必须继续前进,直到在植物细胞膜上定位。病原细菌效应子如果在植物细胞内发挥作用,例如PXO99A的TALE蛋白质PthXo1,它就必须从细菌细胞转入植物细胞[9-12],这种转运过程(translocation)需要病菌T3转位子(translocon)的帮助[9-13,49]。T3转位子由亲水性和疏水性蛋白质组成,执行底物转运功能对拓扑学结构的一个基本要求就是,转位子蛋白质必须经由植物细胞膜上的蛋白质和脂类受体的识别作用,进而定位到植物细胞膜上或插入其中[11,49]。根据在动物病原细菌上的研究,T3转位子蛋白质有三种,但对植物病原细菌,迄今还没有在哪个种群(种/species、致病变种/pathovar、菌株/strain等)上鉴定出三种转位子蛋白质[11,49]。最近,我们发表了从2003年开始研究Xoo效应子转运调控机制的部分结果,证明Xoo的T3分泌系统辅助因子Hpa1蛋白质作为疏水性转位子蛋白质起作用[12],帮助病菌效应子PthXo1从Xoo细胞转入水稻细胞,PthXo1进而调控它的靶标基因OsSWEET11表达,诱发白叶枯病[9-10]。同其他植物病原细菌一样,Xoo还没有第二个转位子蛋白质得到鉴定。但有研究表明,植物病原细菌某种T3蛋白质如果定位到植物细胞膜,它就有可能担当T3转位子组分和毒性/无毒性效应子这种双重功能[49-50]。根据XopN定位于植物细胞膜[48]及其功能的“亚全能性(pluripotent)”,我们推测,除了毒性效应子的作用,XopN还可能担当T3转位子蛋白质的功能。对此假设,我们的研究现已接近收官,可望对XopN的“亚全能性”提供一种解释。
再看OsSWEET11,研究集中在黄单胞菌致病性与水稻抗病性机制方面。显性感病基因Xa13编码的OsSWEET11/Xa13能与铜转运载体蛋白质COPT1和COPT5合作,调节铜离子在植物细胞间的重新分布,把铜离子移出木质部,免除它对细菌的毒害,病菌得以繁殖、扩展、致病[53]。除了蛋白质功能调控,基因转录调控也有重要作用。显性感病基因Xa13而非隐性抗病基因xa13的启动子区内的“效应子结合元件(effector-binding elements,EBEs)”是PthXo1的靶标[41,51],PthXo1因此可以靶向OsSWEET11/Xa13基因,进而发挥毒性作用[35]。相反,OsSWEET11/xa13启动子区内的EBEs存在突变,拒绝TALEs结合,导致植物抗病性,这可能是IRBB13对白叶枯病防卫反应的一种机制[32]。
根据上述XopN与OsSWEET11在转录调控和转录后调控水平上的作用机制,在PXO99A诱导隐性感病基因OsSWEET11/Xa13及其同源基因表达或抑制显性感病基因OsSWEET11/xa13表达的过程中,XopN可能按三种模式参与调控。1)作为T3转位子蛋白质,帮助PthXo1从细菌细胞向植物细胞转运,PthXo1随后按上述机制发挥毒性作用,尤其是激活显性感病基因OsSWEET11/Xa13表达[41,51]。2)按此方式,EBEs存在突变、拒绝TALEs结合[32]的隐性抗病基因OsSWEET11/xa13的诱导表达自然受到抑制。3)XopN具有毒性效应子兼T3转位子蛋白质的双重功能,与其他转位子组分(如Hpa1[12])合作,实现转运,功能靶向PTI[25,48]。对这三种模式的设想,需要通过实验加以验证。

