第三代超声辅助吸脂获取的hADSCs构建组织工程软骨的实验研究
王健 周栩
小耳畸形是常见的先天性体表畸形,严重影响患者身心健康,耳郭再造是目前最有效的治疗手段,其关键是耳郭软骨支架的制备。目前,常采用自体肋软骨制备耳郭支架。组织工程的发展为耳郭再造提供了新的途径。脂肪干细胞(Adipose tissue derived stromal/stem cells,ADSCs)是从脂肪组织中分离提取的具有多向分化潜能的成体干细胞。研究发现,ADSCs具有成软骨分化并形成软骨样组织的能力[1-3]。与BMSCs 相比,ADSCs具有来源广、易获得、创伤小、纯化率高、体外增殖速度快等优点,是构建组织工程软骨的理想种子细胞。
现有证据表明,不同的脂肪收获方法可能影响脂肪组织中ADSCs的质量和再生潜力[4]。超声辅助吸脂(Ultrasound-assisted liposuction,UAL)已在临床广泛应用,其基本原理是将电能转化为振动,引起热效应、空泡效应和机械效应,从而导致脂肪碎裂[5-7]。但目前尚不清楚超声辅助吸脂所获取的hADSCs对构建组织工程软骨是否存在不利因素,因此本研究通过第三代超声辅助吸脂获取hADSCs,并与残耳软骨细胞共培养,观察其在体内构建组织工程软骨的效果。
1 材料与方法
1.1 实验动物、试剂与仪器
6周龄雌性裸鼠6只(北京维通利华实验动物技术有限公司)。
PLA、油红O工作液、茜素红(Sigma,美国);Ⅰ型胶原酶(Invitrogen,美国);10%FBS(Gibco,美国);完全成脂培养基A、完全成脂培养基B、完全软骨分化培养基、完全成骨分化培养基(Cyagen,美国);组织糖胺多糖总含量阿利辛蓝比色法定量检测试剂盒(上海杰美基因医药科技有限公司)。
培养箱(Thermo,美国);生物力学分析仪(Instron 5967,美国)。
1.2 人耳软骨细胞的获取和培养
来源于小耳畸形患者术中废弃的残耳软骨,均获患者知情同意。取术中废弃的残耳软骨组织,去除软骨膜及周围组织,将残耳软骨块剪成1 mm3碎块,加入0.15%胶原酶,37 ℃摇床消化10~12 h,200目滤网过滤,2 000 r/min离心8 min,去上清后加入完全培养基重悬,计数后以1×104cells/cm2的细胞浓度接种于培养皿中,37 ℃、5%CO2、饱和湿度培养箱内培养。每3天换液一次,待软骨细胞生长至75%~80%融合时传代[8-9],收集第2代细胞备用。
1.3 ADSC的分离、培养
脂肪移植物采集自10名要求进行吸脂塑形的健康女性志愿者。实验通过北京协和医学院伦理委员会审批,所有志愿者术前均签署知情同意书。抽脂部位选取同一患者的双侧大腿,左侧大腿使用第三代超声辅助抽脂,右侧大腿使用常规负压抽脂。局部肿胀麻醉后,第三代超声辅助抽脂技术采用3.7 mm、3环探头在50%功率下连续模式乳化脂肪,当几乎感觉不到阻力时停止乳化。常规负压抽脂采用3.7 mm长吸脂管进行常规负压脂肪抽吸(-0.5 bar)。获取脂肪组织后,剥除肉眼可见的筋膜、小血管等脂肪周围组织,剪成1 mm3大小组织块,加入终浓度为 0.075%的Ⅰ型胶原酶,37 ℃摇床内消化40 min,加入含10%FBS的低糖 DMEM 培养基终止消化,200目滤网过滤,1 500 r/min离心5 min,去上清后加入完全培养基重悬,计数后以5×104cell/cm2的细胞浓度接种于培养皿内,37 ℃、5%CO2、饱和湿度培养箱内培养。每3天换液一次,待细胞融合达85%后传代,收集第3代细胞备用。
1.4 hADSCs诱导分化及检测
1.4.1成脂分化诱导
37 ℃的6孔板中加入第3代hADSCs,37 ℃、5%CO2、饱和湿度培养箱内培养,直到细胞达到100%融合。将原培养基替换为2 mL完全成脂培养基A培养3 d,然后替换为完全成脂培养基B培养 24 h。培养基A和B重复交替3个周期。用10%中性甲醛固定30 min,1 mL油红O工作液染色10 min,显微镜下观察细胞。
1.4.2成骨分化诱导
取第3代hADSCs,37 ℃、5%CO2、饱和湿度培养箱内培养,直到细胞融合达 80%~90%,替换为2 mL完全成骨分化培养基,每3天更换1次培养基。3 周后用10%中性甲醛固定30 min,1 mL茜素红染色5 min,显微镜下观察细胞。
1.4.3成软骨分化诱导
取第3代hADSCs接种于离心管中,加入完全软骨分化培养基,平均每管细胞数为2×105个。每3天更换1次培养基。在诱导培养基中培养4周后,固定细胞,石蜡切片,阿尔新蓝50~60 ℃染色15 min,显微镜下观察细胞。
1.5 材料支架的制作
取无纺PGA,均匀嵌入预制的圆柱状(直径5 mm、厚度1 mm)模具内,滴加含0.5%PLA的二氯甲烷溶液约50 μL,待其自然干燥后,用75%乙醇浸泡8 h,PBS洗涤3次,含10%FBS低糖DMEM培养基预培养过夜,准备接种细胞。共制作支架36个。
1.6 细胞-支架复合物的体外培养及分组
实验分为3组,每组12个细胞-支架复合物。对照组1(MC),接种单纯残耳软骨细胞,细胞浓度为 5.0×107cells/mL。对照组2(Co-culture 1),接种第2代残耳软骨细胞+常规负压抽脂获取的第3代hADSCs(1∶1)共培养,细胞浓度为 5.0×107cells/mL;实验组(Co-culture 2),接种第2代残耳软骨细胞+第三代超声辅助抽脂获取的第3代hADSCs(1∶1)共培养,细胞浓度为 5.0×107cells/mL。3组细胞-支架复合物均置于含10%FBS的DMEM培养液中培养,每周换液3次,体外培养4周后,每组取6个标本进行相关检测,剩余6个植入裸鼠体内。
1.7 裸鼠体内移植
每只裸鼠皮下分别植入对照组、实验组1和实验组2的细胞-支架复合物各1个,共6只裸鼠。对照组植入左背上部,实验组1植入左背下部,实验组2植入右背下部。体内植入8周后取出进行检测。
1.8 相关评价指标的检测
对体外培养4周和体内培养8周的各组标本进行大体观察,包括新生组织的形态、大小和色泽,并进行称重。
阿利辛蓝比色法检测上述各组标本的糖胺多糖(GAG)含量。
将各组标本以 4%中性甲醛固定、石蜡包埋、切片。HE染色观察细胞基本形态和组织结构;甲苯胺蓝染色及 Safranin O 染色观察软骨组织的异染程度及基质中 GAG 的分泌情况;Ⅱ型胶原免疫组化染色观察各组标本Ⅱ型胶原表达情况。
应用生物力学分析仪对各组标本进行弹性模量检测,以最大负荷250 N、0.3 mm/min的位移速度加压,计算新生组织的弹性模量。
1.9 统计学分析

2 结果
2.1 残耳软骨细胞形态学观察
原代残耳软骨细胞约12~24 h贴壁,48 h后开始增殖。细胞刚贴壁时为圆形,伸展后呈多角形,类似于同源细胞群的生长方式形成独立的小群体,中央密集处可形成软骨样结节。一般8~10 d可达90%以上的汇合状态。传代后细胞生长速度加快,4 d即可接近汇合状态,可继续传代。残耳软骨细胞随传代出现伪足状细胞突起,呈现出更加明显的长梭形外观(图1)。

A:残耳软骨;B:残耳软骨细胞. A: Microtia ear cartilage; B: Microtia chondrocytes.图1 残耳软骨与残耳软骨细胞Fig. 1 Microtia ear cartilage and microtia chondrocytes
2.2 hADSCs形态观察
第三代超声辅助抽脂和常规负压抽脂获取的hADSCs接种48 h后都可见大部分细胞开始贴壁,为多角形的单层细胞,有的细胞体细长似成纤维细胞。72 h后大多数细胞贴壁,并开始伸展、分裂,呈梭形。5~7 d后细胞逐渐分裂、融合成单层并铺满底部。细胞平均传代扩增时间约为3 d,第3代细胞分裂增殖旺盛,细胞细长,排列紧凑且规律(图2)。

A:UAL和SAL抽脂部位;B:UAL提取的hADSCs;C:UAL和SAL抽取的脂肪;D: SAL提取的hADSCs A: Liposuction area of UAL and SAL; B: hADSCs obtained by UAL; C: Adipose tissue obtained by UAL and SAL; D: hADSCs obtained by SAL图2 通过UAL和SAL获取hADSCsFig. 2 hADSCs obtained by UAL and SAL
2.3 hADSCs的定向诱导分化
成脂诱导分化72 h后,镜下可见细胞立体感增强,细胞内有小脂滴出现,约1周后脂滴数量增加并相互融合,细胞由长梭形变为圆形或多边形,诱导第11天时,细胞分化达到高峰,可见大量脂滴融合成团,油红O染色阳性,显示有大量脂质沉淀(图3B、E)。

A:SAL提取的hADSCs成骨分化;B:SAL提取的hADSCs成脂分化;C:SAL提取的hADSCs成软骨分化;D:UAL提取的hADSCs成骨分化;E:UAL提取的hADSCs成脂分化;F:UAL提取的hADSCs成软骨分化。 A: Osteogenic differentiation of hADSCs obtained by SAL; B: Adipogenic differentiation of hADSCs obtained by SAL; C: Chondrogenic differentiation of hADSCs obtained by SAL; D: Osteogenic differentiation of hADSCs obtained by UAL; E: Adipogenic differentiation of hADSCs obtained by UAL; F: Chondrogenic differentiation of hADSCs obtained by UAL图3 hADSCs的鉴定Fig. 3 Identification of hADSCs
成骨诱导分化第4天时,细胞呈多角形,胞质内细胞颗粒增多;第8天时胞质内充满颗粒,细胞呈集落样生长,细胞间见钙质沉积;第12天时细胞结节中心的细胞逐渐融合失去细胞结构,钙结节形成明显;第14天时诱导分化达到高峰,可见大量钙沉积,并融合成片,茜素红染色阳性,呈红色结节(图3A、D)。
成软骨诱导分化24 h后,细胞呈小颗粒状漂浮在诱导液中,单个细胞形态无明显变化。随诱导时间延长,在密度较大处细胞逐渐聚集成群;诱导第7天即可在聚集细胞的表面看到微黄色的物质积累,量逐渐增多;诱导第21天时达到高峰,阿尔新蓝染色阳性(图3C、F)。
2.4 体外培养4周时的细胞-支架复合物的大体、组织学观察
体外培养4周后,大体观察可见3组细胞-支架复合物均形成了类软骨组织,呈微黄色、略有光泽,较薄。组织学观察可见对照组1、对照组2与实验组均未形成基质饱满的类软骨组织,组织结构疏松,类似细胞-材料复合物生长的早期阶段,仅有少量新生基质的生长包裹,呈现软骨特异性ECM沉积,仍有未降解的PGA支架材料。番红O染色、Ⅱ型胶原染色、甲苯胺蓝染色都可见稀少的新生基质,分别表现为淡染的红色、黄色、蓝色(图4)。
2.5 体内培养8周时的细胞-支架复合物的大体、组织学观察
体内培养8周后取材,大体观察可见3组细胞-支架复合物均形成了与原支架等大的类软骨组织,色微黄,触之有弹性。组织学观察显示,对照组1软骨组织不均一,大部分区域形成成熟的软骨组织,可见大量的软骨陷窝和细胞外基质分泌,但有部分区域组织结构疏松,软骨特异性ECM分泌较少;对照组2与实验组均形成成熟的软骨组织,结构均一,可见大量的软骨陷窝和细胞外基质分泌,支架材料已经完全降解。番红O染色、Ⅱ型胶原染色、甲苯胺蓝染色都显示强阳性(图5)。
2.6 细胞-支架复合物称重
对各组标本进行称重,结果显示对照组2与实验组均显著优于对照组1(P<0.05),对照组2与实验组无显著差异(P>0.05)(图6 A)。
2.7 GAG含量检测
对各组标本进行GAG含量检测,结果显示对照组2与实验组均显著高于对照组1(P<0.05),对照组2与实验组无显著差异(P>0.05)(图6B)。

图4 体外培养4周细胞-支架复合物大体、组织学观察。MC(对照组1),Co-culture 1(对照组2),Co-culture 2(实验组)Fig. 4 Gross view and histological observation of cell-scaffold complex after cultured 4 weeks in vitro. MC(ctrl group 1), Co-culture 1(ctrl group 2),Co-culture 2(Exp group)

图5 体内培养8周细胞-支架复合物大体、组织学观察。MC(对照组1),Co-culture 1(对照组2),Coculture 2(实验组)Fig. 5 Gross view and histological observation of cell-scaffold complex after cultured 8 weeks in vivo. MC(ctrl group 1), Co-culture 1(ctrl group 2),Co-culture 2(Exp group)
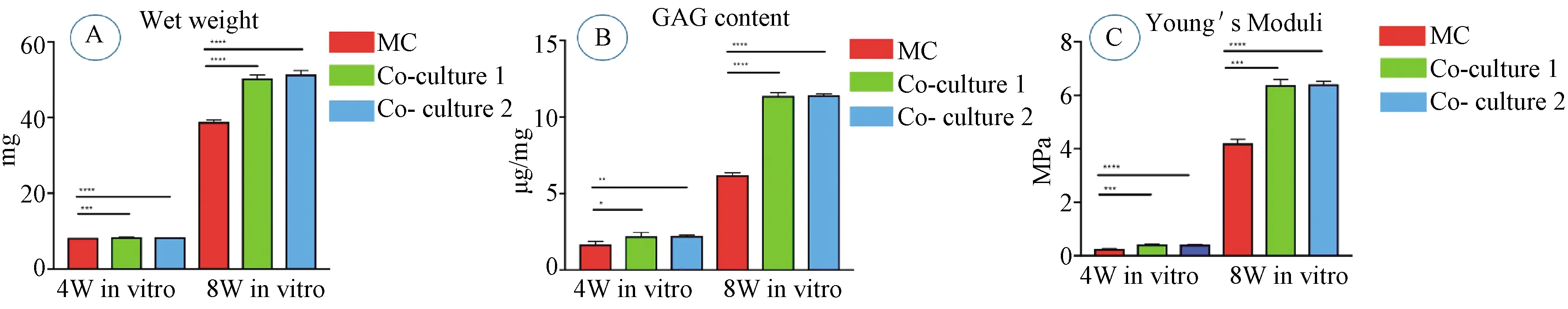
图6 体外培养4周和体内培养8周各组湿重、GAG含量、杨氏模量的比较。MC(对照组1),Co-culture 1(对照组2),Co-culture 2(实验组)Fig. 6 The comparisons of wet weight, GAG content and Young’s modulus among the 3 groups after cultured 4 weeks in vitro and 8 weeks in vivo. MC(ctrl group 1),Co-culture 1(ctrl group 2),Co-culture 2(Exp group)
2.8 生物力学检测
各组标本弹性模量检测结果显示,体外培养4周后,3组标本力学强度都很低,对照组2与实验组显著优于对照组1(P<0.05),对照组2与实验组无差异(P>0.05)。但经过体内8周的重塑后,3组标本的弹性模量都有明显提升,对照组2与实验组显著优于对照组1(P<0.05),对照组2与实验组无显著差异(P>0.05)(图6C)。
3 讨论
构建组织工程软骨耳郭最主要的问题是种子细胞的来源,小耳畸形患者的残耳软骨组织往往较小,不足以提供足量的残耳软骨细胞,而过度体外扩增将使软骨细胞逐渐失去表型及分泌软骨基质的能力,进而失去成软骨能力[10-11]。而ADSCs来源广、易获得、纯化率高、体外增殖速度快,是构建软骨组织的理想种子细胞。ADSCs成软骨细胞诱导的研究较多,但传统的诱导方法需要大量生长因子,难以应用于临床。研究发现,软骨微环境能有效促进干细胞成软骨分化,形成软骨样组织并用于修复缺损[12-13]。微环境可能的作用机制为:软骨细胞分泌 TGF-β、IGF 等生长因子,诱导干细胞向软骨方向分化[10];相邻细胞间的相互作用[11];分泌软骨微环境特异性细胞外基质,作用于细胞的增殖、分化、黏附及细胞间信号传导等。研究显示,残耳软骨细胞在体外独立模拟软骨诱导微环境,能够诱导ADSCs定向分化并形成软骨组织[14]。因此,本实验采用ADSCs和残耳软骨细胞共培养来构建软骨组织,湿重、糖胺多糖、生物力学检测都显示对照组2与实验组均显著优于对照组1,对照组2与实验组间无显著差异。组织学染色结果类似,对照组2与实验组形成的软骨组织结构均一,可见有大量的软骨陷窝和细胞外基质分泌,对照组1软骨组织不均一,有部分区域组织结构疏松,软骨特异性ECM分泌较少。由此推断,残耳软骨细胞微环境对ADSCs的软骨方向分化具有确切的促进作用,共培养组中的ADSCs能替代一定量的残耳软骨细胞形成软骨样组织。
超声辅助吸脂的基本原理是将电能转化为振动,引起热效应、空泡效应和机械效应,从而导致脂肪碎裂;超声能量会选择性地分解脂肪组织,对组织损伤较小,从而在减少出血的情况下实现抽脂。本实验中超声辅助吸脂和常规负压吸脂获得的ADSCs都可以进行成骨、成脂和成软骨分化,并且超声辅助吸脂和常规负压吸脂获得的ADSCs与残耳软骨细胞共培养都可以成功构建组织工程软骨,两者之间无显著差异,表明超声能量对ADSCs无不良影响。
综上所述,应用第三代超声辅助吸脂可以安全有效地获取ADSCs,超声能量对ADSCs无不良影响;应用第三代超声辅助抽脂获取的hADSCs+残耳软骨细胞共培养,可形成成熟的组织工程软骨。

