桃叶珊瑚苷抑制机械张力诱导增生性瘢痕的机制研究
程雨龙 杨松林 邓辰亮 郑江红
增生性瘢痕(Hypertrophic Scar,HS)是一种常见的皮肤疾病,通常表现为高出皮肤表面的瘢痕增生,并伴有疼痛、牵拉感或瘙痒[1]。增生性瘢痕的病理生理和分子机制极为复杂,目前已发现的相关因素包括过度炎症、长时间再上皮化、细胞外基质(Extracellular matrix,ECM)沉积等[2]。在皮肤损伤发生时,中性粒细胞、巨噬细胞、T淋巴细胞以及上皮细胞、内皮细胞和成纤维细胞等各种炎性细胞被招募到损伤部位[3],随后释放多种细胞因子,如MCP-1、TNF-α、TGF-β、EGF等,刺激一系列瘢痕形成活动,如ECM沉积、再上皮化和血管再生等[4-5]。这一过程涉及多条信号通路,如通过激活TGF-β1/Smad信号通路,可使正常成纤维细胞向肌成纤维细胞转化,导致ECM大量沉积[6]。除了TGF-β1/Smad信号途径外,一些非Smad途径也被认为可以调节HS的形成,例如胞内磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)途径。PI3K/Akt细胞通路被认为与炎症反应和细胞凋亡存在密切关系。研究表明,PI3K/Akt细胞通路可以通过增强IκB的磷酸化,从而激活NF-κB,进而促进炎症因子TNF-α的产生和释放并引起炎症反应[7]。另有研究认为,PI3K/Akt在HS中表达明显上调,其抗凋亡作用可能促进了成纤维细胞的增殖[8]。
桃叶珊瑚苷(β-D-吡喃葡萄糖苷,Aucubin)是从日本桃叶珊瑚、杜仲、车前草等植物中分离得到的一种环烯醚萜苷[9],具有抗氧化、抗UVA损伤等多种生物学活性[10],还具有抗肝损伤、抗炎和促进伤口愈合的功效[11]。研究表明,在伤口愈合过程中,桃叶珊瑚苷可加速再上皮化和ECM形成,并抑制炎症细胞的释放。但目前对于桃叶珊瑚苷促进创面愈合的分子机制尚不清楚。
在HS的治疗方面,压力疗法、皮质类固醇、5-氟尿嘧啶(5-FU)和干扰素等已被证明是有效的[12],但副作用较多,包括色素减退、皮肤和皮下脂肪萎缩、毛细血管扩张等[13],且复发率也较高[14]。本研究拟探究桃叶珊瑚苷对机械张力诱导的增生性瘢痕的抑制作用,并对其分子机制进行研究。
1 材料和方法
1.1 实验材料
实验动物:4周龄SCID小鼠40只,雌性,体质量18~23 g(上海市肿瘤研究所)。桃叶珊瑚苷(上海融禾医药科技发展有限公司)。
苏木精和伊红染液(Fluka Analytical,瑞士),Western-blot试剂盒(Promega,美国),小鼠来源GAPDH、MCP-1、TNF-α、p-PI3K/PI3K、p-Akt/Akt抗体(Sigma,美国),光学显微镜(Olympus,日本)。
1.2 机械诱导小鼠HS模型的建立[15]
在小鼠背部切开一长约2 cm切口,6-0尼龙线缝合,4 d后拆除缝线,在伤口两侧用6-0尼龙线固定张力装置,每隔一天扩张2 mm,并用记号笔标记;8 d后每隔一天扩张4 mm,持续2周,设为实验组。对照组小鼠仅切开一长约2 cm切口并缝合,4 d后拆除缝线。
1.3 组织学检查
模型建立后1 d, 实验组小鼠腹腔注射桃叶珊瑚苷(5 mg/Kg·d)。对照组小鼠注射等剂量的生理盐水。2周、4周后切取创面组织。
完整切取标本后,10%甲醛固定,石蜡包埋,HE染色后在镜下观察,依据瘢痕指数、胶原蛋白结构以及炎症水平进行评分。瘢痕指数(Scar Elevation Index,SEI)是指瘢痕厚度与邻近正常皮肤厚度的比值。胶原蛋白的结构和炎症水平通过光镜下检查染色部分进行评估。
SEI评分:0分,SEI 0~1;1分,SEI 1~2;2分,SEI 2~3;3分,SEI≥3。
胶原结构:0分,组织良好,无旋涡样结构;1分,组织紊乱,无旋涡样结构;2分,组织紊乱且有1个旋涡/高倍视野下(HP);3分,组织紊乱,≥2个旋涡/HP。
炎症水平:0分,无单核细胞;1分,单核细胞或肥大细胞2~5个/HP;2分,单核细胞或肥大细胞5~10个/HP;3分,单核细胞或肥大细胞>10个/HP。
最后将每项评分相加,计算样本的组织病理学得分。
1.4 Western-blot检测相关蛋白
实验组于注射前、注射后4 周切取创面组织,对照组在相同时间点取材。依据蛋白提取试剂盒说明书提取样本蛋白,BCA法测定蛋白浓度,Western-blot检测GAPDH(内参)、MCP-1、TNF-α、p-PI3K/PI3K、p-Akt/Akt在各组标本中的蛋白表达情况。
1.5 统计方法

2 结果
2.1 桃叶珊瑚苷对瘢痕模型组织学评分的影响
镜下观察两组标本的组织学和结构变化,并进行组织学评分。结果显示,2周、4周后取材,相比对照组,实验组小鼠瘢痕评分均明显降低(P<0.05)(图1)。
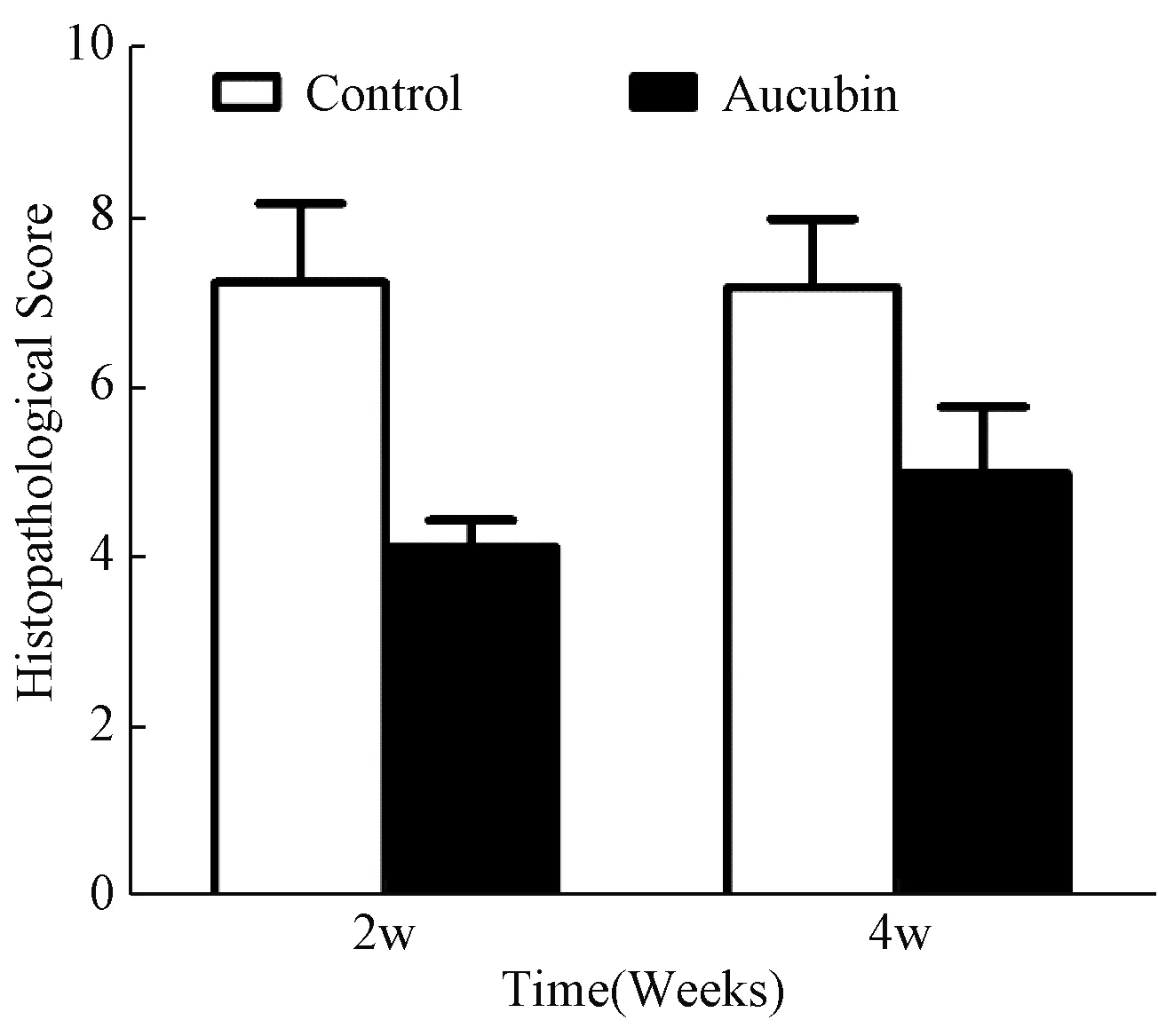
图1 2周、4周时实验组与对照组小鼠瘢痕评分对比Fig. 1 Comparison of scar scores between the experimental group and the control group 2 weeks and 4 weeks after injection
2.2 桃叶珊瑚苷对炎症反应的影响
Western-blot结果显示,桃叶珊瑚苷注射前,实验组相比对照组MCP-1蛋白表达水平显著升高(P<0.05),表明实验组中性粒细胞的趋化因子上调;注射桃叶珊瑚苷4周后,对照组MCP-1表达无明显变化,而实验组中MCP-1表达显著降低(P<0.05)(图2)。
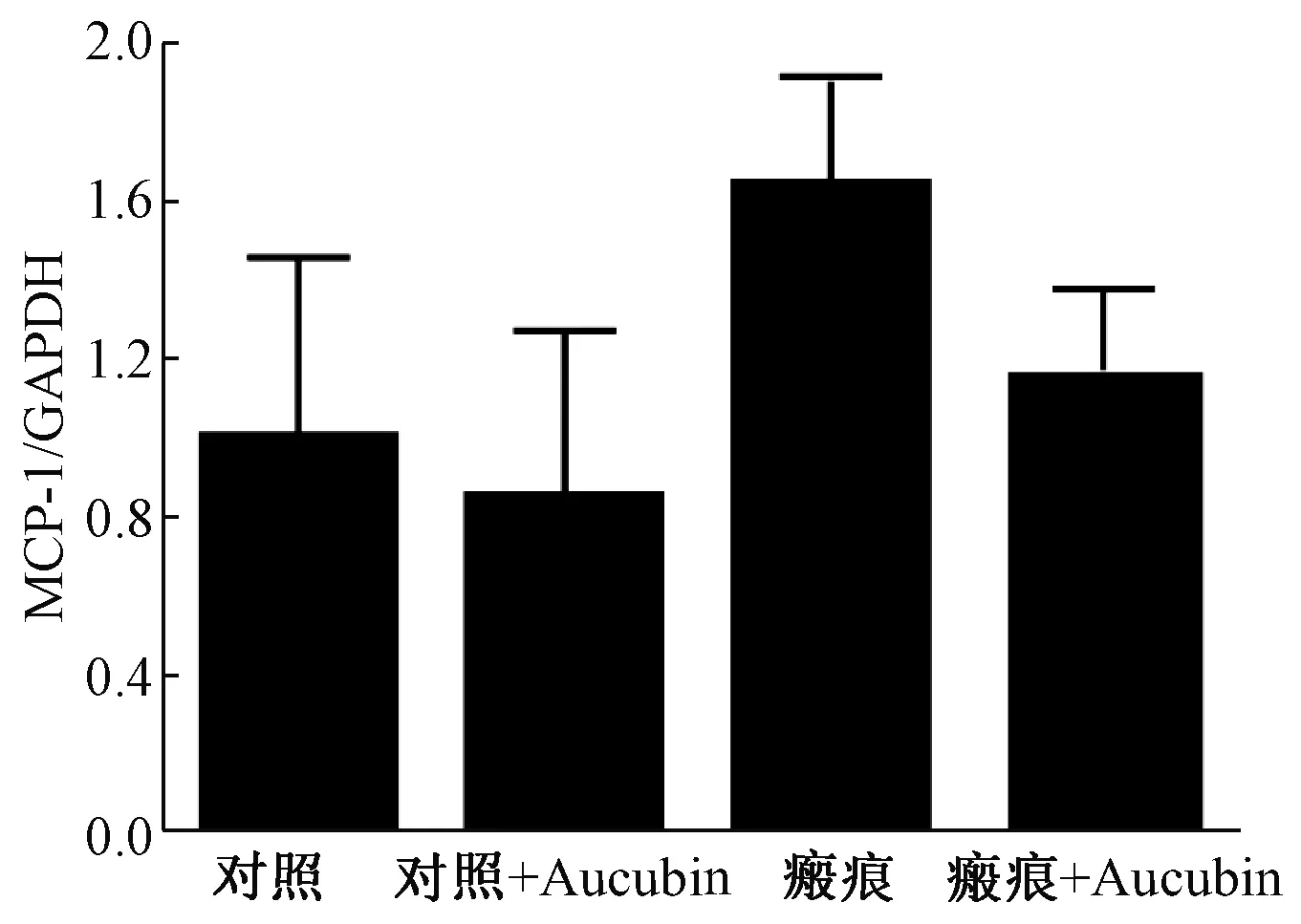
图2 不同方法处理后MCP-1在各组的表达对比Fig. 2 Comparison of MCP-1 expression in each group after different treatments
同样的,桃叶珊瑚苷注射前,实验组相比对照组TNF-α蛋白表达水平显著升高(P<0.05);注射桃叶珊瑚苷4周后,对照组TNF-α表达无明显变化,而实验组中TNF-α表达显著降低(P<0.05)。(图3)
显然,桃叶珊瑚苷抑制了TNF-α和MCP-1的蛋白表达,表明桃叶珊瑚苷可以显著减轻HS小鼠的炎症反应。
2.3 桃叶珊瑚苷对PI3K/Akt信号通路的影响
采用Western-blot检测p-PI3K/p-Akt表达,结果显示,桃叶珊瑚苷注射前,实验组相比对照组PI3K/Akt磷酸化水平明显升高(P<0.05),说明HS中PI3K/Akt信号通路上调;注射桃叶珊瑚苷4周后,对照组p-PI3K/p-Akt表达无明显变化,而实验组表达显著降低(P<0.05),说明桃叶珊瑚苷可以显著降低PI3K/Akt信号通路的表达(图4)。
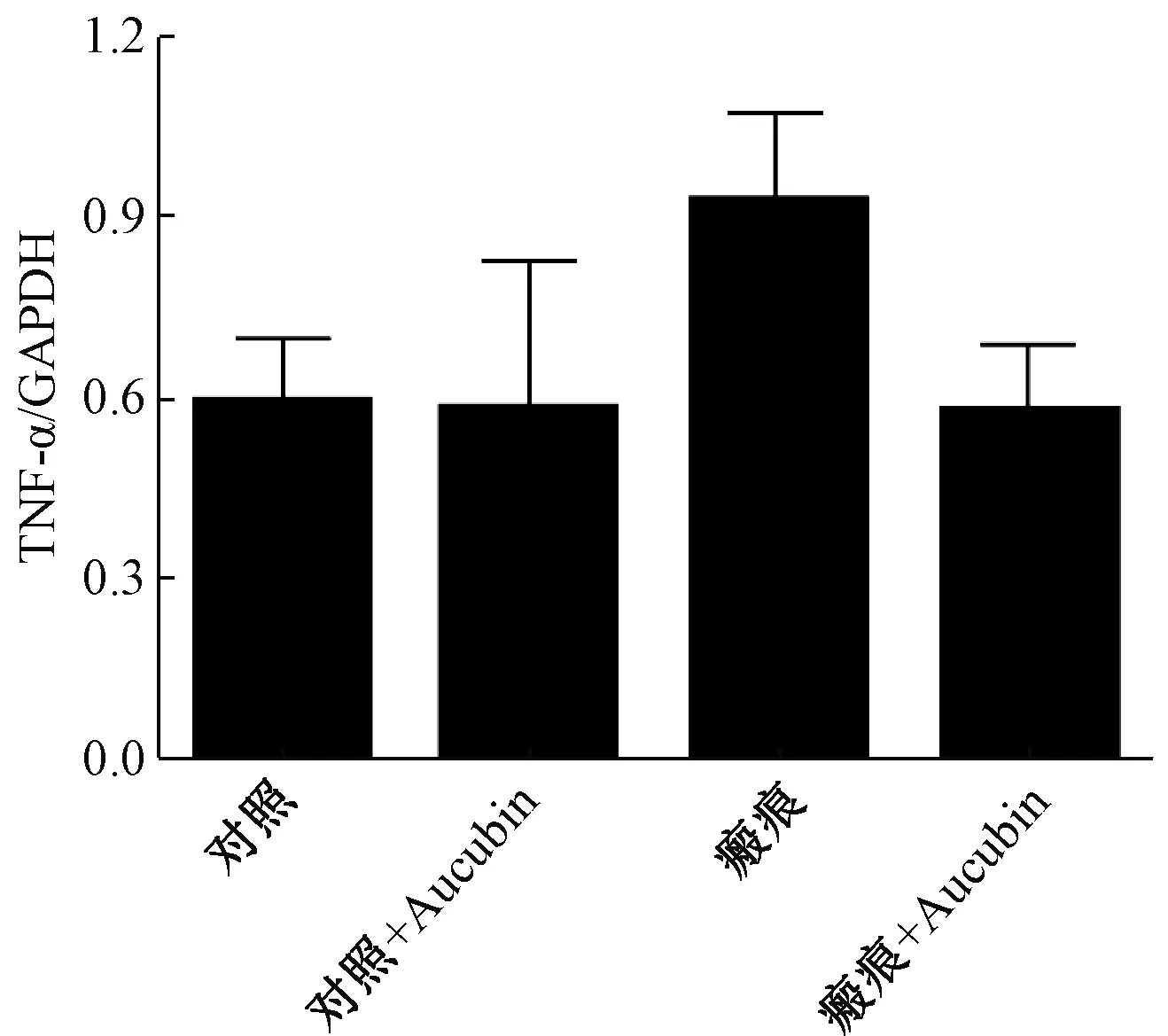
图3 不同方法处理后TNF-α在各组的表达对比Fig. 3 Comparison of TNF-α expression in each group after different treatments
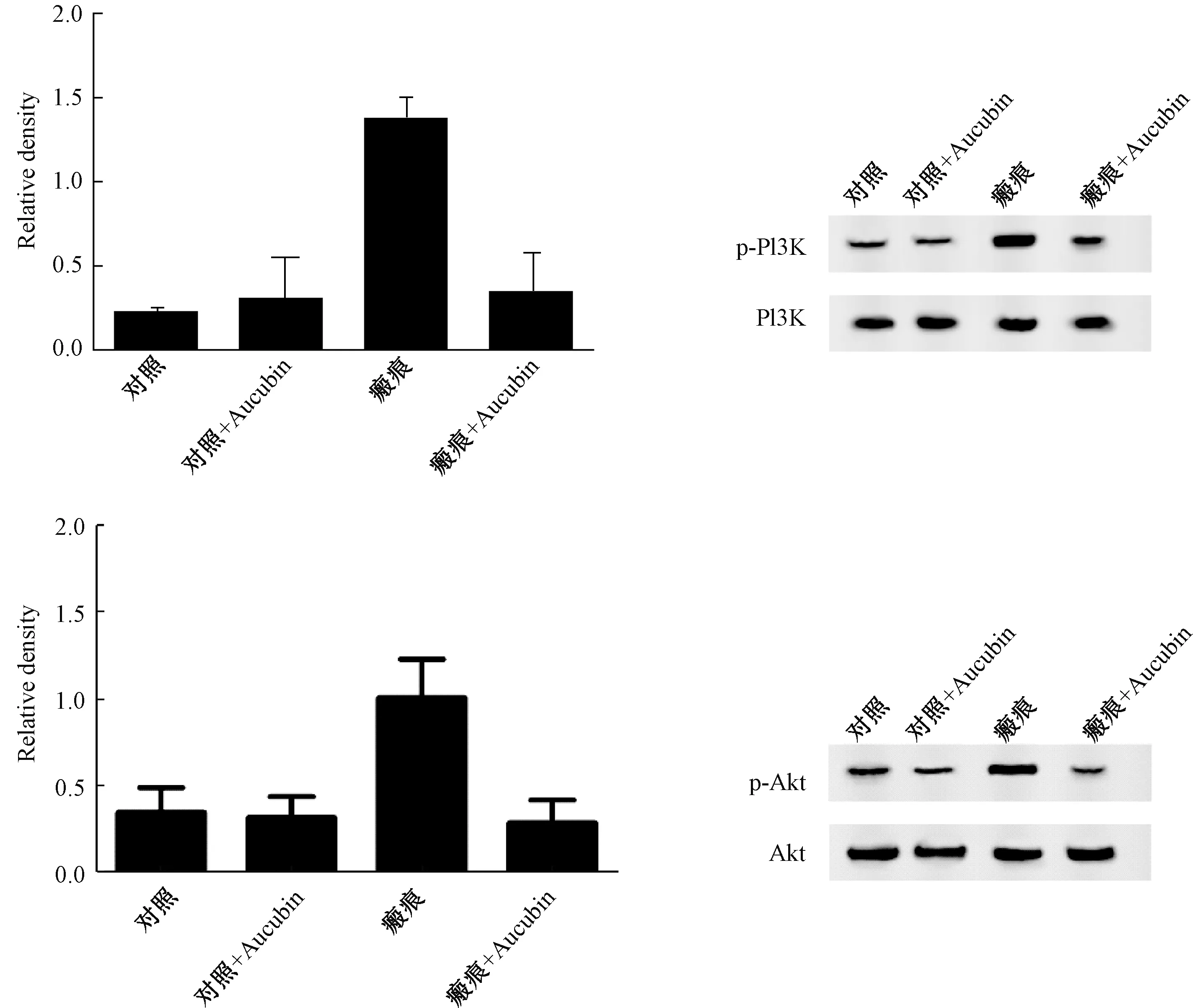
图4 不同方法处理后p-PI3K/p-Akt在各组的表达对比Fig. 4 Comparison of p-PI3K/p-Akt expression in each group after different treatments
3 讨论
增生性瘢痕通常会发生在皮肤张力较高的部位,如肩部、颈部和前胸等[16]。研究证明,机械牵拉可多方面影响成纤维细胞的生理学特征,包括迁移、增殖、蛋白质合成和基因表达等[17-18]。随着皮肤的周期性牵张,HS成纤维细胞的生长方向会与机械应力方向明显一致[19]。小鼠机械诱导瘢痕增生动物模型是一种特征性很强的模型,且广泛应用于HS的研究[15]。组织病理学检查显示,在机械应力诱导的HS中,胶原纤维变粗、变大,排列紊乱,形成胶原旋涡。为了消除皮肤张力,早期HS采用压缩治疗的方法[14],但因舒适性差而导致患者无法长期坚持[20]。其他方法,包括皮质类固醇注射、5-FU注射和激光治疗[21],已被广泛应用于临床。然而,由于治疗副作用多以及复发率较高,HS的临床治疗效果仍不令人满意。
本研究拟将桃叶珊瑚苷作为一种治疗HS的潜在药物进行研究。桃叶珊瑚苷是从植物中提取的一种天然化合物,具有多种药理作用,其抗炎和抗纤维化作用一直被广泛研究[11]。本实验中,我们从瘢痕厚度改变、胶原排列以及炎症反应三个方面评估桃叶珊瑚苷对于HS模型的治疗效果,发现其可有效降低HS模型的瘢痕评分,并以此推测桃叶珊瑚苷可通过抑制胶原增生、排列紊乱以及减轻炎症反应而抑制HS形成。
HS的形成可分为3个阶段,即过度炎症、长时间再上皮化、基质沉积[2]。炎症反应是HS发生发展的关键步骤,可表达多种细胞因子,如TNF-α、IL-6、TGF-β和MCP-1。我们利用Western-blot检测炎症标志物TNF-α和MCP-1的表达,结果两者在HS中表达显著上调,但在注射桃叶珊瑚苷后,其表达水平均明显降低,恢复正常。该结果进一步证实了桃叶珊瑚苷是通过抑制HS的炎症反应从而抑制HS的形成。
PI3K/Akt信号通路在HS的形成中起重要作用,不仅可调节炎症反应,而且在成纤维细胞增殖中也起重要作用[22]。本实验探究了桃叶珊瑚苷对于PI3K/Akt信号通路的作用,并检测桃叶珊瑚苷注射治疗后HS小鼠的p-PI3K和p-Akt的表达。结果表明,HS小鼠中p-PI3K、p-Akt表达均有显著增高,经注射桃叶珊瑚苷后,HS小鼠中p-PI3K、p-Akt水平显著降低,说明该信号通路被桃叶珊瑚苷有效抑制。然而,是否存在其他途径的参与,以及这些途径如何影响HS等问题仍需进一步研究。
综上所述,桃叶珊瑚苷在动物体内可通过减轻炎症反应而有效抑制增生性瘢痕形成,该作用可能是通过抑制PI3K/Akt信号通路介导的。

