miR-200a在TGF-β诱导口腔黏膜修复中的功能研究
代冬 冯小东
口腔黏膜是由口腔上皮细胞、成纤维细胞和细胞外基质组成的黏膜屏障系统,可有效抵御病原体,是维护口腔健康的第一道屏障[1]。然而,口腔黏膜常受到局部物理性伤害,引发破损、溃疡等损伤[2]。研究发现,口腔黏膜创面形成后可激活固有免疫细胞,如单核-巨噬细胞、树突状细胞和中性粒细胞等,并产生大量炎症因子,引发局部的炎症反应[3-5]。其中,TGF-β在促进口腔黏膜重建和修复的过程中发挥了重要作用[3,6-7]。TGF-β可通过刺激口腔黏膜成纤维细胞增殖和迁移以促进伤口修复,但对口腔黏膜成纤维细胞活性的调控机制还不完全清楚。
微小RNA(microRNA,miRNA)是一类内源基因表达的非编码RNA,可通过与下游靶基因的mRNA形成特定的配对位点,调控下游基因的表达水平,影响多种细胞生理活动[8]。miR-200a是miR-200家族中的主要成员,在TGF-β信号转导通路中具有重要作用[9],但是否参与口腔黏膜修复和重建的调控还不清楚。本研究利用人牙龈成纤维细胞(Human Gingival Fibroblast,HGF),对TGF-β诱导口腔黏膜修复过程中miR-200a的表达及功能进行初步研究。
1 材料和方法
1.1 实验试剂及仪器
DMEM高糖培养基、胎牛血清、Trypsin-EDTA胰酶消化液(ThermoFisher公司,美国);M-MLV逆转录试剂盒(北京全式金生物技术有限公司);重组人转化生长因子β(R&D公司,美国);Lipofectmine RNAiMAX转染试剂、TRIzol(Invitorgen公司,美国);CCK-8细胞增殖检测试剂盒(同仁化学,日本),Transwell细胞培养小室(BD公司,美国)。
1.2 健康牙龈标本采集及原代HGF培养
收集本院口腔科因手术拔除阻生第三磨牙而切除的牙龈组织。入组标准:①年龄≤30周岁;②无口腔癌和牙周病;③无全身系统性疾病。手术切除的新鲜牙龈组织以4 ℃预冷的含有1%青霉素-链霉素的HBSS冲洗,去除残留血凝块,并用眼科剪修剪成为5 mm3大小的方块,随后加入1 U/mL的Dispase Ⅱ分散酶,置于4 ℃冰箱中静置16 h。次日,小心分离牙龈组织的表皮层、血管等组织,加入0.25%Trypsin-EDTA,放置于37 ℃培养箱消化30 min后,加入胎牛血清终止消化,1 000 r/min离心5 min,使用含有10%胎牛血清和青霉素、链霉素的DMEM培养基重悬细胞,培养于60 mm细胞培养皿中。待细胞充分贴壁后换液,去除悬浮的组织碎片。每天换液,每3天传一代。第3代HGF用于后续实验。
1.3 细胞总RNA提取
第3代HGF分别加入终浓度0、5、10、20、40 ng/mL的重组人TGF-β处理24 h,经Trypsin-EDTA消化分离细胞,加入500 μL TRIzol,室温静置20 min,随后加入100 μL三氯甲烷,充分混匀后12 000 g离心10 min,取200 μL上清,加入等体积异丙醇,12 000 g离心10 min,沉淀的总RNA用70%乙醇清洗2遍,晾干后加入50 μL DEPC水充分溶解。
1.4 实时荧光定量PCR
取0.5 μg总RNA,利用M-MLV逆转录试剂盒合成cDNA,随后使用罗氏SYBR Green qPCR Mix,以逆转录方式得到的cDNA为模板进行实时荧光定量PCR检测。对miR-200a的定量检测使用U6为对照内参,反应所需的引物序列为:miR-200a正向引物5’-CCTACGCCACAATTAACAAGCC-3’;miR-200a反向引物5’-GCCGTCTAACACTGTCTGGTA-3’;U6正向引物5’-CTCGCTTCGGCAGCACA-3’;U6反向引物5’-TGGTGTCGTGGAGTCG -3’。
1.5 实验分组及细胞转染
将第3代HGF分为空白组、对照组和实验组。对照组和实验组均加入20 ng/mL TGF-β预处理12 h,随后对照组转染随机序列miRNA,实验组转染miR-200a模拟物,空白组不予TGF-β刺激及转染操作。miRNA的转染使用Lipofectmine RNAiMAX转染试剂,miRNA及转染试剂使用量参照转染试剂操作说明,依据每次转染的细胞数确定。
1.6 Transwell细胞迁移实验
Transwell小室预先加入500 μL终浓度为10 μg/mL的Fibronectin溶液于24孔板中,让小室下层基底膜充分接触Fibronectin溶液,37 ℃孵育2 h。随后将小室取出,PBS清洗2次。将各组细胞消化并使用无血清DMEM培养基重悬,调整细胞浓度为1×106cells/mL,上层小室加入200 μL细胞悬液,下层小室加入含有10%胎牛血清的DMEM完全培养基。37 ℃培养18 h后,取出Transwell小室,用棉签擦拭上层小室中未迁移的细胞,然后将小室基底膜放置于4%多聚甲醛溶液中,室温下固定15 min,PBS清洗后结晶紫溶液染色20 min,PBS清洗3次,小心取下基底膜,镜下观察拍照,并统计每个视野中迁移的细胞数目。
1.7 CCK-8检测细胞增殖
空白组、对照组和实验组HGF消化离心并重悬,取2×104个细胞接种于96孔板中,每组设置3个复孔。待细胞充分贴壁后,于0 h、24 h和48 h,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,酶标仪读取450 nm处的吸光度值。
1.8 蛋白质免疫印迹实验
离心收集HGF,用预冷的PBS清洗1遍,加入200 μL RIPA细胞裂解缓冲液和蛋白酶抑制剂,冰上裂解30 min,12 000 r/min离心10 min,取上清加入50 μL 5×SDS上样缓冲液,100 ℃加热10 min,待样品冷却后使用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样品,后转到0.45 μm PVDF膜上。转印蛋白样品的PVDF膜先用5%脱脂牛奶封闭40 min,后依次孵育一抗和HRP偶联的二抗各1 h后,加入显色底物,使用凝胶成像仪获取显影图像,使用Gel Pro软件对蛋白显影条带进行灰度值定量分析。
1.9 统计学方法

2 结果
2.1 不同浓度TGF-β对HGF中miR-200a表达的影响
与无TGF-β处理组(0 ng/mL)相比,TGF-β处理的HGF中miR-200a表达水平显著下降,且随着TGF-β作用浓度提高,表达下降比例增加,具有明显的剂量依赖效应(图1)。
2.2 细胞转染对HGF中miR-200a表达水平的影响
与空白组相比,对照组miR-200a表达水平显著下降(P<0.05);与对照组细胞相比,实验组miR-200a表达水平显著上升(P<0.05)(图2)。

a:与空白组相比,P<0.05;b:与对照组相比,P<0.05 a: compared with blank group, P<0.05; b: compared with control group, P<0.05图2 各组细胞miR-200a表达水平比较Fig. 2 The expression level of miR-200a in each group
2.3 过表达miR-200a对HGF增殖活性的影响
与空白组相比,经TGF-β处理的对照组HGF在24 h和48 h时间点检测的细胞增殖活性显著上升(P<0.05);而与对照组相比,转染miR-200a模拟物的实验组HGF在24 h和48 h检测的细胞增殖活性显著下降(P<0.05)(图3)。

a:与同一时间点空白组相比,P<0.05;b:与同一时间点对照组相比,P<0.05 a: compared with blank group at the same time point, P<0.05; b: compared with control group at the same time point, P<0.05图3 各组细胞增殖活性分析Fig. 3 The proliferation activity of HGF cells in each group
2.4 过表达miR-200a对HGF迁移能力的影响
与空白组相比,对照组HGF迁移到下层小室的数量明显上升(P<0.05);与对照组相比,实验组HGF迁移到下层小室的数量明显下降(P<0.05),表明过表达miR-200a会影响细胞迁移(图4)。

a:与空白组相比,P<0.05;b:与对照组相比,P<0.05 a: compared with blank group, P<0.05; b: compared with control group, P<0.05图4 Transwell实验检测各组细胞迁移能力Fig. 4 The migration capability of HGF cells in each group
2.5 过表达miR-200a对HGF中Ⅰ型和Ⅲ型胶原表达的影响
蛋白质免疫印迹实验结果表明,与空白组相比,对照组Ⅰ型胶原和Ⅲ型胶原表达水平均显著上升(P<0.05);与对照组相比,转染miR-200a模拟物的实验组Ⅰ型胶原和Ⅲ型胶原表达水平均显著下降(P<0.05)(图5)。
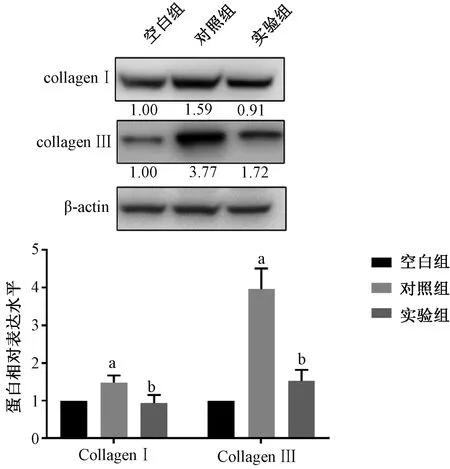
a:与空白组相比,P<0.05;b:与对照组相比,P<0.05 a: compared with blank group, P<0.05; b: compared with control group, P<0.05图5 各组细胞Ⅰ型和Ⅲ型胶原表达水平Fig. 5 The expression levels of collagen Ⅰ and Ⅲ in each group
3 讨论
创面愈合是皮肤、黏膜等在损伤后自发进行的一系列自我保护的生理过程,机体各个组织的创面愈合过程基本一致,都涉及到炎症反应、组织再生等生理活动,并且通过一个快速的修复过程避免机体的进一步损害,这一过程被高度有序地调控,然而其调控机制还不清楚[10]。口腔黏膜由于处于富含微生物的湿润环境中[2],其创面愈合重建的过程与皮肤相比可能有不同的调控机制。研究发现,miR-2053可以通过影响Ⅰ型、Ⅲ型胶原蛋白以及金属蛋白酶MMP-1、MMP-3的表达,影响HGF的迁移和增殖,进而影响口腔黏膜修复[11]。
口腔黏膜创伤愈合过程中,炎症因子发挥了重要的作用[6]。研究表明,口腔黏膜损伤后TGF-β表达水平上升,但其参与口腔创伤愈合和黏膜重建的机制尚未明确。本研究发现,在20 ng/mL TGF-β处理后,HGF的miR-200a表达水平下调,提示miR-200a可能在TGF-β信号通路下游发挥了重要作用。TGF-β在肿瘤和炎症反应中都发挥了重要的作用,但对细胞功能的调控作用在不同组织中或疾病的不同阶段都不尽相同。TGF-β信号转导主要是通过胞浆蛋白Smad的磷酸化介导的,TGF-β与膜受体结合,促进Smad蛋白发生磷酸化修饰,Smad蛋白N端MH1结构域具有DNA结合功能,而C端MH2结构域则可以与其他转录因子结合,激活TGF-β下游信号转导蛋白的转录[12]。关于TGF-β下游信号通路与miRNA的研究表明,TGF-β在促进或抑制某些miRNA的成熟中发挥了重要作用[13-14]。miR-200家族包括5个成员,即miR-200a、miR-200b、miR-200c、miR-141和miR-429。研究显示,在TGF-β诱导的肿瘤细胞上皮-间质转化过程中,miR-200家族成员的表达都显著下调。miR-200a可以抑制E-cadherin转录抑制因子ZEB1和ZEB2的表达,TGF-β通过下调miR-200a并增加ZEB2的表达水平,促进肿瘤细胞的迁移和浸润[15-16]。口腔黏膜修复过程中,成纤维细胞通过自身增殖、迁移来促进创口愈合,并通过表达胶原蛋白以促进基质的重建。在该过程中,TGF-β可以促进成纤维细胞的增殖和迁移、调控炎症反应、促进血管新生并促进胶原蛋白合成以重建细胞外基质,对口腔黏膜修复发挥了重要作用。本研究发现,HGF过表达miR-200a可以显著抑制TGF-β诱导的细胞增殖和细胞迁移,并可以抑制牙龈成纤维细胞表达Ⅰ型、Ⅲ型胶原蛋白。这些结果提示,在口腔黏膜修复过程中,miR-200a可以作为TGF-β信号通路重要的调控因子,影响牙龈成纤维细胞的功能。本研究为揭示TGF-β调控口腔黏膜修复重建的机制提供了新的研究基础。

