18F-FDG PET/CT显像对非结节型肝外胆管腺癌的诊断价值
冼伟均,冯彦林,黄克敏,王颖,鲁胜男
广东省佛山市第一人民医院核医学科,广东佛山 528000;*通讯作者 冯彦林 fylin@fsyyy.com
肝外胆管癌是起源于肝外胆管上皮的恶性肿瘤,包括肝门部胆管癌和远端胆管癌,其中以腺癌最常见,偶可见黏液腺癌、透明细胞腺癌、印戒细胞癌、腺鳞癌、未分化癌和神经内分泌肿瘤等。肝外胆管癌根据大体形态特点可以分为结节型、管壁浸润型以及腔内息肉型[1]。18F-FDG PET/CT 对结节型肝外胆管癌的诊断准确性较高[2-3],但对其他类型肝外胆管癌的诊断效能尚存在争议。有研究认为18FDG PET 对浸润型肝外胆管癌的诊断敏感度低[4-5];而Moon 等[6]的研究则持不同观点。上述研究均未考虑肝外胆管癌的病理分型以及肿瘤分化程度[4-6];但在多种恶性肿瘤的研究中发现,病灶的病理分型以及肿瘤细胞的分化程度均可对18F-FDG的摄取产生重要影响。由于绝大部分肝外胆管癌为腺癌,本研究拟分析18F-FDG PET/CT 在非结节型肝外胆管腺癌诊断中的价值,以及肿瘤细胞分化程度对病灶摄取18F-FDG的影响。
1 资料与方法
1.1 研究对象 回顾性分析2013年1月—2018年6月怀疑肝外胆管癌,并于佛山市第一人民医院行18F-FDG PET/CT检查患者的影像学资料。恶性病变组纳入标准:①PET/CT检查前未行肝外胆管有创性检查或治疗,包括手术、内镜逆行性胰胆管造影术或经皮肝穿刺胆管造影等;②PET/CT检查后2 周内行手术治疗,病理结果确诊为腺癌;③影像学检查未见结节样(直径>1 cm)病灶,术后病理大体分型排除结节型。依据病理结果将纳入患者分成高分化腺癌组、中分化腺癌组及低分化腺癌组。良性病变组纳入标准:PET/CT检查前未行肝外胆管有创性检查或治疗,影像学检查未见结节样(直径>1 cm)病灶,但病理结果证实为良性病变。
最终纳入122例患者,年龄22~85岁,中位年龄61岁。恶性病变组77例中,男41例,女36例;良性病变组45例中,男28例,女17例。
1.2 型别分类 恶性病变组患者按照腺癌细胞分化程度分为高分化组20例,中分化组39例,低分化组18例;按照发生部位分为肝门部胆管腺癌31例,远端胆管腺癌42例,4例为弥漫型。良性病变组中,胆管炎34例,胆管结石11例。在阳性显像患者中,58例行双时相18F-FDG PET/CT显像,分别为恶性病变组中高分化13例、中分化23例、低分化10例,良性病变组12例。
1.3 仪器与方法患者检查前空腹6 h 以上,空腹血糖≤150 mg/dl。静脉注射18F-FDG 4.44~5.55 MBq/kg,18F-FDG 放化纯度>95%。注射后静卧60 min。应用Philips GEMINI-DUAL PET/CT扫描仪进行扫描;在注射后180 min 再次行延迟扫描。扫描范围完整包含肝脏及胆道走行部。PET 采用3D 采集模式,3 min/床位;CT 采集条件:电压120 kV,电流200 mA,螺距1.0,层厚6 mm,重建厚度5 mm。利用CT扫描数据进行衰减校正,迭代法重建,图像融合处理后获得冠状位、矢状位及横断面显像。
1.4 图像分析 由2名核医学主治及以上职称医师共同阅片。分别采用视觉分析和SUV 半定量分析方法对病灶进行诊断。视觉分析:病变部位呈局限性放射性增高,放射性高于周围正常组织定义为阳性,无放射性增高定义为阴性。半定量分析:通过融合图像判断肝外胆管浓聚影部位及范围,并在图像中勾画感兴趣区(ROI)进行分析,获取最大标准化摄取值(SUVmax)。根据公式(1)计算最大标准化摄取值的滞留指数(RIsuv)。

1.5 血清CA19-9 检测 所有患者血清CA19-9 结果均取自手术或经皮肝穿刺胆管造影、内镜逆行性胰胆管造影术检查前1 周内。采用Roche E 601 全自动电化学发光分析仪及其配套CA19-9 试剂(CLIA),对不同分组血清CA19-9表达水平进行比较。
1.6 统计学方法 采用 SPSS 19.0软件,病灶SUVmax 等符合正态分布的计量资料以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD 法;年龄、RIsuv等不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis 检验,两组间比较采用Mann-WhitneyU检验。相关性分析采用Spearman 法。受试者工作特征(ROC)曲线下面积比较采用Delong 法。P<0.05表示有统计学意义。
2 结果
2.1 视觉分析 恶性病变组中,66例病灶显像阳性(图1);11例阴性,其中6例高分化腺癌、3例中分化腺癌、2例低分化腺癌,病变部位:7例位于肝门部胆管,4例位于远端胆管。良性病变组中,21例病灶显像阳性(图2);24例阴性。视觉分析PET/CT显像的敏感度为85.71%(66/77),特异度为53.33%(24/45),阳性预测值为75.86%(66/87),阴性预测值为68.57%(24/35),准确率为73.77%(90/122)。
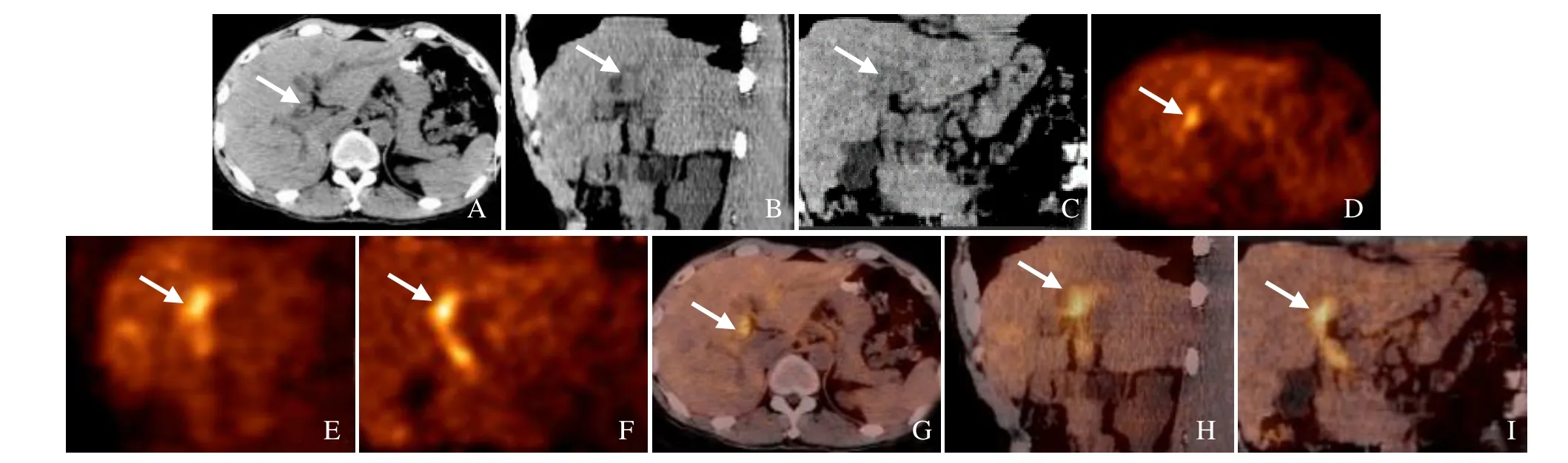
图1 男,46岁,非结节型中分化肝外胆管腺癌。CT 示左、右肝管汇合处及肝总管、胆总管管壁弥漫性轻度增厚(箭,A~C);PET 示增厚肝管及胆管FDG代谢明显异常增高(箭),SUVmax为5.7(D~F);PET/CT 融合图像示病灶部位(箭,G~I)
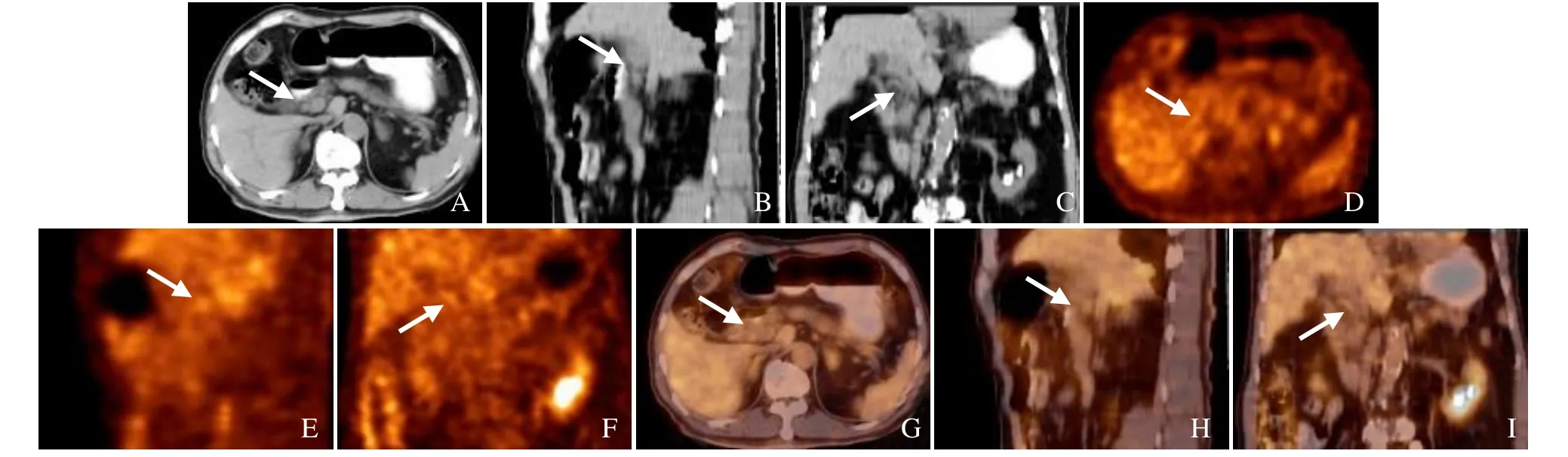
图2 男,74岁,胆总管炎。CT示胆总管中上段管壁轻度增厚(箭,A~C);PET示胆总管中上段管壁FDG代谢轻度增高(箭),SUVmax为1.7(D~F);PET/CT 融合图像示病灶部位(箭,G~I)
2.2 不同组患者SUVmax 比较 显像阳性患者中,高分化腺癌组14例、中分化腺癌组36例、低分化腺癌组16例、良性病变组21例的SUVmax分别为3.33±1.44、4.86±2.10、5.51±1.41、3.20±1.33,4组间差异有统计学意义(F=8.375,P=0.000);组间两两比较显示,中分化腺癌组、低分化腺癌组SUVmax 高于良性病变组,差异均有统计学意义(P=0.001、P=0.000),高分化腺癌组与良性病变组SUVmax 差异无统计学意义(P=0.822)。Spearman 相关分析显示,非结节型肝外胆管腺癌的SUVmax 与肿瘤细胞的分化程度呈负相关(r=-0.454,P=0.000)。
2.3 SUVmax 诊断非结节型肝外胆管腺癌的效能 对于18F-FDG PET/CT显像阳性患者,SUVmax 诊断良、恶性病变的ROC曲线下面积为0.769(0.667~0.852),Youden指数为0.439,SUVmax 诊断最佳临界值为3.8,对应的诊断敏感度与特异度分别为57.58%、86.36%,见图3。
2.4 不同部位及性别患者SUVmax 比较 肝门部非结节型胆管腺癌SUVmax为4.69±2.16,远端胆管SUVmax为4.63±1.82,差异无统计学意义(t=-0.128,P=0.898);男性患者SUVmax为4.98±2.19,女性患者SUVmax为4.35±1.62,差异无统计学意义(t=1.306,P=0.196)。

图3 SUVmax 诊断非结节型肝外胆管腺癌与良性病变的ROC曲线
2.5 不同组患者PET/CT 双时相显像RIsuv 与血清CA19-9表达水平比较 中分化腺癌组、低分化腺癌组RIsuv 均高于良性病变组,差异有统计学意义(Z=-2.332,P=0.020;Z=-2.310,P=0.021);血清CA19-9水平高于良性病变组,差异有统计学意义(Z=-2.051,P=0.040;Z=-2.809,P=0.005);而高分化腺癌组RIsuv、血清CA19-9 与良性病变组间差异均无统计学意义(Z=-1.063,P=0.288;Z=-1.850,P=0.064),见表1。

表1 各组患者双时相显像RIsuv 与血清CA19-9表达水平比较[M(P25,P75)]
3 讨论
肝外胆管癌常见的临床症状为无痛性黄疸,部分患者也可出现皮肤瘙痒、腹痛、消瘦、盗汗等[7]。由于临床症状不典型,影像学检查是诊断肝外胆管癌的重要方法。但超声、CT、MRI 等传统影像学检查对非结节型肝外胆管癌早期诊断存在困难,与硬化性胆管炎等所致胆管狭窄的良性病变难以鉴别[8]。
本研究结果显示,18F-FDG PET/CT显像对非结节型肝外胆管腺癌的诊断敏感度达85.71%,高于Kim 等[3]报道的80.8%及杨晖等[9]报道的61.7%,这一差异可能与本研究病例单一的病理构成有关。既往研究发现[10],所有胆管癌及转移性腺癌均呈高代谢;由于大部分胆管癌的病理类型亦为腺癌,故18F-FDG PET/CT显像对胆管腺癌的敏感度较高,其原因可能是胆管癌细胞内的葡萄糖-6-磷酸酶活性较低,18F-FDG 进入细胞内后形成18F-FDG-6-磷酸,但不能去磷酸化重新生成18F-FDG 离开细胞,使其容易滞留在腺癌细胞内[5]。然而,不同病理类型的胆管癌对18F-FDG的摄取存在差异,如黏液癌中的黏液成分短时间内无法摄取葡萄糖,导致黏液癌易出现假阴性结果[11]。此外,胆管腺癌细胞的分化程度也会影响18F-FDG PET/CT诊断的敏感度。本研究11例假阴性患者中,高分化腺癌的比例最高,且相关性分析显示 PET/CT显像的SUVmax 与肿瘤细胞的分化程度呈负相关,低分化程度患者SUVmax 较高,与Cho 等[12]的研究结论相符。这可能与肿瘤细胞的增殖活性有关。分化程度越低的患者其肿瘤增殖越快,18F-FDG的摄取程度越高[13];另一方面,低分化癌通常有较高的微血管密度[14];而根据肺癌、肾癌等相关研究结果显示,微血管密度与18F-FDG 摄取呈正相关[15-16]。既往研究发现胆管癌病灶的SUVmax 还与TNM分期具有相关性[17]。TNM分期越高,其SUVmax 越高,越容易呈阳性显像;不同发生部位[9]、不同性别[18]SUVmax 之间也存在差异。本研究未收集患者TNM分期的数据进行比较分析;但结果显示,远端胆管腺癌的诊断敏感度高于肝门部胆管腺癌,这可能与肝门部周围肝组织的高代谢相关。由于肝脏摄取18F-FDG 较高,肝门部胆管小病灶难以发现,在视觉分析上呈“阴性”结果;而不同性别患者之间SUVmax 并未发现差异。
视觉分析的特异性较低,由于炎症细胞和肿瘤细胞在许多代谢通道中存在相似的机制,炎性病变同样会导致胆管壁的18F-FDG 高摄取[19]。本研究中,中、低分化胆管腺癌的SUVmax 明显高于良性胆管病变,尤其是SUVmax>3.8时,诊断特异度较高,提示SUV半定量分析可以提高诊断的准确性。但高分化胆管腺癌SUVmax 与良性胆管病变无显著差异。相关研究发现,双时相显像有助于鉴别良、恶性病变[20]。Nishiyama 等[2]研究显示延迟显像可进一步提高肝外胆管癌的诊断准确性,但本研究结果发现高分化腺癌组与良性病变组RIsuv 间并无明显差异,提示双时相显像并不能有效地对两者进行鉴别。
肿瘤标志物检测对诊断高分化胆管腺癌具有一定的价值,最常用的指标为血清CA19-9。但本研究显示,高分化胆管腺癌的血清CA19-9水平与良性胆管病变差异无统计学意义,故需结合CA125、CEA 等其他血清肿瘤标志物提高诊断的准确性。
本研究存在一定的局限性,18F-FDG PET/CT 在诊断肝外胆管癌区域淋巴结转移、远处转移及分期方面均较传统影像学检查有明显的优势[9];而本研究并未进行分析。
总之,18F-FDG PET/CT显像是诊断非结节型肝外胆管腺癌有效的影像学方法,可鉴别诊断中、低分化肝外胆管腺癌,但对高分化肝外胆管腺癌的诊断价值有限,双时相显像并不能提高高分化肝外胆管腺癌的诊断准确性。

