氨氮和亚硝酸盐对单环刺螠幼体的急性毒性实验
张赛赛 宋晓阳 尚宏鑫 孙阳 周竹君 杨婷婷 田斌 宋珞珈 陈文博 刘彤

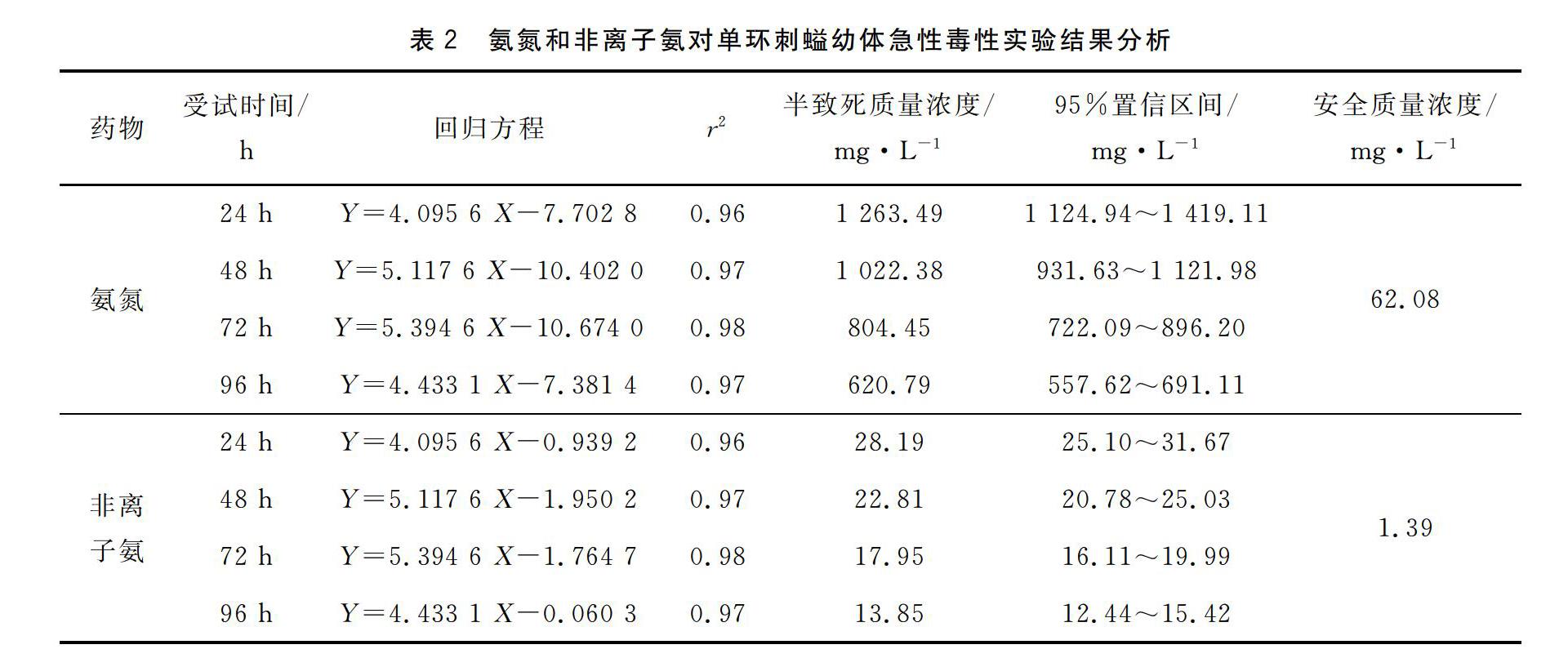

摘 要:在水温15.1~17.3 ℃,pH 7.88~8.15,盐度32.17‰~32.28‰,溶解氧6.40~7.40 mg/L的条件下,采用半静水法研究了氨氮和亚硝酸盐对体质量(2.86±0.43)g的单环刺螠(Urechis unicinctus)幼体的急性毒性效应。试验结果表明,单环刺螠幼体中毒后体色变暗,对外界刺激变得不敏感,最后身体缩成一团或细线状。随着氨氮和亚硝酸盐质量浓度升高死亡率逐渐升高,存在明显的剂量效应和时间效应。氨氮对单环刺螠幼体96 h半致死质量浓度分别为620.79 mg/L(95%置信区间557.62~691.11 mg/L),安全质量浓度为62.08 mg/L,对应非离子氨浓度为13.85 mg/L(95%置信区间12.44~15.42 mg/L),安全质量浓度为1.39 mg/L;亚硝酸盐对单环刺螠幼体96 h半致死质量浓度为243.90 mg/L(95%置信区间223.10~266.65 mg/L),安全质量浓度为24.39 mg/L。非离子氨对单环刺螠幼体毒性大于亚硝酸盐毒性。
关键词:单环刺螠(Urechis unicinctus);氨氮;亚硝酸盐;急性毒性实验
氨氮和亚硝酸盐是危害养殖生物生命安全的重要因素。氨氮胁迫对鱼类、虾类等多种水生动物的抗氧化酶活性有顯著影响[1-3],氨氮慢性毒性会影响大型溞(Daphnia magna)母溞的子代对毒物的敏感性[4]。海水鱼类一般通过肠上皮吸收亚硝酸盐,蓄积在体内对自身产生毒害作用[5],受低浓度亚硝酸盐胁迫的凡纳滨对虾(Litopenaeus vannamei)抗病能力下降,抗菌活力和溶菌活力显著下降[6]。
本文探究了单环刺螠幼体平均体质量(2.86±0.43)g时的氨氮和亚硝酸盐的耐受性及其安全浓度,为单环刺螠的工厂化养殖水环境的控制提供数据支持。
1 材料与方法
1.1 试验动物
单环刺螠取自大连市金普新区黄海沿海一养殖场,系野生亲本人工繁育,平均体重(2.86±0.43)g。试验前,单环刺螠暂养在底部铺细沙的塑料水槽内一周,使其适应实验室内环境,期间每天早上投喂一次藻粉,下午换水1/2体积,气石悬挂在水体中下层保持充氧。
1.2 试验用水
实验室用海水为自然海水经沉淀砂滤处理以后静置于储水池内,海水进入养殖间后在蓝色塑料水槽中充氧备用,盐度32.17‰~32.28‰,水温15.1~17.3 ℃,pH值7.88~8.15,溶解氧6.40~7.40 mg/L,氨氮0.010 5~0.043 3 mg/L,亚硝酸盐0.001 7~0.002 8 mg/L。
1.3 试验药品及溶液配制
试验用氯化铵和亚硝酸钠均采购自天津市科密欧化学试剂有限公司,为分析纯。实验前用蒸馏水分别配制成400 g/L氯化铵和200 g/L亚硝酸盐母液,试验开始时向养殖海水中添加不同体积的母液稀释到对应试验组设置浓度,添加母液体积不超过养殖水体的5‰。
1.4 试验方法
根据工厂化养殖水环境中可能存在的氨氮和亚硝酸盐浓度和参考文献[7-8],设置了预实验浓度范围分别为200~1 000 mg/L和400~1 263 mg/L。再根据预试验死亡率分布情况分别设置了6个氨氮和亚硝酸盐等对数距离质量浓度梯度,分别设置1个对照组,其中氨氮质量浓度梯度设置为:381、526、726、1 000、1 380、1 905 mg/L,亚硝酸盐质量浓度设置为:200、252、318、400、503、633 mg/L,每个质量浓度组分别设置3平行组。实验采用96 h半静水法,实验在3 L白色塑料小桶内进行,加入2.5 L试验用海水。然后加入试验用母液至所需梯度浓度。试验前一天,将单环刺螠从基质细沙中挑出,选择规格接近健康的单环刺螠幼体每桶20个,适应过夜后第二天加入母液开始试验。每隔24 h全量更换试验海水及相应药品,保持单环刺螠幼体在相应浓度下完成实验。
实验过程中,观察单环刺螠活力情况,每24 h观察记录幼体死亡数目,统计死亡率并及时捞出死亡个体。对于单环刺螠死亡的认定,幼体缩成一团或细线状,被触碰5 s后无任何反应记做死亡。试验进行过程不投喂。
1.5 数据处理
试验数据用excel 2010收集记录。然后采用机率单位法分别计算氨氮和亚硝酸盐氮对单环刺螠的半致死质量浓度和LC50的95%置信区间[9-10]。水体中非离子氨氮质量浓度由氨氮质量浓度换算得出。
安全质量浓度按下式计算:
安全质量浓度=0.1×96 h LC50
式中:LC50为半致死质量浓度。
2 结果与分析
2.1 中毒情况观察
单环刺螠幼体在不同浓度的氨氮和亚硝酸盐海水中身体行为反应差异不大。初入实验水体中,身体会伸缩翻转,之后会适应水环境,在水体底部缓慢蠕动,偶尔到水体中层,无激烈运动。中毒后的单环刺螠幼虫活力明显下降,体色变暗,对外界反应不敏感,触动后反应慢或无反应,接着肠容物排出体外,最后身体缩成一团或者呈细线状直至死亡。
2.2 氨氮对单环刺螠幼体的急性毒性效应
氨氮对单环刺螠幼体的急性毒性效应见表1、表2。由表1可知,随着试验药物质量浓度的提高和药物胁迫时间的延长,氨氮对单环刺螠幼体的急性毒性效应明显增强,死亡率明显升高。由表2可知,氨氮胁迫单环刺螠幼体24 h时半致死浓度为1 263.49 mg/L;当达到96 h时,半致死浓度为620.79 mg/L,仅为胁迫24 h的49.13%。对应氨氮浓度的非离子氨急性毒性效应规律一致。非离子氨对单环刺螠幼体急性毒性效应,当达到24 h时,半致死浓度为28.19 mg/L,当达到96 h时,半致死浓度为13.85 mg/L,仅为胁迫24 h的49.13%。这表明氨氮和非离子氨对单环刺螠幼体的致毒效应随着药物胁迫时间的延长而增加。
采用96 h半致死质量浓度乘以安全系数0.1,作为安全质量浓度,计算得到氨氮对单环刺螠幼体的安全质量浓度为62.08 mg/L,非离子氨氮对单环刺螠幼体的安全质量浓度为1.39 mg/L。
2.3 亚硝酸盐对单环刺螠的急性毒性效应
亚硝酸盐对单环刺螠幼体的急性毒性效应见表3、表4。由表3可知,随着试验药物质量浓度的提高和药物胁迫时间的延长,亚硝酸盐对单环刺螠幼体的急性毒性效应明显增强,死亡率明显升高。由表4可知,当达到24 h时,半致死浓度为419.98 mg/L,当达到96 h时,半致死浓度为243.90 mg/L,为胁迫24 h的58.07%。这表明亚硝酸盐对单环刺螠幼体的致毒效应随着药物胁迫时间的延长而增加。
采用96 h半致死质量浓度乘以安全系数0.1,作为安全质量浓度,计算得到亚硝酸盐对单环刺螠幼体的安全质量浓度为24.39 mg/L。
3 讨论
3.1 单环刺螠对氨氮毒性反应
养殖环境中氨氮有两大主要来源,一是含氮有机物的分解,如粪便和残饵的分解;二是水生动物代谢排出,鱼类代谢蛋白质排泄氨氮[11]。氨氮主要以非离子氨和离子氨两种形式存在,因温度和pH的不同影响两者互相转化的效率,其中非离子氨毒性远大于离子氨毒性[1]。非离子氨具有不带电荷、半径小、脂溶性强等特点,损害养殖生物的代谢和免疫系统,最终引起动物死亡[12]。养殖生物中一般规律,大个体较小个体对氨氮毒性耐受性强,因此研究生物幼体期氨氮的毒性效应可以作为该品种整个生活史养殖技术的参考数据。
当单环刺螠幼体受到氨氮胁迫后,活动减弱、体色变淡、慢慢缩成一团或线状,中毒严重直至死亡。较多的研究认为氨氮能降低鱼类载氧能力[13-14],降低甲壳类和软体动物的代谢活动[15-16]。龙虎斑(Epinephelus lanceolatus ♂ × Epinephelus fuscoguttatus ♀)[17]和斜带石斑鱼(Epinephelus coioides)[18]的研究中均发现,氨氮损伤了鳃组织,从而影响氧气的交换。墨吉明对虾(Fenneropenaeus merguiensis)的研究表明氨氮降低了对虾的免疫酶活性[19],菲律宾蛤仔(Ruditapes philippinarum)幼体受氨氮胁迫后畸形率、死亡率明显上升,生长性能下降[20]。对单环刺螠幼体氨氮中毒表现的观察,高浓度氨氮条件下对应非离子氨浓度也高,非离子氨易于通过细胞膜产生毒性效应[21],幼体体色变浅、活动减慢都是代谢活动受到影响。
非离子氨对生物的毒性受多个因素影响,如生物种类大小[22]、水体溶氧[23]、盐度[24]和pH等。现阶段关于海洋生物非离子氨的急性毒性的研究多集中于幼体,在正常海水条件下其中刺参(Apostihopus japonicus)[25]、脊尾白虾(Exopalaemon carinicauda)[22]、墨吉明对虾[19]、偏顶蛤(Modiolus modiolus)[26]、西施舌(Coelomactra antiquata)[27]、龍虎斑[17]、暗纹东方鲀(Takifugu fasciatus)[11]和大黄鱼(Pseudosciaena crocea)[28]的96 h半致死质量浓度分别为7.99、2.57、3.25、14.06、0.903、1.24、0.46和0.015 mg/L。本试验中,非离子氨对单环刺螠幼体96 h半致死质量浓度为13.85 mg/L,仅与偏顶蛤96 h半致死质量浓度浓度接近,远高于其它生物,说明单环刺螠幼体对非离子氨有着较强的耐受性。
3.2 单环刺螠对亚硝酸盐毒性反应
在集约化养殖环境中,亚硝酸盐主要是水环境中硝化作用和脱氮作用不平衡产生的。特别是当水体溶氧较低时,在硝化作用下水体中亚硝酸盐浓度会增加,危害养殖生物健康[29]。亚硝酸盐进入生物血液系统能降低载氧蛋白与氧的亲和力,是其毒性的主要体现,此外还会影响鱼类的免疫酶活性和神经系统等[30]。汪家鑫研究红鳍东方鲀(Takifugu rubripes)亚硝酸盐亚急性毒性的实验结果表明胁迫4周后的红鳍东方鲀肝脏抗氧化酶活性明显受到抑制[31]。有关墨吉明对虾的毒性研究发现受到胁迫的墨吉明对虾SOD活力受到抑制[32]。亚硝酸盐对银鲷(Sparus sarba)亚急性毒性试验表明对鱼体渗透压和热休克蛋白的表达有明显影响[33]。
单环刺螠亚硝酸盐急性毒性反应和氨氮的毒性反应表现结果类似。中毒状态的单环刺螠幼体血液载氧能力和基础代谢受到亚硝酸盐的影响,导致单环刺螠生理活动受到影响。
因为亚硝酸盐是硝酸盐和氨氮转换的中间产物,这个化学平衡受到水环境指标和消化细菌数量影响,不同生物种类大小对其耐受性也不相同。罗杰等[34]研究表明亚硝酸盐的毒性随pH和盐度降低对管角螺(Hemifusus tuba)稚贝毒害作用变大。氧气充足能提高大菱鲆(Scophthalmus maximus)对亚硝酸盐的耐受力[35]。在正常海水条件下,多个研究生物幼体亚硝酸盐急性毒性的实验结果,斜带石斑鱼[18]、红鳍东方鲀(Takifugu rubripes)[31]、花鲈(Lateolabax maculatus)[36]、龙虎斑[17]、大黄鱼[28]、偏顶蛤[26]、中华绒螯蟹(Eriocheir sinenisis)[15]和日本囊对虾(Marsupenaeus japonicus)[37]的96 h半致死质量浓度分别为208.4、159.25、58.62、90.41、50.06、54.20、52.69和427.39 mg/L。本试验中,单环刺螠幼体亚硝酸盐96 h半致死质量浓度为243.90 mg/L。其96 h半致死质量浓度与斜带石斑鱼接近,明显小于日本囊对虾,大于其它种类生物。说明单环刺螠对亚硝酸盐耐受性较好。
参考文献:
[1]
董玉波,王轲,王林同.氨氮对水生生物毒性的研究进展[J].天津水产(z1):6-11.
[2] 刘晓华,曹俊明,杨大伟,等.氨氮胁迫前后凡纳滨对虾组织中抗氧化酶和脂质过氧化产物的分布[J].水利渔业,2007,27(6):24-26.
[3] 张云龙,张海龙,王凌宇,等.氨氮对鱼类毒性的影响因子及气呼吸型鱼类耐氨策略[J].水生生物学报,2017,41(5):1157-1168.
[4] 赵志刚,张志生,程杰,等.大型溞母溞暴露于氨氮所产子代对氨氮毒性的耐受性[J].环境科学研究,2011,24(2):85-89.
[5] 高明辉,马立保,葛立安,等.亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素[J].南方水产科学,2008,4(4):73-79.
[6] 黄翔鹄,李长玲,郑莲,等.亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响[J].水生生物学报,2006,30(4):466-471.
[7] 王爱敏,冯俊荣,杨秀兰.氨氮及盐度对单环刺螠耗氧率的影响研究[J].齐鲁渔业,2009(05):1-4.
[8] 郑岩,白海娟,王亚平.单环刺螠对水温、盐度和pH的耐受性的研究[J].水产科学,2006,25(10):30-33.
[9] 环境保护部.水质 物质对淡水鱼(斑马鱼)急性毒性测定方法:GB/T 13267-1991 [S].北京:中国标准出版社,1991.
[10] 全国海洋标准化技术委员会.海洋监测规范 第7部分:近海污染生态调查和生物监测:GB/T 17378.7-2007 [S].北京:中国标准出版社,2007.
[11] 孙侦龙,朱永祥,刘大勇,等.非离子氨氮和亚硝酸盐氮对暗纹东方鲀稚鱼的急性毒性试验[J].水产科学,2015,34(3):135-139.
[12] Ren Q ,Li M ,Yuan L ,et al.Acute ammonia toxicity in crucian carp Carassius auratus and effects of taurine on hyperammonemia[J].Comp biochem physiol c toxicol pharmacol,2016(190):9-14.
[13] 付莹,赵玉蓉.氨氮对鱼类的毒性及鱼类应对氨氮毒性的策略[J].水产学杂志,2018,31(3):49-54.
[14] Bucking C .A broader look at ammonia production,excretion,and transport in fish: a review of impacts of feeding and the environment[J].Journal of Comparative Physiology B,2016,187(1):1-18.
[15] 王煜恒,李庆,陈军,等.不同溶氧浓度下非离子氨和亚硝酸盐对中华绒螯蟹的急性毒性[J].水产学杂志,2019(4):38-44.
[16] 陈金凤.氨氮对文蛤能量收支的影响及其毒理效应的研究[D].苏州:苏州大学,2010.
[17]曹伏君,陈思,梁華芳,等.氨氮和亚硝酸盐对龙虎斑的急性毒性研究[J].水产科技情报,2018,45(5):259-262.
[18] 郑乐云.氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J].海洋科学,2012,36(5):81-86.
[19] 钱佳慧,栗志民,刘建勇,等.氨氮对墨吉明对虾的急性毒性及对其免疫因子的影响[J].应用海洋学学报,2016,35(2):211-216.
[20] 韩天坤,杨凤,贾甲,等.总氨态氮对菲律宾蛤仔早期生长发育的影响[J].大连海洋大学学报,2018,33(2): 210-216.
[21] 黄鹤忠,李义,宋学宏,等.氨氮胁迫对中华绒螯蟹(Eriocheir sinensis) 免疫功能的影响[J].海洋与湖沼,2006,37(3):198-205.
[22] 梁俊平,李健,李吉涛,等.氨氮对脊尾白虾幼虾和成虾的毒性试验[J].水产科学,2012,31(9):526-529.
[23] 王娟,曲克明,刘海英,等.不同溶氧条件下亚硝酸盐和氨氮对中国对虾的急性毒性效应[J].海洋水产研究,2007,28(6):1-6.
[24] Boardman G D ,Starbuck S M ,Hudgins D B ,et al.Toxicity of ammonia to three marine fish and three marine invertebrates[J].Environmental Toxicology,2004,19(2):134-142.
[25] 程龙,宋坚,何舟,等.氨氮对刺参幼参的急性毒性研究[J].安徽农业科学,2013,41(33):12933-12934.
[26] 张晓森,宁军号,常亚青,等.氨氮和亚硝酸氮对偏顶蛤的急性毒性研究[J].安徽农业科学,2016,44(8):115-117.
[27] 吴进锋,陈素文,陈利雄,等.硫化物和氨对西施舌幼贝的毒性影响研究[J].热带海洋学报,2006,25(1):42-46.
[28] 阮成旭,袁重桂,吴德峰,等.氨氮和亚硝态氮对大黄鱼幼鱼的急性毒性效应[J].福州大学学报:自然科学版,2014,42(2):333-336.
[29] 董玉波,戴媛媛.亚硝酸盐氮对水产经济动物毒性影响的研究概况[J].水产养殖,2011,32(4):28-32.
[30] Pamenter M E,Skelton G,Duquette S,et al.The relationship between NMDA receptor function and the high ammonia tolerance of anoxia-tolerant goldfish.[J].The Journal of Experimental Biology,2011,214(24):4107-4120.
[31] 汪家鑫,張钊,胡盼,等.亚硝酸氮对红鳍东方鲀的毒性效应[J].广东海洋大学学报,2013,33(6):52-56.
[32] 栗志民,钱佳慧,刘建勇,等.亚硝酸盐对墨吉明对虾的毒性及其免疫因子的影响[J].安徽农业科学,2015,43(21):160-163.
[33] Deane E E,Woo N Y.Impact of nitrite exposure on endocrine,osmoregulatory and cytoprotective functions in the marine teleost Sparus sarba[J].Aquatic Toxicology,2007,82(2):85-93.
[34] 罗杰,陈加辉,刘楚吾.管角螺稚贝对亚硝酸盐耐受力研究[J].南方水产科学,2011,07(2):42-48.
[35] 曲克明,徐勇,马绍赛,等.不同溶解氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应[J].海洋水产研究,2007,28(4):83-88.
[36] 韩枫,黄杰斯,温海深,等.不同盐度条件下亚硝酸态氮与非离子氨对花鲈幼鱼的毒性实验[J].海洋科学,2016,40(10):8-15.
[37] 陈亭君,刘建勇,申玉春,等.亚硝酸盐氮对日本囊对虾幼虾的急性毒性研究[J].渔业现代化,2019,46(3):35-40.
Acute toxicity test of ammonia nitrogen and nitrite on Urechis Unicinctus larva
ZHANG Saisai,SONG Xiaoyang,SHANG Hongxin,SUN Yang,ZHOU Zhujun,YANG Tingting,TIAN Bin,SONG Luojia,CHEN Wenbo,LIU Tong
(1.Dalian Modern Agricultural Production Development Service Center,Dalian 116023,China;2.College of Biological Science and Technology,Shenyang Agricultural University,Shenyang 110866,China)
Abstract:Under the conditions of water temperature 15.1~17.3 ℃,pH 7.88~8.15,salinity 32.17‰~32.28‰,and dissolved oxygen 6.40~7.40 mg/L,the method of half static water was adopted to study the acute toxicity effects of ammonia nitrogen and nitrite on Urechis unicinctus larva with a body mass of (2.86+0.43)g.Test results showed that after being poisoned,
the Urechis unicinctus larva got a darker body color and became less sensitive to external stimuli,eventually huddling itself into a ball or a fine line.With the increase of the mass concentration of ammonia nitrogen and nitrite,the lethality rate gradually increased,so it was apparent that there existed a dose effect and a time effect.As for the effects of ammonia nitrogen on the Urechis unicinctus larva,the 96 h lethal concentration 50 (LC50) was 620.79 mg/L(95% confidence interval 557.62~691.11 mg/L) with a safety mass concentration of 62.08 mg/L,the corresponding non-ionic ammonia concentration was 13.85 mg/L (95% confidence interval 12.44~15.42 mg/L) with a safety mass concentration of 1.39 mg/L; as for the effects of nitrite on the Urechis unicinctus larva,the 96 h LC50 was 243.90 mg/L (95% confidence interval 223.10~266.65 mg/L) with a safety mass concentration of 24.39 mg/L.Non-ionic ammonia is more toxic to the Urechis unicinctus larva than nitrite.
Key words:Urechis unicinctus; ammonia nitrogen; nitrite; acute toxicity test
(收稿日期:2020-06-28)

