高通量测序分析新生儿感染早产儿肠道菌群特点
孙倩,姜春明
(哈尔滨医科大学附属第一医院新生儿重症监护二科,哈尔滨 150001)
肠道是新生儿出生后菌群定植的主要场所,微生物的种类、分属、数量及相对丰度等的动态平衡,在保证婴幼儿生长发育、促进免疫系统发育成熟、参与体内物质代谢等方面起重要作用。近年来有研究表明,婴幼儿所患疾病(感染性疾病、呼吸道疾病等)与肠道微生态的失衡有密切联系[1]。新生儿期是肠道微生物群落建立的关键阶段,在某些特定条件下,如机体抵抗力下降、过度使用广谱抗生素等,肠道内的次要菌群在肠道内大量繁殖,转变为肠道内的新优势菌群,使得肠道稳态失衡从而致病[2]。肠道微生态的生物学功能主要是保持肠道的正常生理结构及相关功能,避免致病微生物的入侵及定植,调节人体的免疫系统发挥功能[3]。而影响新生儿肠道菌群定植的因素主要包括胎龄、分娩方式、喂养方式等。当肠道微生态失衡时,其表现的致病性包括:①导致自身感染或原定植细菌转移到其他部位而诱发感染;②导致胃肠道功能紊乱,表现为排便困难、腹泻等;③导致或参与某些肠道器质性病变(如坏死性小肠结肠炎)的发病[4]。因此,深入研究新生儿肠道微生态的动态变化,可针对性调整肠道内的定植菌群,有效降低新生儿感染的发病率[2]。本研究通过高通量测序分析方法对早产儿粪便样本中所有细菌进行DNA测序,研究早产儿肠道微生态的分布特征,分析患有新生儿感染早产儿的肠道菌群特点。
1 资料与方法
1.1一般资料 选取2017年8月至2018年12月在哈尔滨医科大学附属第一医院产科分娩且符合入组标准的26例早产儿作为研究对象,患儿出生后均在本院新生儿重症监护病房住院治疗。新生儿感染标准:①出生7 d出现气促、发绀、三凹征等临床表现。②出生7 d后血常规示白细胞计数<5×109/L,或>20×109/L;血小板计数<100×109/L;血清降钙素原>2.0 μg/L等。③临床症状为皮肤发花、四肢末梢凉、拒乳、发热、腹胀、黄疸进行性加重等,但血培养为阴性。④血培养为阳性。按照是否感染将患儿分为新生儿感染组(12例)和未感染组(14例)。
1.2纳入与排除标准 纳入标准:①早产儿,胎龄为30~37周;②均为剖宫产;③出生体重为1 000~3 000 g;④住院时间超过7 d;⑤均为人工喂养;⑥收集标本前均未给予抗生素及益生菌。排除标准:①排除患严重消化道畸形、遗传代谢病及重度窒息的早产儿;②排除母亲孕期患有宫内感染、给予抗生素治疗的早产儿。
1.3试验方法 分别于出生后第1天(即24 h内)和出生后第7天收集患儿粪便。采集样本时要留取早产儿粪便的中部,每份标本重量≥200 mg,将样本装入无菌的EP管中,并立即放入液氮中进行冻存。
利用美国丹诺尔Denovix超微量紫外可见分光光度计DS-11和适当浓度凝胶电泳对早产儿粪便中的微生物DNA做总质检。选择特定16S核糖体DNA为扩增片段,合成具有特异性的引物。用稀释后的DNA序列作为模板,使用Taq DNA多聚酶进行聚合酶链反应,选用适当浓度的凝胶进行电泳检测聚合酶链反应,其产物利用Denovix超微量紫外可见分光光度计DS-11和凝胶电泳进行相应文库质检[5]。
检验合格后,使用荧光定量系统对文库进行定量,并依据每个样本的数量要求,进一步做对应要求的混合。使用美国Illumina公司的HiSeq PE2500测序平台进行上机测序[6]。由上海锐翌基因科技有限公司完成相应样本提取、建库、测序、分析。
1.4生物信息学分析
1.4.1测序数据统计 对原始数据进行过滤、链接和去嵌合体处理,得到的有效序列按照97%相似度进行归类,得到操作分类单元(operational taxonomical unit,OTU),每个OTU对应一个不同的细菌(微生物)种群。然后对每个样本的序列数据进行处理,进一步提取相应的OTU序列。对每个OTU序列进行种群相应的分类,依据每个分类单元中序列的数目,获得相应的丰度表,最终依据该丰度表进行后续相应数据分析[7]。
1.4.2物种分类和丰度分析 依据物种归类的结果,分别在各分类等级(门、纲、目、科、属)对各个样本做种群相对丰度图,可直接查看在每一等级上,物种的相对丰度及所占比例。
1.4.3物种多样性分析 运用Beta多样性分析,利用各样本序列间的丰度信息来计算样本间距离,从而反映组间是否具有显著的微生物群落差异。采用多响应置换过程(multi-response permutation procedure,MRPP)分析组间菌群组成的差异性,P<0.05 为差异有统计学意义。MRPP分析包括加权与非加权两种:非加权时,不考虑物种的丰度进行加权处理,会扩大或缩小物种丰度的差异;而加权统计后,考虑了物种的丰度,保留了物种原始丰度特征,对低丰度菌群反映更好。
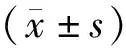
2 结 果
2.1一般情况 26例早产儿共收集52份粪便样本,成功提取DNA并完成测序25份,将标本信息纳入生物信息分析。进入测序分析的两组早产儿的胎龄、出生体重比较差异无统计学意义(P>0.05),见表1。

表1 两组早产儿的胎龄和出生体重比较
2.2测序数据结果和OUT统计 本次测序得到的有效序列总数为828 388,总碱基数为351 852 086 bp,平均长度为424.35 bp,其中长度为420~440 bp的优质序列占总序列的92.68%。25个标本共得到79个OTU,说明本次测序的深度足够,测序所得数据量合理。
2.3物种多样性的分析
2.3.1单个样品的菌群分类及相对丰度 共测得门水平6个、纲水平12个、目水平17个、科水平29个、属水平40个,菌群种类共40个。丰度较高的菌群包括门水平为变形菌门、拟杆菌门、厚壁菌门、放线菌门,纲水平为γ-变形菌纲、拟杆菌纲、杆菌纲、梭菌纲、放线菌,目水平为肠杆菌目、拟杆菌目、乳酸杆菌,科水平为肠杆菌科、拟杆菌科、紫单胞菌科、肠球菌科、消化链球菌科,属水平为克雷伯杆菌属、埃希杆菌属/志贺杆菌属、拟杆菌属、副杆菌属、肠球菌属,见图1~5。
2.3.2早产儿生后第7天肠道菌群对新生儿感染情况的影响 运用物种MRPP分析提示,新生儿感染组与非感染组的肠道微生物群落结构差异有统计学意义(P<0.05),见表2。
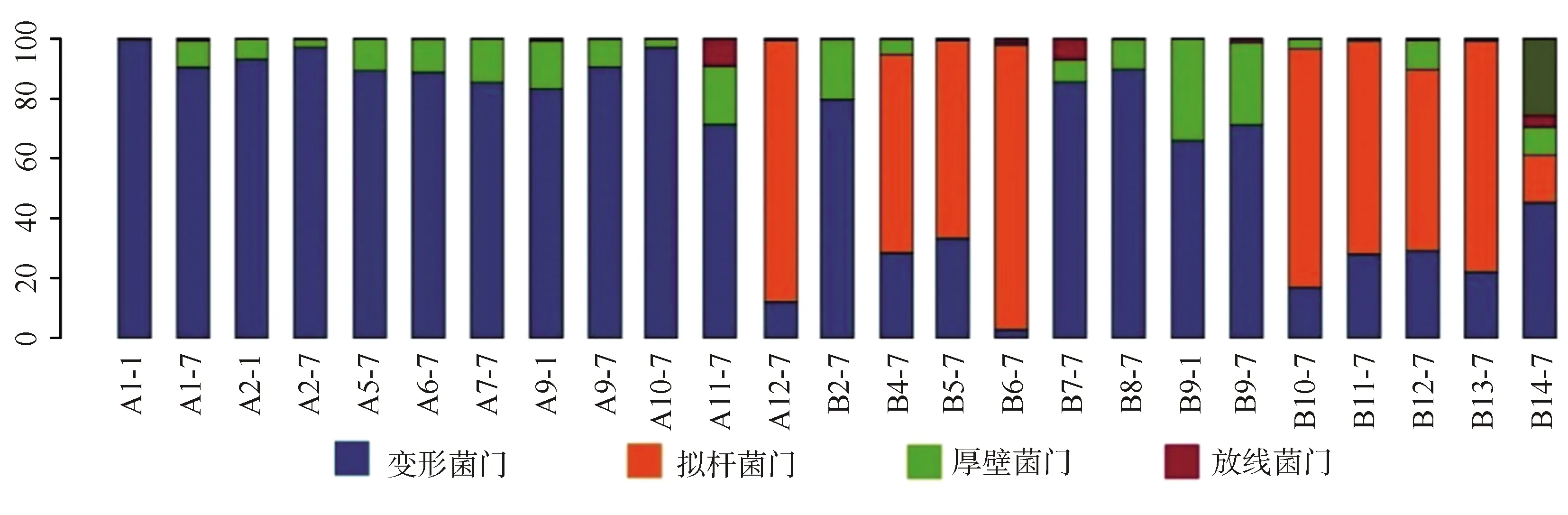
A:感染组;B:非感染组

A:感染组;B:非感染组

A:感染组;B:非感染组
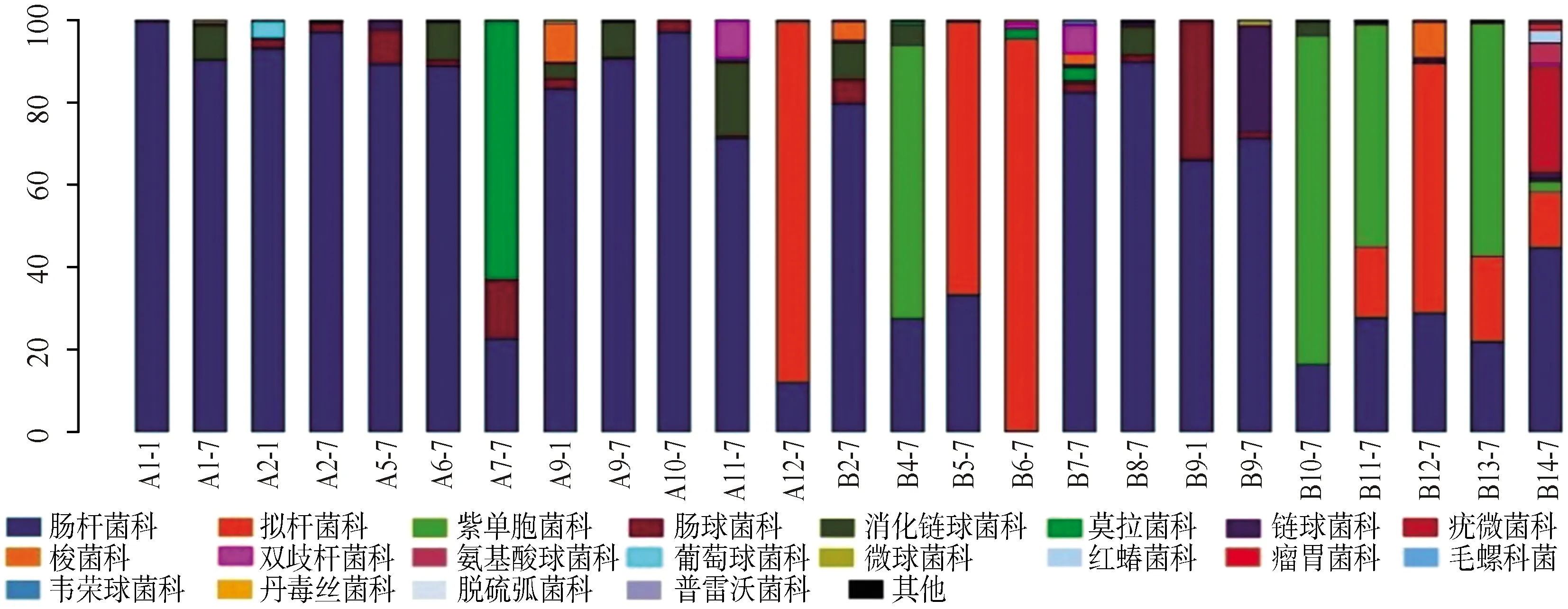
A:感染组;B:非感染组
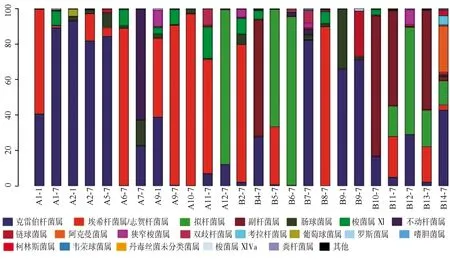
A:感染组;B:非感染组

表2 两组早产儿的MRPP差异比较
3 讨 论
新生儿肠道微生态动态平衡是维持新生儿正常生长发育的重要因素,影响新生儿肠道菌群分布的因素较多,主要包括胎龄、分娩方式、喂养方式、新生儿抗生素使用情况等。当肠道微生物群失衡时,极易诱发新生儿感染性疾病,常见的有宫内感染、败血症、坏死性小肠结肠炎等。
有研究表明,母乳喂养以双歧杆菌、乳酸杆菌为优势菌群,且可以为有益菌群的定植提供合适的环境[8];阴道分娩的胎儿肠道菌群多样性较高,且无定植延迟,较少发生肠道菌群失调并引发感染性疾病[9]。因此,本研究选取剖宫产出生、人工喂养的早产儿作为研究对象,以减少分娩方式及喂养方式对肠道菌群的影响。本研究共收集了52份新生儿粪便样本,DNA提取失败共27份,其中22份出生后第1天及5份出生后第7天粪便标本因浓度过低未提取成功。由于新生儿出生时肠道内接近无菌状态,出生后才逐渐获得各种菌群定植,所以本研究中患儿生后第1天粪便样本DNA提取成功率较低。既往研究表明,胎龄是新生儿肠道微生态形成的影响因素,早产儿身体各器官发育均不成熟,抵抗力与适应性差,故出生体重越轻,胎龄越小,肠道成熟度越低,肠道菌群的丰富度及多样性越差,各种感染的发生率越高[10]。本研究对象是胎龄为30+2~36+3周,平均胎龄为34 周的早产儿,因此粪便的微生物含量可能较低,影响DNA的提取。
本研究将提取成功的25份样本的基因进入测序程序,由Alpha稀释曲线可知,每一份样本的曲线均随Reads数目的增加而趋于平坦,所以本试验测序深度足够,且测序数据量比较合理。本研究测得的早产儿早期肠道菌群,按细菌分类表分类包括门水平6个、纲水平12个、目水平17个、科水平29个、属水平40个。研究表明,由于早产儿胃肠道在宫内发育不成熟、出生后肠道由宫内的低氧环境转为宫外富氧环境、肠道抗氧化系统未成熟等,早产儿的肠道微生态形成延迟,所以其丰度较足月新生儿明显降低[11]。
本研究对感染与非感染状态下早产儿生后第7天的肠道菌群分布进行比较,其中新生儿感染组共测得门水平4个、纲水平6个、目水平10个、科水平13个、属水平35个,未感染组共测得门水平5个、纲水平10个、目水平14个、科水平28个、属水平40个,未感染组肠道菌群的丰富度明显高于新生儿感染组。经MRPP组间差异分析,两组细菌物种的组成差异有统计学意义。通过主坐标分析对各样品菌种的相对丰度进行分析发现,与新生儿感染组相比,未感染组的新生儿肠道菌群相对丰度更高,肠道微生态多样性更加丰富。
本研究结果显示,新生儿感染组的肠道菌群主要分布如下:门水平为变形菌门,纲水平为γ-变形菌纲、杆菌纲,目水平为肠杆菌目、梭菌目,科水平为肠杆菌科、肠球菌科,属水平为克雷伯杆菌属、大肠埃希菌属/志贺菌属及拟杆菌属;未感染组的肠道菌群主要分布如下:门水平为拟杆菌门、变形菌门,纲水平为γ-变形菌纲、拟杆菌纲、杆菌纲,目水平为肠杆菌目、拟杆菌目、乳酸杆菌目,科水平为肠杆菌科、拟杆菌科、紫单胞菌科,属水平为克雷伯杆菌属、大肠埃希菌属/志贺菌属、拟杆菌属、副杆菌属。可见,新生儿感染组菌群分布范围较小、菌种含量较少、变形杆菌丰度较高;而未感染组的菌群分布更为广泛、多样性较高、更有均一性。但是菌群多样性过高同样也会增加条件致病菌的致病机会,所以恰当的菌群多样性才可以对宿主起保护作用[12]。
新生儿感染可发生在三个阶段:①出生前感染,可发生于妊娠期各阶段,最常见的途径为病原菌经母亲血流通过胎盘感染胎儿,又称宫内感染;②出生时感染,剖宫产、胎膜早破、产程延长等均可导致胎儿感染;③出生后感染,较上述两种感染更为常见。病原体通过呼吸道、消化道等途径传播,导致新生儿败血症、新生儿感染性肺炎等。而新生儿肠道微生态的建立是一个缓慢发展的动态演变过程,直至2周岁时才逐渐趋于稳定,且与正常成人的肠道微生态相似[13]。针对早产儿细菌培养的研究已发现,早产儿肠道细菌定植延迟,其潜在条件致病菌的优势菌群包括肠杆菌、拟杆菌及已知病原体(梭菌、葡萄球菌、假单胞菌和克雷伯菌)[14]。早产儿肠黏膜屏障功能并不成熟,造成肠壁通透性增加,故可能导致肠道微生态中的病毒、细菌和内毒素进入肠黏膜上皮细胞,造成肠道感染,甚至可以穿过肠壁进入血液、器官或组织,造成全身感染[15]。
感染发生及其严重程度与致病微生物的毒性有极大关系。感染是否发生,一方面依据细菌的数量、感染方式、毒力等,另一方面与机体当时的免疫状态也有极大关系。有研究表明,肠道内肠杆菌科的大肠埃希菌可以在极低水平时造成感染,当其内部的Rcs系统启动时,细菌对宿主细胞的侵袭力增强,致使感染加重;同属肠杆菌科的克雷伯杆菌亦是如此,菌内的Rcs系统启动使得荚膜多糖合成,进而产生高毒力,易导致败血症、传染病鼠疫、肺炎等感染性疾病的发生[16]。所以,当肠道内定植大量变形杆菌(肠杆菌)时,条件致病菌群的相对丰度增加,可造成肠道微生态失衡,易诱发新生儿感染。当肠道内微生物多样性增加时,致病菌的相对丰度就会降低,且与其他菌群形成相对稳态,降低了感染性疾病的发生率。此外,包含败血症和全身炎症反应综合征在内的严重新生儿感染均与微生物定植-宿主相互作用有关。有研究表明,新生儿败血症可能是由肠黏膜防御功能低下,通透性高,肠道细菌移位侵入血液循环引起[17-19]。由于早产儿开奶延迟或不能母乳喂养,双歧杆菌、乳酸杆菌、拟杆菌等益生菌无法在肠道内正常定植,进而导致病原菌在肠道内定植或作为优势菌群在肠道内进行大量繁殖,侵袭肠道,引起肠黏膜损伤,最终导致坏死性小肠结肠炎[20]。
本研究结果显示,肠道内定植大量变形杆菌(肠杆菌),增加了菌群的相对丰度,由次要菌群变为优势菌群,同时降低了有益菌群的相对丰度,造成肠道生理稳态的失调,极易诱发新生儿感染。当肠道定植菌群的多样性增加时,可以维持肠道菌群的动态平衡,促进了免疫系统的建立和成熟,降低新生儿尤其是早产儿感染性疾病的发生率。
综上所述,关于新生儿感染时早产儿肠道菌群的分布仍需大量试验验证,目前肠道微生态与新生儿疾病的关系已成为研究热点。随着试验技术及设备的不断进步,基因库的不断完善,新生儿肠道微生物群落的变化在新生儿感染性疾病发生中所起的作用将得到充分证实,同时肠道微生态也会对新生儿相关疾病的早期诊断和治疗起到一定作用,极大改善新生儿,尤其是早产儿感染性疾病的预后并对远期生长发育产生影响。

