STAT3和STAT5基因多态性与四川地区老年风湿性心脏病的相关研究
张红玉 阳国兴 孙 颖
风湿性心脏病是常见的自免性疾病[1],是甲组乙型溶血性链球菌感染所引起变态反应的部分表现,其病理变化主要发生在心脏瓣膜,二尖瓣是最常见受累部位,随着病程进展会出现心脏钙化及瓣叶增厚。临床上常见的瓣膜病变主要有二尖瓣关闭不全、主动脉瓣狭窄、三尖瓣狭窄、三尖瓣关闭不全以及联合瓣膜病变等,瓣膜病变发展到一定阶段引发心衰,严重影响患者的生活质量[2]。风湿性心脏病是全球性疾病,患病率约(2.5~3.2)/1000人[3]。在老年风湿性心脏病人群中更易发生瓣膜病变,从而增加患者心衰甚至死亡风险。研究表明信号转导和转录激活因子3(STAT3)基因以及信号转导和转录激活因子5(STAT5)基因多态性与老年风湿性心脏病易感性密切相关[4],目前国内相关研究较少。本研究通过等位基因特异性扩增法研究四川地区老年风湿性心脏病患者发病与STAT3基因多态性位点rs4796793及STAT5基因多态性位点rs6503691的临床相关性,从DNA分子水平探讨老年风湿性心脏病发病机制。
1.资料与方法
1.1 一般资料 受试对象为2017年9月至2019年8月四川省人民医院及成都市武侯区第三人民医院住院的风湿性心脏病患者(病例组)及非风湿性心脏病患者(对照组)。病例组97例,男性37例,女性60例,年龄61~90岁,平均(65.72±5.78)岁。纳入标准:①甲组乙型溶血性链球菌感染病史;②临床表现有瓣膜病变或心衰症状体征;③多普勒超声心动图提示风心病。排除标准:①除本病外的其他心脏基础疾病;②除风湿热、风心病外的其他自身免疫病;③遗传性疾病。对照组共收集150例,为上述医院排除心脏病、遗传性疾病及自身免疫性疾病的人群,男性67例,女性83例,年龄62~90岁,平均(66.46±5.85)岁。本研究通过医院伦理委员会审查,入组患者或家属签署知情同意书。
1.2 方法
1.2.1 DNA提取:抽取受试者外周静脉血4ml,采用盐析法提取核DNA,Solution I加入血液中,12000rpm离心5分钟,小心去除管中液,沿内壁加Solution Ⅱ后再次离心,加入Solution Ⅲ轻微振荡,离心后将上清液转移至新离心管,加入等体积异丙醇,离心去上清,加入75%酒精沉淀后再次离心去上清液,最后加入双蒸水完成DNA提取。
1.2.2 ARMS-PCR:NCBI数据库检索多态性位点rs4796793及rs6503691DNA序列,在线设计引物并由礼来生物公司协助合成。两条引物在3’端核苷酸不同,分别对野生型等位基因及突变型等位基因特异,在Taq酶作用下,与模板匹配的引物体系扩增出产物,最后通过凝胶电泳分辨特异性产物。
1.3 统计学方法 Hardy Weinberg平衡分析采用Haploview v4.2软件进行分析,整体实验数据分析使用SPSS 17.0软件,使用χ2或非参数检验分析组间多态性位点的分布差异。P<0.05时为差异具有统计学意义。
2.结果
2.1 两组间基线数据比较 临床资料表示,风湿性心脏病组年龄61~90岁,平均(65.72±5.78)岁,男女比例37:60,对照组年龄62~90岁,平均(66.46±5.85)岁,男女比例67:83,实验组与对照组间受试对象的年龄及性别无统计学差异(P>0.05),提示本研究中组间可比性好,见表1。
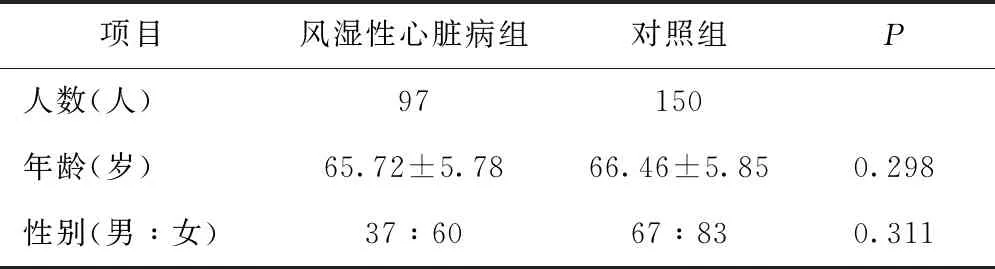
表1 临床基线资料的组间比较
2.2 两组间STAT3基因多态性的比较 STAT3基因的SNP位点rs4796793已通过哈迪-温伯格遗传平衡检验。统计结果显示位点rs4796793基因型分布及等位基因频率在两组间具有统计学显著差异(P<0.05),其中CC基因型频率分别是42.26%和28.67%,CG基因型的频率分别是49.48%和54.00%,GG基因型的频率分别为8.25%和17.33%;等位基因C频率分别为67.01%和56.67%,等位基因C的频率分布为32.99%和43.33%,见表2。
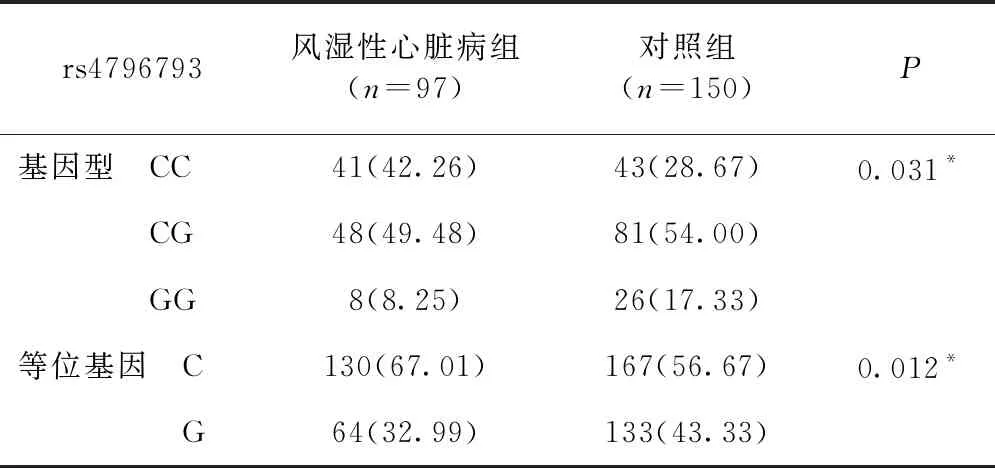
表2 STAT基因SNP位点变异组间比较[例(%)]
2.3 两组间STAT5基因多态性的比较 STAT5基因的SNP位点rs6503691基因型分布在风湿性心脏病组和对照组间差异有统计学意义(P<0.05),其中CC基因型在两组中的频率分别是47.42%和26.00%,CT基因型的频率分别是37.11%和36.00%,TT基因型的频率分别为15.46%和23.33%。此外,该SNP位点等位基因频率(P=0.001)具有显著的统计学差异,其中C等位基因频率分别为65.98%和51.33%,T等位基因频率分布为34.02%和48.67%,见表3。
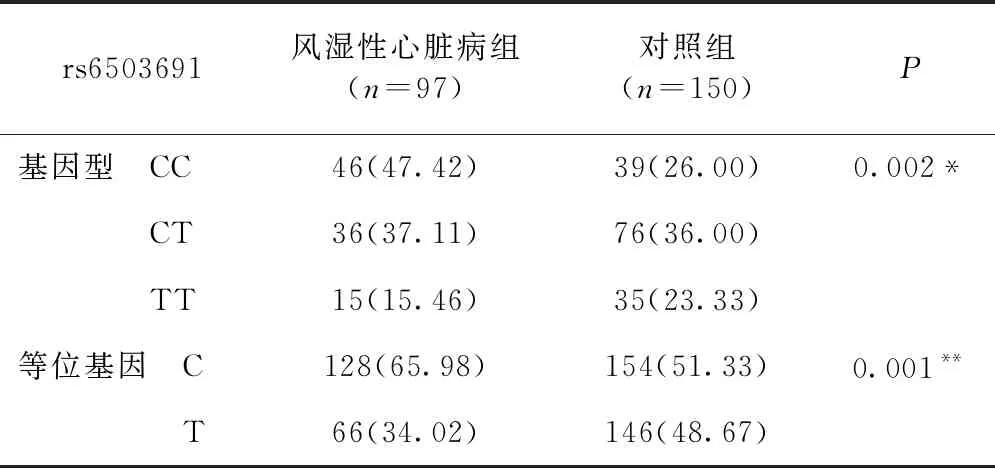
表3 STAT5基因SNP位点改变组间对比[例(%)]
3.讨论
风湿性心脏病是链球菌感染后引发的炎症性自身免疫性疾病,主要特征是抗体针对自身组织不正确的免疫反应。这种免疫反应主要对心脏瓣膜造成损害,导致瓣膜关闭不全或者狭窄,随着患者年龄增大,心脏病变加重,最终引发心衰,增加患者死亡风险。老年风湿性心脏病具有更危重的临床表现,更高的死亡率。因此针对老年风湿性心脏病病因学的研究亟待发展。目前研究表明细胞因子在调节免疫和炎症中起关键作用,众多遗传学研究发现与炎症相关的细胞因子基因如信号转导因子、白介素-4、白介素-6及白介素-10等基因均参与老年风湿性心脏病发生、发展及影响该疾病的严重程度[5~8]。信号转导和转录激活因子STAT(包括STAT 1~6)是细胞因子调节信号的细胞内效应分子,在人类免疫系统和造血功能的发展中发挥重要作用,并参与T细胞存活的调节。研究表明STAT3及STAT5基因的单核苷酸多态性改变赋予了风湿性心脏病发病的风险[4],但基因多态性对疾病的影响通常具有地域差异性,我国目前关于STAT基因与风湿性心脏病发病的相关研究较少,因此本研究通过研究四川地区老年风湿性心脏病人群与健康老年人中变异位点s4796793和rs6503691的组间差异,进一步分析本地区位点s4796793和rs6503691变异对老年风湿性心脏病发病、进展及严重程度的影响。
信号转导和转录激活因子(STAT)是抗炎细胞因子,信号转导与转录激活因子包括STAT1~6,STAT信号改变在炎症性疾病中促炎与抗炎细胞因子之间的平衡中起着重要作用。研究表明这一系列信号转导和转录激活因子可在心脏组织中检出,包括内皮细胞及心肌细胞等[9,10]。众多研究表明STAT1~6的基因多态性与多种疾病有关,如肠道克罗恩病、胰腺癌、淋巴瘤、直肠癌等[11~14]。搜索NCBI数据库STAT3多态性位点rs4796793位于STAT3基因5’端,STAT5多态性位点rs6503691位于STAT5b基因外显子1上。Ito等人研究发现STAT3基因多态性位点rs4796793的次要等位基因会降低STAT3的蛋白表达,低表达的STAT3会逐渐引发心脏瓣膜的损失[15]。Peng等人发现在中国汉族人群STAT5多态性位点rs6503691显著增加扩张性心肌病的发病风险,而STAT3多态性位点rs4796793与扩心病发病无关[16]。Gaupta等人研究发现STAT3多态性位点rs4796793及STAT5多态性位点rs6503691与风湿性心脏病的致病性相关,但这两个位点变异与风湿性心脏病严重程度无关[17]。我们的研究同上述研究结果一致,SNP位点rs4796793与rs6503691的基因型与等位基因分布在风湿性心脏病组与对照组间的差异,提示在四川老年人群上述两个SNP位点也与风湿性心脏病的发病有密切关系。虽在整体上均与风湿性心脏病易感性有关,但具体的基因型与等位基因比例仍与国外研究有差异,提示SNP位点分布存在地域与种群的差异。
综上,SNP位点rs4796793与rs6503691可能为中国老年风湿性心脏病患者的易感基因位点。但本研究中受试者分为风湿性心脏病组与对照组,对与疾病严重程度与多态性位点之间的关系尚缺乏进一步研究,后续我们应增加研究对象,并根据瓣膜受累程度及多少完善严重程度的相关分组,进一步研究STAT基因SNP位点在老年风湿性心脏病疾病中的作用,为老年风湿性心脏病的诊疗提供新的思路与途径。

