FUNDC1对高脂诱导的人血管内皮细胞的保护作用研究*
张 鹏,张年荣,谢紫洁,欧阳昌汉,余开湖**
(1.湖北科技学院,湖北 咸宁 437100;2.湖北科技学院附属第一医院放射介入科)
高脂血症是一种脂质代谢异常疾病,患者体内分解脂质的脂酶活性不足或相对不足,导致脂质堆积,继而发生脂代谢紊乱及血管损伤等一系列不良后果。在一项对35岁以上人群血脂异常患病率的调研中发现,血脂异常者高达34.7 %[1]。线粒体的脂肪酸氧化是人体内重要的生命活动,细胞中的活性氧(reactive oxygen species,ROS)也是由线粒体产生。受损线粒体产生的大量ROS是导致血管内皮细胞损伤的重要原因[2]。FUN14结构域蛋白1(FUN14 domain-containing protein 1,FUNDC1)是一种存在于线粒体外膜与内质网联结处的自噬受体蛋白[3],它通过与LC3-b相互作用介导线粒体自噬[4-5]。目前已有研究发现,在细胞缺氧的条件下,FUNDC1在线粒体内质网联结处积累,促进线粒体自噬的发生[6];线粒体质量与数目失调与线粒体自噬受体FUNDC1有着重要的关联[7]。
目前对FUNDC1在高脂诱导的血管内皮细胞中的作用研究还尚未见报道,本研究以腺病毒为载体,过表达EA.hy926人血管内皮细胞中的FUNDC1,再加入棕榈酸(palmitic acid,PA)建立高脂细胞模型,检测细胞活力值、细胞ROS含量、线粒体膜电位去极化情况、腺苷三磷酸(adenosine triphosphate,ATP)含量以及自噬相关蛋白表达情况来探讨FUNDC1在高脂诱导的血管内皮细胞中的作用。
1 材料与方法
1.1 材料与试剂
EA.hy926内皮细胞(中国科学院上海细胞库);FUNDC1腺病毒(维真生物);空载腺病毒(维真生物);棕榈酸(美国Sigma公司);FUNDC1抗体(北京博奥森生物);P62抗体(美国Cell Signaling Technology公司);LC3抗体(美国Cell Signaling Technology公司);GAPDH抗体(美国Cell Signaling Technology公司);HRP标记羊抗兔IgG(美国Jackson公司);cck8试剂盒(日本同仁);细胞活性氧检测试剂盒(上海碧云天生物);JC-1试剂盒(上海碧云天生物);ATP含量试剂盒(南京建成生物)。
1.2 仪器与设备
垂直电泳仪(美国Bio-Rad公司);自动发光凝胶成像系统(英国Syngene公司);超净工作台(苏州安泰空气技术公司);荧光显微镜(日本奥林巴斯);全波段多功能酶标仪(美国Bio-Tek公司)。
1.3 检测方法
1.3.1 不同浓度PA下细胞存活率
取对数生长期EA.hy926细胞,用0.25%胰蛋白酶消化,DMEM完全培养液调制成5×104个/mL细胞悬液,接种在96孔培养板内,每孔100μL。待细胞完全贴壁,换成不同浓度(0.1、0.15、0.2、0.25、0.3、0.5、0.7mmol/L)的PA培养,培养24h后,每孔加入cck8试剂10μL,继续孵育1~2h,酶标仪检测 450nm处各孔的OD值。实验重复3次。
1.3.2 细胞分组
实验分为4组,对照组:EA.hy926常规培养条件培养;高脂组:EA.hy926细胞常规培养48 h 后,将细胞培养基换成0.2mmol/L PA培养24h;高脂+空载组:转染空载腺病毒48h后,将细胞培养基换成0.2mmol/L PA培养24h;高脂+FUNDC1组:转染FUNDC1腺病毒48h后,将细胞培养基换成0.2mmol/L PA培养24h。
1.3.3 细胞活力检测
在方钢管柱两端各布置一个位移计1、2,以测量其竖向侧移;在梁端布置位移计3,以测量其水平侧移,用来校准作动器位移读数。由于连接节点的弯矩和转角在试验中不便直接测量,本试验采用测量目标位置点的竖向位移和测量梁端集中荷载并通过转换计算来求得节点的弯矩和转角。分别在悬臂抗剪腹板与外套筒腹板焊缝连接处、外套筒翼缘、角钢加劲肋、外套筒腹板、方钢管柱腹板于外套筒截面突变处、角钢梁侧钢肢、角钢柱侧钢肢以及梁翼缘与角钢变截面处布置了应变花以及应变片。
取对数生长期EA.hy926细胞,用0.25%胰蛋白酶消化,DMEM完全培养液调制成5×104个/mL细胞悬液,接种在96孔培养板内,每孔100μL。各组细胞相应处理后,每孔加入 cck8试剂10μL,继续孵育1~2h,酶标仪检测450nm处各孔的吸光度OD值。实验重复3次。
1.3.4 活性氧检测
取对数生长期EA.hy926细胞,用0.25%胰蛋白酶消化,接种于6孔板中。待细胞长至70%左右,各组细胞进行相应处理,吸除6孔板培养液,以1∶1000为比例,用无血清DMEM培养液稀释DCFH-DA,每孔加入1 ml已稀释的DCFH-DA溶液,37℃细胞培养箱内孵育30min,孵育结束后用无血清DMEM细胞培养液洗涤细胞3次,荧光显微镜下观察,随机取5个视野拍照。实验重复3次。
1.3.5 线粒体膜电位检测
取对数生长期EA.hy926细胞,用0.25%胰蛋白酶消化,接种于6孔板中。待细胞长至70%左右,各组细胞进行相应处理,吸除6孔板培养液,加入1mL JC-1染色工作液和1 mL DMEM培养基,充分混匀。细胞培养箱中37℃孵育20min,孵育结束后,吸除上清,用JC-1 Buffer(1×)洗涤2次,加入2mL DMEM培养液,荧光显微镜下观察,随机取5个视野拍照。实验重复3次。
1.3.6 ATP含量检测
取对数生长期EA.hy926细胞,用0.25%胰蛋白酶消化,接种于6孔板中。待细胞长至70%左右,各组细胞进行相应处理,离心收集下层细胞沉淀,将收集好的细胞加入300μL热双蒸水,置于热水浴(90℃)中匀浆破碎,后将细胞悬液于沸水浴中加热10min,取出混匀抽提1min,依次加入ATP含量检测试剂1~6,酶标仪636nm处检测吸OD值。根据公式:ATP含量(μmol/gprot)=[(A测定管-A对照管)÷(A标准管-A空白)]×标准品浓度(1×103μmol/L)×样本测定前稀释倍数÷待测样本蛋白浓度(gprot/L),计算各组ATP含量。实验重复3次。
1.3.7 蛋白质印迹法(Western Bolt)检测转染效率及自噬相关蛋白表达情况
1.4 统计学方法

2 结 果
2.1 不同浓度PA下细胞存活率
与对照组相比,PA可明显降低细胞存活率,并呈现出一定的浓度依赖性。PA浓度为0.1、0.15、0.2、0.25、0.3、0.5、0.7mmol/L时,细胞存活率分别为(80.873±1.490)%、(64.157±11.098)%、(45.883±3.645)%、(31.567±6.472)%、(25.743±3.748)%、(12.327±1.919)%、(8.207±4.743)%。PA浓度为0.2mmol/L时,细胞存活率为(45.883±3.645)%,与对照组相比,显著性降低(P<0.01),根据相关文献研究结果[8],选用0.2mmol/L的PA浓度作为后续实验的高脂浓度。结果见图1。

PA浓度(mmol/L)
2.2 高脂处理后各组细胞活力
与对照组相比,高脂组和高脂+空载组细胞存活率[(45.233±0.505)%、(44.013±1.267)%]显著下降(P<0.01),而高脂+FUNDC1组存活率(68.150±0.655)%明显高于(P<0.01)高脂组,高脂组和高脂+空载组两组结果无显著差异(P>0.05)。结果见图2。
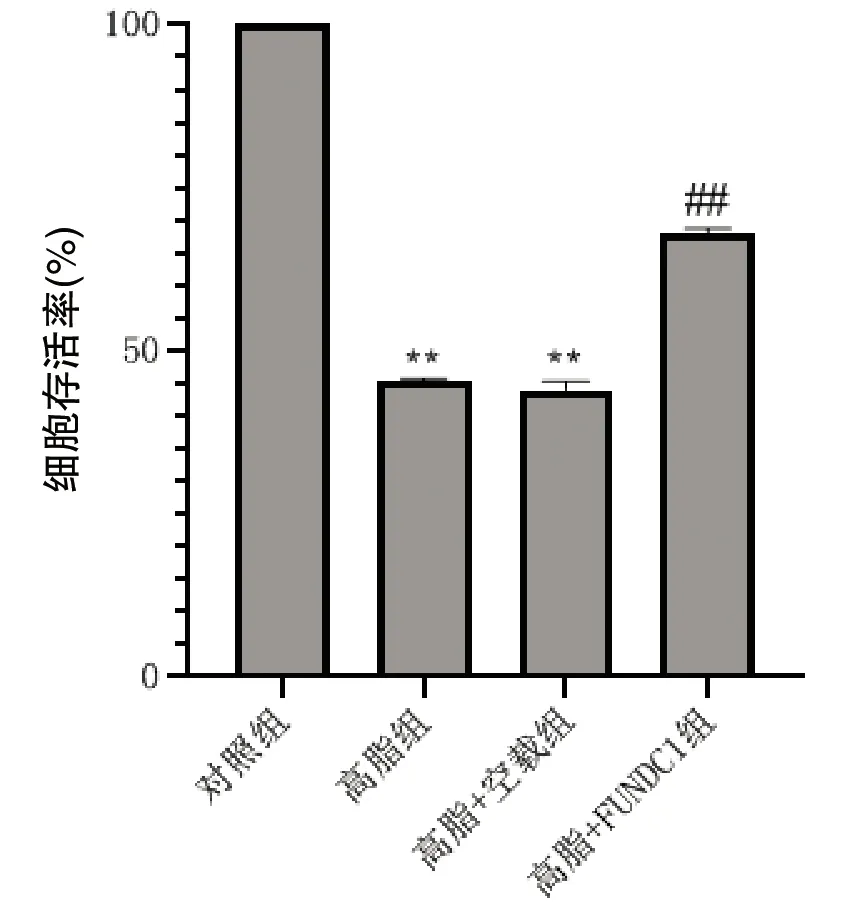
与对照组比较,**P<0.01;与高脂组比较,##P<0.01
2.3 各组细胞活性氧含量
与对照组相比,高脂组和高脂+空载组荧光强度明显升高(P<0.01),表明ROS含量明显升高,而高脂+FUNDC1组荧光强度明显低于(P<0.01)高脂组,表明高脂+FUNDC1组ROS含量减少,高脂组和高脂+空载组两组结果无显著差异(P>0.05)。结果见表1、图3(封二)。

表1 各组线粒体内ROS水平及膜电位去极化比例
2.4 各组细胞线粒体膜电位检测情况
与对照组相比,高脂组和高脂+空载组探针绿色荧光强度明显增强,红色荧光强度明显减弱,红色荧光与绿色荧光强度比值显著降低(P<0.01),提示线粒体膜电位去极化的比例升高,而高脂+FUNDC1组与高脂组相比,JC-1 探针绿色荧光强度显著减弱,红色荧光强度增加,红色荧光与绿色荧光比值明显增高(P<0.01),线粒体膜电位去极化的比例减少,高脂组和高脂+空载组两组结果无显著差异(P>0.05)。结果见表1、图4(封二)。
2.5 各组细胞ATP含量情况
与对照组相比,高脂组和高脂+空载组ATP含量[(62.054±11.26)μmol/gprot、(57.604±9.696)μmol/gprot]显著下降(P<0.01),而高脂+FUNDC1组ATP含量(117.446±21.695)μmol/gprot明显高于高脂组(P<0.05),高脂组和高脂+空载组两组结果无显著差异(P>0.05)。
2.6 FUNDC1转染效率及自噬相关蛋白表达情况
转染48h后,与对照组相比,转染FUNDC1组FUNDC1量显著上升(P<0.01),经Image J软件分析蛋白条带可得,转染效率达192.49%。结果见图5。

与对照组比较,**P<0.01
与对照组相比,高脂组和高脂+空载组LC3b/a增加(P<0.01),P62含量增加(P<0.05),FUNDC1变化无显著差异(P>0.05);与高脂组相比,高脂+FUNDC1组FUNDC1、LC3b/a、P62明显减少(P<0.05)。高脂组和高脂+空载组两组结果无显著差异(P>0.05)。结果见图6。
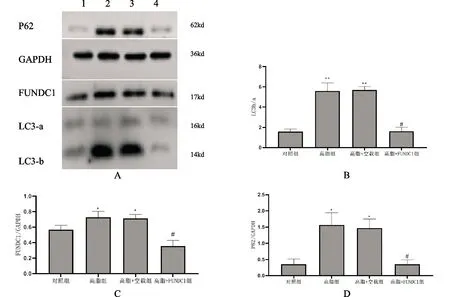
A:各组细胞自噬蛋白表达情况(n=3,±s) 1:对照组;2:高脂组;3:高脂+空载组;4:高脂+FUNDC1组
3 讨 论
高脂血症严重影响患者健康,是动脉粥样硬化、糖尿病、胰腺炎、冠心病及脑梗死等疾病的独立危险因素[9]。高脂血症所导致的脂毒性作用对血管内皮细胞的损伤主要在于诱导细胞线粒体产生过量ROS,有研究表明[10],过量ROS导致的氧化应激会损伤组织与细胞,致使其功能障碍、代谢紊乱。血管内皮细胞功能失调将导致血管生理功能紊乱,是高脂血症诱发动脉硬化的原因之一。
FUNDC1是一个定位于线粒体外膜上的线粒体自噬的受体蛋白[11],在FUNDC1过表达的情况下能够引起显著的线粒体自噬[12]。线粒体自噬是一种选择性清除功能失调线粒体的细胞自我修复过程[13]。其调节线粒体的数目和质量,对减少ROS产生、调节代谢平衡、维持细胞稳态有着重要的意义。有研究[14]发现,FUNDC1在心脏健康的维持中有重要意义,它促进线粒体内质网联结处的稳定,对细胞器结构稳定和细胞整体的稳态有重要作用。FUNDC1匮乏的心肌细胞中,FUNDC1-环磷腺苷效应元件结合蛋白(CREB)途径调节失衡,线粒体发生损伤、功能紊乱。Wu等[15]发现代谢类疾病中线粒体的功能失调与自噬受体FUNDC1缺陷导致的炎症反应有关。Yu等[16]在研究Mst1在心脏缺血再灌注损伤中的作用时发现,损伤机制之一是Mst1抑制了FUNDC1介导的自噬。
上述研究说明了FUNDC1介导的线粒体自噬在维持细胞结构功能稳定上有重要作用。而FUNDC1在高脂损伤的血管内皮细胞中的作用还未见报道,本研究利用腺病毒为载体过表达EA.hy926人血管内皮细胞中FUNDC1,再以0.2mmol/L PA处理转染过的细胞,检测其增殖活力、ROS含量变化、线粒体膜电位去极化情况、ATP生成量和自噬相关蛋白变化等指标来探究FUNDC1在高脂损伤的血管内皮细胞中的作用。结果发现,与对照组相比,高脂组和高脂+空载组LC3、P62含量明显增加(P<0.05);高脂+FUNDC1组相比较于高脂组LC3、P62含量明显减少(P<0.05),高脂组和高脂+空载组结果无明显差异(P>0.05)。LC3蛋白分为LC3-a和LC3-b两种形式,当自噬发生时,LC3-a与磷脂酰乙醇胺结合,形成LC3-b,聚集在自噬体表面,LC3-a向LC3-b的转化意味着自噬体的形成,LC3-b与LC3-a的比值是反映细胞自噬程度的标志之一。P62蛋白是自噬体与底物之间的适配蛋白,它与泛素化蛋白结合后,与LC3相互作用聚集在自噬体上,并不断被自噬体-溶酶体降解。P62蛋白水平高低反映自噬活性的高低,当自噬功能减弱时,P62会不断积累。Western Bolt检测自噬相关蛋白的表达情况实验中发现,在高脂组中,高脂损伤会导致内皮细胞发生反馈调节,高脂组LC3-b增多,表示在内皮细胞中自噬小体生成量不断增多,但结合P62蛋白增多的结果来看,生成的自噬小体没有被溶酶体降解,即高脂组自噬反应没有发生完全。在过表达FUNDC1的高脂+FUNDC1组中,LC3-b、P62含量明显减少,Western Bolt检测FUNDC1腺病毒转染效率的实验中可得,FUNDC1过表达效率达到192.49%,而在高脂+FUNDC1组中,发现FUNDC1的量是减少的,参考FUNDC1作用机制,即FUNDC1与LC3-b蛋白相互结合作用[7-8],表明在高脂+FUNDC1中,过表达的FUNDC1与LC3-b相结合发挥介导自噬的作用,再结合P62蛋白减少的结果,表明生成的自噬小体已被溶酶体降解,即高脂+FUNDC1组自噬反应进行的更加完全,在高脂损伤的内皮细胞中过表达FUNDC1有促进自噬反应进行的作用。细胞活力实验结果发现,高脂+FUNDC1组相比较于高脂组,细胞活力明显提升(P<0.01);ROS检测实验结果发现,高脂+FUNDC1组相比较于高脂组,绿色荧光明显减弱(P<0.01),说明ROS含量下降;线粒体膜电位(JC-1)检测实验发现,高脂+FUNDC1组相比较于高脂组,红色荧光强度明显增强,绿色荧光强度明显减弱,红色荧光与绿色荧光强度比值显著升高(P<0.01),提示线粒体膜电位去极化的比例降低;ATP含量实验发现,高脂+FUNDC1组相比较于高脂组,ATP含量有所增加(P<0.05)。与高脂组相比较,过表达FUNDC1的高脂+FUNDC1组上述各项细胞功能指标均得到一定程度改善。
综上所述,过表达FUNDC1对高脂诱导的EA.hy926人血管内皮细胞有保护作用,其具体机制可能与促进自噬发生,降低ROS量,改善线粒体功能障碍有关。

