b型流感嗜血杆菌荚膜多糖提取新工艺中Triton X-114残留含量的质量标准研究
朱文勇 欧阳圣洁 代小虎 宋绍辉 寸怡娜 陈 枫 廖国阳
中国医学科学院医学生物学研究所,云南昆明 650118
b型流感嗜血杆菌(Haemophilus influenzaetype b,Hib)为荚膜型致病菌,可导致败血症、会厌炎、肺炎、脑膜炎等多种侵袭性疾病[1-3]。接种Hib结合疫苗是目前预防其感染的最有效途径[4]。Hib荚膜多糖是其最主要的毒力因子[5]和免疫抗原[6],现在上市的Hib结合疫苗,荚膜多糖的提取均采用传统工艺[7],其中使用大量的苯酚,严重影响操作者的身体健康,破坏生态环境。为此,国内外开展了Hib荚膜多糖提取新工艺的研究[8-13],其中利用Triton X-114进行多糖纯化的新工艺,具有安全环保、成本低廉、线性放大好等优点,同时也有相关研究[14-15]将Triton X-114应用于生物制品成品生产工艺过程中。同时,新工艺提取的多糖与载体蛋白进行结合后的原液稳定性研究也初步显示了良好的应用潜力[16],因此,有望将该工艺投入到实际生产中。而对于其在荚膜多糖中的残留控制则影响着疫苗产品的质量安全,目前在《中国药典》中并没有关于Triton X-114的检测方法,但已有文献[17]根据Triton X-100的检测方法建立了Triton X-114的检测方法,而其在Hib荚膜多糖中残留含量的质量标准尚无相关研究。本文通过对苯酚法应用于Hib荚膜多糖中Triton X-114残留含量检测的可行性进行验证,并对多批次的检测数据进行统计,结合安全性评价结果初步制定出Hib荚膜多糖中Triton X-114残留量的质量控制标准。
1 材料与方法
1.1 仪器与试药
Varioskan Flash全波长多功能酶标仪(美国Thermo公司);苯酚(西陇化工有限公司);Triton X-114(美国Sigma公司)。Hib荚膜多糖由中国医学科学院医学生物学研究所生物制品五室制备。
1.2 试验方法
1.2.1 线性范围的验证 分别配制10.00、20.00、40.00、60.00、70.00mg/L TritonX-114 溶液,按照文献[17]中的方法测定TritonX-114与苯酚发生反应后产物在340nm波长处的A值,确定线性范围。每个稀释度测定3次,计算每个稀释度的3个测定值之间的相对标准偏差(RSD)值,RSD值应≤5%。标准曲线的R2应≥0.99。
1.2.2 准确性和精密性验证 配制低(10.00mg/L)、中(30.00mg/L)、高(60.00mg/L)浓 度 的 TritonX-114溶液,同时每个浓度设置对应添加终浓度为5.00g/L Hib荚膜多糖(由传统方法制备)的对照组,按照文献[14]中的方法进行检测,每个浓度样品平行测定3组,重复测定3次,计算回收率和RSD值,验证方法的准确性和精密性,要求回收率的范围应为90%~110%,RSD值应≤5%。
1.2.3 样品检测及异常毒性试验 新工艺提取的15批Hib荚膜多糖中Triton X-114的检测按照文献[17]中的方法,其每mL体积的含量与多糖含量的比值即为Hib荚膜多糖中Triton X-114的残留含量。异常毒性实验按照2015年《中国药典》三部中通则1141法进行检测。
2 结果
2.1 线性范围的验证结果
从10.00~70.00mg/L的5个浓度检测结果(表1)显示其RSD值均小于5%,表明在10.00~70.00mg/L的范围内可以用该方法检测。同时利用该值做线性回归,其回归方程为Y=0.0107X-0.0056,R2=1.00,说明其线性关系成立,且相关性较好。

表1 测定范围结果
2.2 准确性和精密性验证结果
低、中、高浓度情况下,含Hib荚膜多糖与否并不影响Triton X-114的检测结果,并且回收率均在95%~105%,说明该方法准确度良好,而其RSD值均<5%,说明该方法精密度较好。见表2~ 3。
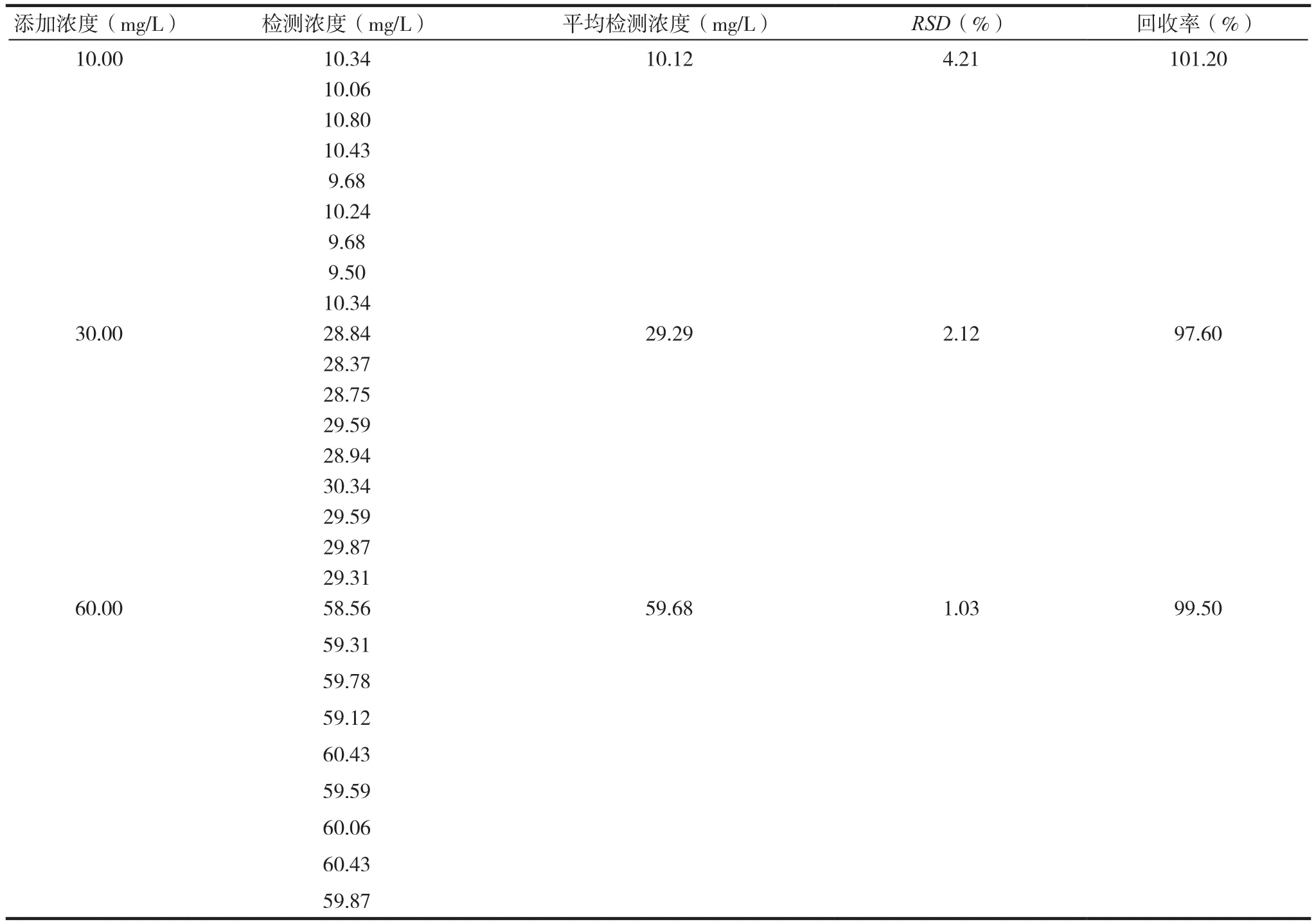
表2 标准品的准确度、精密度检测结果

表3 含Hib荚膜多糖标准品的准确度、精密度检测结果
2.3 样品检测及异常毒性试验
不同批次间Triton X-114的残留含量并不完全一致,但异常毒性的检测结果均符合安全性要求(表4)。残留含量平均值为15.04mg/g荚膜多糖,这15批间的标准差为4.58,根据统计学规律,其残留量上限应为15.04+2×4.58=24.20mg/g荚膜多糖,结合异常毒性的检测结果,初步把Hib荚膜多糖中Triton X-114的残留含量质量标准的上限定为25.00mg/g荚膜多糖。

表4 新工艺提取Hib荚膜多糖中Triton X-114的残留含量及其异常毒性检测结果
3 讨论
随着社会的发展、生活水平的提高,人们对疫苗质量及对环境保护要求越来越高,病原菌荚膜多糖的提取工艺不断改进,新的化学试剂也随之引入。Triton X-114是一种常用化学试剂,已广泛应用于微量金属物富集检测、生物大分子的分离与纯化及环境样品的前处理中[18-20]。但Triton X-114尚未在《中国药典》生物制品中正式出现,而其类似物Triton X-100则已应用于上市生物制品中。在其检测方法被建立的基础上,通过本实验验证了该方法也可以应用于Hib荚膜多糖中的Triton X-114残留含量的检测。
Triton X-114与Triton X-100类似都属于非离子表面活性剂,毒性较小,但残留含量在《中国药典》尚无明确质控标准,如后续工艺所需引入该物质,仍需对其残留量进行质量监控。本实验通过对多批新工艺制备的Hib荚膜多糖的Triton X-114进行检测,在保证安全性的前提下,经统计初步制定出Hib荚膜多糖中Triton X-114的残留含量质量标准的上限定为25.00mg/g荚膜多糖。该标准下疫苗的Triton X-114残留含量不高于0.76μg/mL,与之类似的Triton X-100的质控标准在重组乙型肝炎疫苗中为<15.00μg/mL,而在流感病毒裂解疫苗中的质控标准为<300.00μg/mL。因此,本实验制定的Triton X-114残留含量质控标准能够达到生物制品的安全性要求,该标准可以为后续Triton X-114在《中国药典》中残留含量的质控标准的制定提供参考依据。

