入侵性食叶害虫椰子织蛾的单倍型多样性分析
李优佳,杨 帆,吕宝乾,何荣晓,蔡 波
(1 海南大学 林学院,海南 海口 570228; 2 中国热带农业科学院 环境与植物保护研究所,海南 海口 571101; 3 海口海关 热带植物隔离检疫中心,海南 海口 570311)
全球变暖和日益频繁的国际贸易活动加速了外来物种的入侵,且对当地生物多样性、生态系统和作物生产构成重大威胁,造成巨大的经济损失[1]。椰子织蛾Opisina arenosella是近年来发现危害棕榈科植物的入侵性食叶害虫,最早于19世纪中期在印度和斯里兰卡被发现,此后相继在缅甸、印度、孟加拉、印度尼西亚、泰国、马来西亚、巴基斯坦等地发生为害[2-4]。在我国,该虫于2013年8月首次在海南省万宁市被发现,随后快速扩散至广东、广西和福建等地[5-6]。椰子织蛾可危害不同年龄的棕榈科Palmae植物,幼虫从棕榈科植物的下部老叶逐步向上取食,向新叶扩展,幼虫将叶肉吃光,形成干枯状,幼虫排出的粪便会在叶片背面形成织丝虫道,幼虫在里面潜行,危害严重时使下部的叶片焦枯如火烧状,甚至使植株整个树冠叶片干枯,在短期内就能造成树体死亡[4]。此外,椰子织蛾成虫具有较强飞翔能力,可进行远距离扩散[7]。
目前关于椰子织蛾的研究主要集中在化学防治[8]、生物防治[9-10]和生物学特性等[11-12]方面,有关地理种群的遗传结构以及分化方面的研究报道较少。分子标记技术已越来越多应用于入侵害虫的研究工作中,如美国白蛾Hyphantria cunea[13]、舞毒蛾Lymantria dispar[14]、瓜实蝇Bactrocera cucuribitae[15]和美洲斑潜蝇Liriomyza sativae[16]等。线粒体COI基因是目前使用最广泛的分子标记之一,常被应用于分析入侵物种的遗传变异、种群结构、系统发育和系统地理模式等,对于揭示入侵种群的起源、种群基因交流、灾变遗传机制与分子进化等具有重要意义[17-18]。
本研究采用COI基因片段对国内10个地区及国外3个地区的椰子织蛾种群进行单倍型检测,并与其他地区公布的椰子织蛾序列进行比较分析,探讨入侵中国的椰子织蛾的虫源信息,了解扩张历史,进一步预测该虫的入侵发展途径,为椰子织蛾综合防治策略的提出提供理论依据。
1 材料与方法
1.1 供试虫源
本研究的椰子织蛾来自入侵地中国海南和广东以及马来西亚、泰国和原产地印度等16个地区,共采集172个样本,其中序号12~16的种群序列从GenBank下载获得。将采集的新鲜样品浸泡于无水乙醇,–20 ℃冰箱保存,备用。所采集的样本均有定位信息并进行了标注,详细样本采集信息列于表1。
1.2 DNA提取、PCR扩增及序列测定
基因组DNA的提取参考印红等[19]、张德华等[20]的方法。所有样品的DNA质量在超微量紫外分光光度计(生产于上海尤尼柯UV-3802S)下测定,D260nm/D280nm比值均在 1.7~2.0,提取的 DNA 稀释至 500 ng /μL,−20 ℃ 条件下保存,备用。
根据NCBI数据库椰子织蛾线粒体COI基因序列,设计扩増片段长度为1 152 bp特异性引物。引物序列分别为正向引物: 5′-TTTTTGGAA TTTGAGCAGGA-3′,反向引物: 5′-GGGATAATCC GGTAAAAAGAGG-3′。COI基因PCR反应体系为20 μL,包括 2×TaqPlus Master Mix 10.0 μL、上游引物 0.8 μL、下游引物 0.8 μL、Template 1.0 μL (0.1 μg)、ddH2O 7.4 μL。PCR 反应条件:95 ℃ 预变性 5 min;95 ℃ 变性 30 s,60 ℃ 退火 30 s,72 ℃ 延伸 1 min,15 个循环 (每个循环降 1 ℃);95 ℃ 预变性 30 s,50 ℃ 变性 30 s,72 ℃退火 60 s,28 个循环;72 ℃ 延伸10 min,最后修复延伸10 min。委托上海美吉生物医药科技有限公司测序。
1.3 数据分析
利用BioEdit软件对测序获得的COI基因序列进行人工修正和序列对比[21]。使用TCS 1.21构建置信度为90%的简约单倍型网络[22]。基于等位基因频率的方法,运用 Dna SP v5.10 软件对入侵地区的种群进行中性检验,分析群体历史动态,同时分析每个地理种群中的单倍型组成及各个单倍型在所有地理种群中的分布情况。
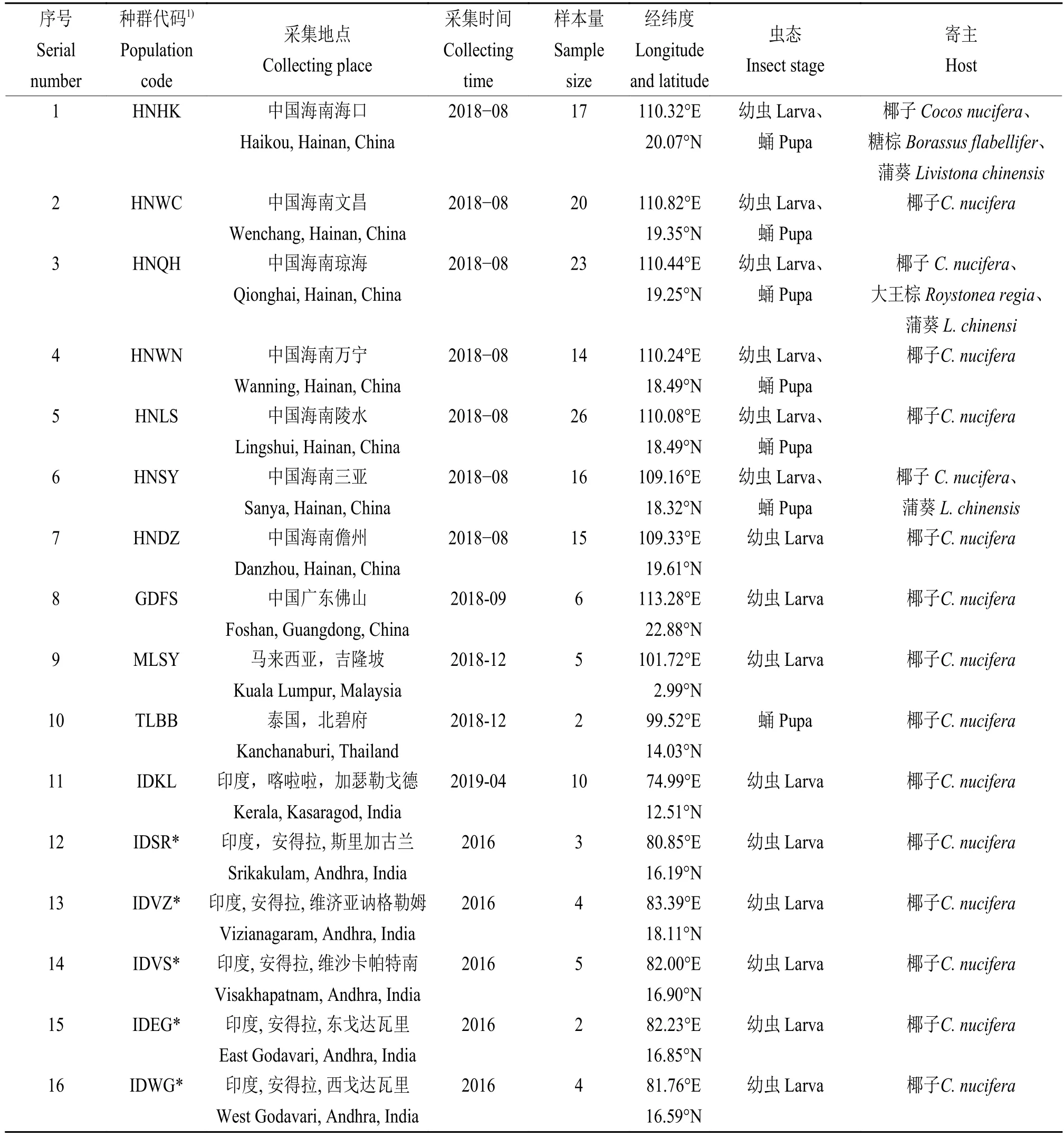
表1 不同地理种群椰子织蛾样本信息Table 1 Sample information of Opisina arenosella from different geographical populations
2 结果与分析
本研究共获得172条来自16个不同地理种群的椰子织蛾线粒体COI序列,其中154条在本次试验中获得,经过比对和引物删除,片段长度约为1 080 bp;18 条从 GenBank 下载获得,片段长度为625 bp。172条序列共鉴定出12个单倍型(图1),构成2个明显的单倍型分支,其中1个分支为单倍型HAP,由144个样本共享,包括海南琼海(HNQH)、海南陵水(HNLS)、海南海口(HNHK)、海南文昌(HNWC)、海南万宁 (HNWN)、海南三亚 (HNSY)、广东佛山(GDFS),以及马来西亚吉隆坡(MLSY)、泰国北碧府(TLBB)(表2);另1个分支由11个单倍型IN1-IN11组成,均来自印度种群,单倍型IN1是印度6个地区椰子织蛾的共享单倍型,IN2-IN11均为独享单倍型,不与其他种群共享。
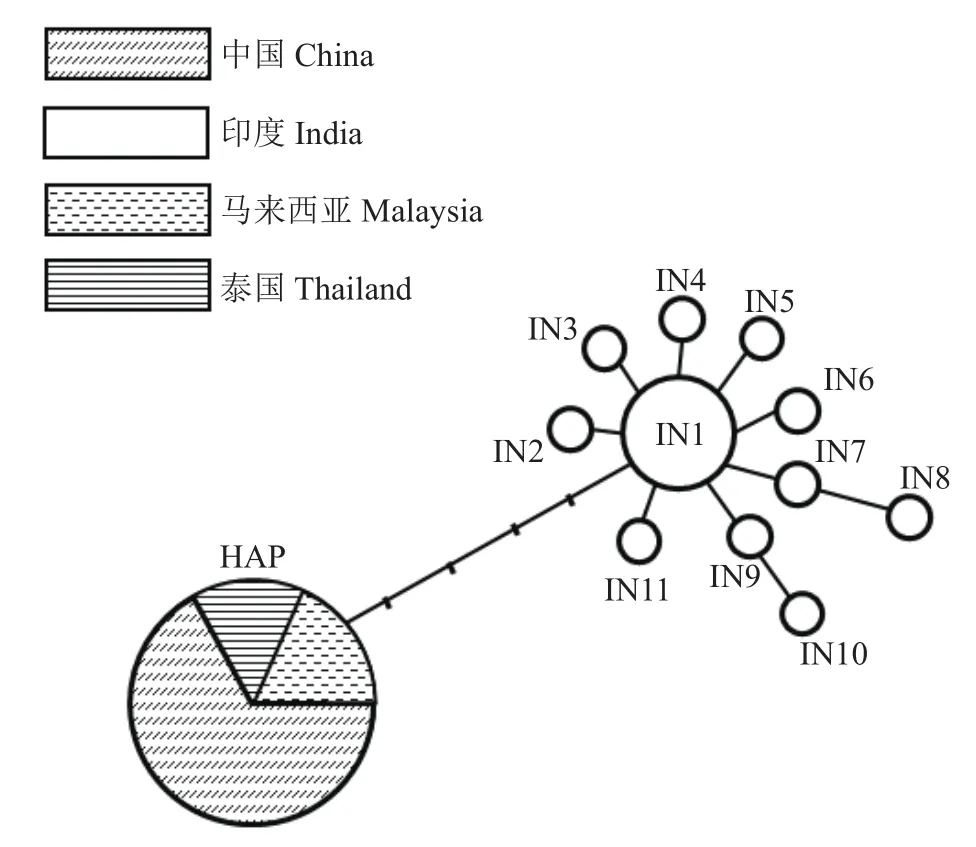
图1 椰子织蛾12个COI单倍型网络进化关系图Fig. 1 Evolution diagram of 12 COI haplotypes of Opisina arenosella

表2 椰子织蛾12个COI单倍型在不同地区的分布Table 2 Distribution of 12 Opisina arenosella COI haplotypes in different regions
序列对比显示COI单倍型包含15个变异位点(图2),其中,73%是碱基转换,27%是碱基颠换。11个来自印度的单倍体(IN1~IN11)与分布在中国、马来西亚和泰国的单倍体HAP存在4个变异位点,位点17的碱基为嘌呤转换,位点161、257和608的碱基为嘧啶转换。

图2 椰子织蛾COI单倍型变异位点分布Fig. 2 Variable site distribution of Opisina arenosella COI haplotypes in different regions
对入侵地区椰子织蛾种群基于等位基因频率的中性检验并结合错配分布的分析结果显示,Tajima’sD值为 −1.159 67(P>0.05),Fu’s Fs 值为−3.515(P>0.05),二者均为负值,但分化值不显著。错配分布图(图3)显示,16个种群的所有单倍型的歧点先形成L形,而后出现单峰分布曲线,表明椰子织蛾在整体水平上并未出现快速扩张等历史事件。

图3 基于等位基因频率的172个椰子织蛾样本的错配分布图Fig. 3 Distribution of mismatch in 172 Opisina arenosella samples based on allele frequency
3 讨论与结论
本研究对16个椰子织蛾种群的172个样本COI序列进行分析,所有序列无插入或缺失现象,并且 A+T 平均占比为68.9%,明显高于G+C 占比(31.1%),表现出A+T碱基偏嗜,符合昆虫线粒体DNA碱基组成结构[23]。将所有个体作为整体进行中性检测分析,种群未经历大规模的扩张,单倍型IN1在印度种群中广泛分布,并作为中心向其他单倍型发散,推断IN1是祖先单倍型;单倍型HAP则形成另一分支,并由中国、马来西亚和泰国的种群共享,表明入侵地区的椰子织蛾种群为同一基因类型或者有相同的入侵源,且该基因型在入侵地区快速繁殖和扩散,说明具有较高的适应和竞争能力。椰子织蛾在入侵地区未形成遗传分化,分析原因可能是椰子织蛾入侵我国的时间较短,新栖息地的地理环境相似,尚未积累丰富的遗传变异。
遗传变异是物种适应环境的基础,当面临新的环境条件时,丰富的遗传变异为物种适应新环境提供了选择材料。因此,较高的遗产变异可以增强环境适应能力。然而,高水平的遗传多样性并非成功入侵的必要条件[24]。外来物种在入侵过程中常伴随奠基者效应,导致遗传多样性水平降低[25-26]。一些入侵物种遗传多样性的降低反而促进其成功入侵。如阿根廷蚂蚁Linepithema humile入侵北美,其遗传多样性的降低减少了种群内部斗争,因此提高了种群的生存与繁殖能力,在数量上占据优势,从而形成了有利于在新环境中竞争的行为特性[27]。在本研究中,入侵中国、马来西亚、泰国等地区的椰子织蛾种群中仅检测到一种COI基因型,原产地印度椰子织蛾种群的多态位点显著多于入侵地区种群的,表明椰子织蛾入侵后遗传多样性下降,种群经历了奠基者效应。一些理论研究表明,入侵过程的瓶颈效应可以增加性状的遗传变异[28]或改变遗传背景[29]。外来物种在入侵过程中通过与转座子的相互作用影响基因组结构、组织和功能,从而促进快速适应,特别是在遗传多样性低的群体中。应激诱导的转座子活性变化可以改变基因作用,并促进遗传变异,有助于遗传多样性低的物种能够在新环境中快速适应[30-31],使群体达到新的适应高峰。入侵地区与原产地印度的椰子织蛾单倍型均存在4个碱基位点的差异,推测是椰子织蛾种群受环境选择压力影响,在新栖息地产生了新的突变或杂交。有研究已证实线粒体的基因突变可以影响与生物学特性有关的表型变化,如灰飞虱Laodelphax striatellus在我国存在2种不同的线粒体单倍型群(HGI、HGII),而这2种单倍型灰飞虱在产卵量和寿命等方面存在显著差异,灰飞虱线粒体DNA的变异导致了DNA复制能力的提高,使其能够抵御遗传漂变作用而被保留下来;同时这些变异带来了生殖和耐寒力方面的优势,使其能够在种群中得到扩散[32]。
在我国,椰子织蛾主要分布在纬度23.5°N以南的局部地区,且暴发为害多发生在以棕榈植物种植为主的公园、国道以及滨江滨海绿化带[33]。据报道,椰子织蛾分布最北的地区为印度德里,纬度约为28.6°N[34]。因此,椰子织蛾在我国可能向北持续扩散,且随着全球变暖日益严重,该虫向北扩散蔓延的速度将进一步加快。本研究分析了3个入侵国家的椰子织蛾单倍型,该信息对精准监测椰子织蛾,综合分析其侵入来源和扩散路径具有重要指导意义。

