氟苯尼考缓释颗粒的制备及体外释放特性
梁立杰,黎键业,许 颖,刘雅红,黄显会
(华南农业大学 兽医学院/国家兽医微生物耐药性风险评估实验室/广东省兽药研制与安全评价重点实验室,广东 广州 510642)
氟苯尼考(Florfenicol)是美国先灵–保雅(Schering-Plough)公司在19世纪70年代末研制的一种动物专用的新型酰胺醇类广谱抗菌药,对革兰阴性菌和革兰阳性菌如胸膜放线杆菌和大肠埃希菌都有强大的抑菌能力[1]。氟苯尼考具有抗菌谱广、吸收好、体内分布广等特点[2],在兽医临床上广泛应用于猪、禽和水产动物的疾病治疗[3-5],仅2013年氟苯尼考的用量就达到了1万 t[6]。在兽医临床上氟苯尼考常用的给药方式是混饲或饮水,目前,氟苯尼考的制剂类型主要有与葡萄糖等辅料简单混合的普通粉剂、以纽氟罗为代表的预混剂和为了提高溶解度研制的环糊精包合物等[7-8]。无论粉剂、预混剂还是环糊精包合物都存在达峰时间快、峰浓度高、消除快等问题,容易导致多剂量连续给药时药物峰谷浓度差较大,且谷浓度低于有效浓度产生抑菌空档期,同时过高的峰浓度不会增强药物疗效反而容易导致免疫抑制[9-10]和胚胎毒性[11]的发生。为减少氟苯尼考在猪体内的峰谷浓度差,消除间歇采食导致的谷浓度低于有效浓度的时间和多剂量给药抗菌空档期,避免诱导耐药性,降低峰浓度值避免药物在体内的浪费,达到增强药物疗效、避免产生耐药性的目的,亟需研制氟苯尼考新剂型。
本试验通过选用合适的稀释剂、填充剂、缓释剂和粘合剂等辅料,以药物体外释放度为评价指标,运用离心喷雾干燥造粒技术制备了一种缓释、长效的新剂型−氟苯尼考缓释颗粒,以缩小氟苯尼考在动物体内血药浓度的峰谷浓度差,延长氟苯尼考在肠道释放吸收的时间,从而减少药物的使用量,避免因多剂量连续使用氟苯尼考产生免疫抑制,降低产生胚胎毒性的风险,为氟苯尼考产业化生产提供新的剂型及工艺。
1 材料与方法
1.1 仪器
高效液相色谱仪(1260型,四元泵,紫外检测器,美国安捷伦公司);色谱柱 (Gemini C18 110A,250 mm×4.6 mm×5 μm,美国 Phenomenex 公司);溶出试验仪(RCY-808型,天津海益达公司);pH测定计(PHS-3C型,上海雷磁仪器厂);数控超声仪(KH-500DB型,昆山禾创超声仪器有限公司)。
1.2 药品与试剂
氟苯尼考对照品(w,99.3%)购自中国兽医药品监察所;氟苯尼考原料药(w,99.8%)购自浙江海翔川南药业有限公司;氟苯尼考粉(w,10%)购自正典生物技术有限公司;硬化油购自杭州油脂化工有限公司;甘油酯购自广州嘉德乐生化科技有限公司;乙腈,色谱级纯,批号:122269,购自 Thermo Fisher Scientific公司;盐酸、冰醋酸、磷酸二氢钾、氢氧化钠、氯化钾、十二烷基硫酸钠(w,95.0%)等均为国产分析纯。
1.3 氟苯尼考缓释颗粒的制备
称取处方量的氟苯尼考原料药和辅料(质量比为 1∶9),将水加热至 60~75 ℃ 后,加入缓释剂、稀释剂和黏合剂,匀速搅拌均匀,得到混匀物料A;待混匀物料A温度上升至80~85 ℃后,再投入填充剂和矫味剂,匀速搅拌使物料完全融溶,得到混匀物料B;将氟苯尼考投入混匀物料B中,搅拌物料至无堆积后,乳化 20~50 min,得到混匀物料 C;将混匀物料C在70 ℃保温后进行离心喷雾干燥,冷却,筛选出粒度大小为300~450 μm的药物颗粒,备用。
1.4 体外溶出分析方法的建立
1.4.1 色谱条件 参考《中华人民共和国兽药典》[11]中氟苯尼考的高效液相色谱(HPLC)检测方法,流动相为乙腈、水和冰醋酸 (体积比为 100∶197∶3),紫外检测波长 224 nm,柱温 30 ℃,流速 1.0 mL/min,进样量 10 μL。
1.4.2 回收率与精密度试验 精密称取氟苯尼考25 mg对照品2份,分别置于50 mL容量瓶中,一份加入适量流动相溶液超声溶解并定容,然后分别用3种释放介质[pH 1.2盐酸缓冲液、pH 4.3醋酸缓冲液 (含 5 g/L SDS)、pH 6.8 磷酸缓冲液 (含 5 g/L SDS)]稀释,作为对照品溶液。另一份先加入氟苯尼考微囊化颗粒配方比例的空白辅料,再加入适量流动相溶液超声溶解并定容,然后分别用3种释放介质溶液稀释,制得质量浓度为40、50、60 μg/mL的氟苯尼考溶液。制得的溶液过0.45 μm针式过滤器,按“1.4.1”的色谱条件上机检测,每个浓度样品连续重复进样3针,记录峰面积,计算供试样品的回收率和相对标准偏差(Relative standard deviation,RSD)。制备氟苯尼考质量浓度为 50 μg/mL的平行供试样品6份,上机检测,计算样品的精密度。
1.4.3 标准曲线的制作 以 pH 1.2 盐酸缓冲液为介质,精密称量氟苯尼考对照品25 mg,用pH 1.2盐酸缓冲液稀释,配制成氟苯尼考质量浓度为500 mg/L的储备液。将储备液用pH 1.2盐酸缓冲液稀释成质量浓度为 5、10、20、50、100、200 mg/L 的溶液,过0.45 μm针式过滤器后,按照“1.4.1”的色谱条件上机检测。参照氟苯尼考在pH 1.2盐酸缓冲液介质中标准曲线的制定方案,制作pH 4.3醋酸缓冲液 (含 5 g/L SDS)介质以及 pH 6.8 磷酸缓冲液 (含5 g/L SDS)介质的标准曲线。
1.4.4 稳定性试验 将氟苯尼考质量浓度为 500 mg/L的储备液分别用3种释放介质溶液稀释,制成质量浓度为50 μg/mL的供试品溶液。室温放置0、1、2、3、4、5、6、7、8 h 后,取 2 mL 溶液过 0.45 μm针式过滤器后上机检测,计算放置不同时间供试样品中氟苯尼考的含量,评价氟苯尼考溶液室温放置的稳定性。
1.5 氟苯尼考缓释颗粒药物含量检测
精密称取制备的氟苯尼考缓释颗粒0.25 g,置于100 mL碘量瓶中,精密加入50 mL提取溶液(乙腈、水、冰醋酸体积比为 200∶97∶3),超声溶解后过滤,精密取滤液5 mL于50 mL容量瓶中,用流动相(乙腈、水、冰醋酸体积比为100∶197∶3)定容并摇匀,过0.45 μm针式过滤器,按“1.4.1”的色谱条件进样分析,利用单点法计算缓释颗粒中氟苯尼考的实际含量。
1.6 氟苯尼考缓释颗粒体外释放度的检测
释放度检测方法以《中华人民共和国兽药典》[11]306-308中的溶出度测定第一法(篮法)为依据。精密称取氟苯尼考缓释颗粒与氟苯尼考粉各0.5 g,置于转篮中。加900 mL相应的溶出介质于溶出杯中,在 (37.0±0.5)℃、100 r/min 条件下进行溶出试验。分别于 0.25、0.5、1、2、3、4、5、6、7、8 h 的时间点取样1 mL(同时向溶出杯中补加相同温度的释放介质溶液 1 mL)。经 0.45 μm 针式过滤器过滤后,按“1.4.1”的色谱条件进样分析,根据“1.4.3”制得的的标准曲线回归方程计算氟苯尼考浓度,按公式(1)计算样品在不同时间点的累计释药百分率,绘制样品的累计释放百分率−时间曲线。

式中,Q表示氟苯尼考的累计释放百分率,Cn表示第n个采样时间点的样品中氟苯尼考的质量浓度;V表示释放介质溶液的总体积;Vi表示第i个采样时间点的取样体积;Ci表示第n个采样时间点所取样品氟苯尼考的质量浓度;m表示颗粒总质量,DL表示颗粒中氟苯尼考的总质量分数。
1.7 释放模型拟合
利用 Origin Pro 8.0 按照 Zero-order、Firstorder和Higuchi方程分别对缓释颗粒在不同pH释放介质条件下的释放曲线进行拟合,以各模型拟合方程的r值确定最佳拟合模型。
2 结果与分析
2.1 专属性试验
氟苯尼考专属性试验结果(图1)显示,氟苯尼考出峰时间为7.1 min,空白溶液在该方法下没有出现干扰峰,专属性良好,符合《中华人民共和国兽药典》[11]规定。
2.2 检测限和定量限
以信噪比≥3的氟苯尼考浓度为检测限,以信噪比≥10的氟苯尼考浓度为定量限。精密移取一定量的氟苯尼考对照品溶液,用流动相溶液逐级稀释,按“1.4.1”的色谱条件进样分析。结果显示,氟苯尼考的检测限为 0.05 μg/mL,定量限为 0.10 μg/mL。
2.3 标准曲线的绘制
以氟苯尼考的峰面积(S)为横坐标,质量浓度(C)为纵坐标,通过最小二乘法对数据进行线性回归,绘制标准曲线。氟苯尼考在pH 1.2盐酸缓冲液中的回归方程为C=0.070 4S−4.381 1 (R2=0.999 3),在pH 4.3醋酸缓冲液中的回归方程为C=0.070 1S−3.556 5 (R2=0.999 0),在 pH 6.8 磷酸缓冲液中的回归方程为C=0.698 0S−2.740 7 (R2=0.999 0)。结果显示,氟苯尼考在5~200 μg/mL质量浓度范围内线性良好 (R2≥0.999 0)。

图1 50 μg/mL氟苯尼考溶液在不同释放介质溶液中的高效液相色谱图Fig. 1 High performance liquid chromatograms of 50 μg/mL florfenicol solution in different release medium solutions
2.4 回收率与精密度试验
根据《药品质量标准分析方法验证指导原则》[11]374-377关于溶出度方法学的要求,在规定范围内,测定50 μg/mL(相当于100%浓度水平)氟苯尼考6份供试样品的结果,并进行精密度评价。以对照品加入量与所取供试品中待测定成分质量比1.2∶1、1∶1、0.8∶1 左右作为回收率高、中、低浓度,本试验所取的氟苯尼考待测成分量约为50 μg/mL,因此选择质量浓度为40、50、60 μg/mL的氟苯尼考溶液进行考察。
氟苯尼考在3种介质中的添加回收率结果(表1)和精密度结果 (表 2)显示:低 (40 μg/mL)、中 (50 μg/mL)与高质量浓度(60 μg/mL)的药物添加回收率分别为 98.33%~100.91%、99.35%~101.13%、98.29%~101.03%,RSD 为 0.13%~0.86%、0.37%~0.67%、0.27%~0.93%,精密度的RSD为0.41%~0.84%。回收率以及精密度的RSD均小于1.50%,符合《中华人民共和国兽药典》[11]中《药品质量标准分析方法验证指导原则》规定。
2.5 稳定性试验
精密移取50 μg/mL的氟苯尼考对照品溶液在0、1、2、3、4、5、6、7、8 h 的时间点进样,以氟苯尼考的峰面积计算,结果(表3)显示,氟苯尼考不同时间点在PH 1.2盐酸缓冲液、PH 4.3醋酸缓冲液和PH 6.8磷酸缓冲液中RSD分别是1.86%、1.44%和1.80%,表明氟苯尼考溶液在这3种不同pH介质中8 h内稳定性良好,符合《中华人民共和国兽药典》[11]规定。
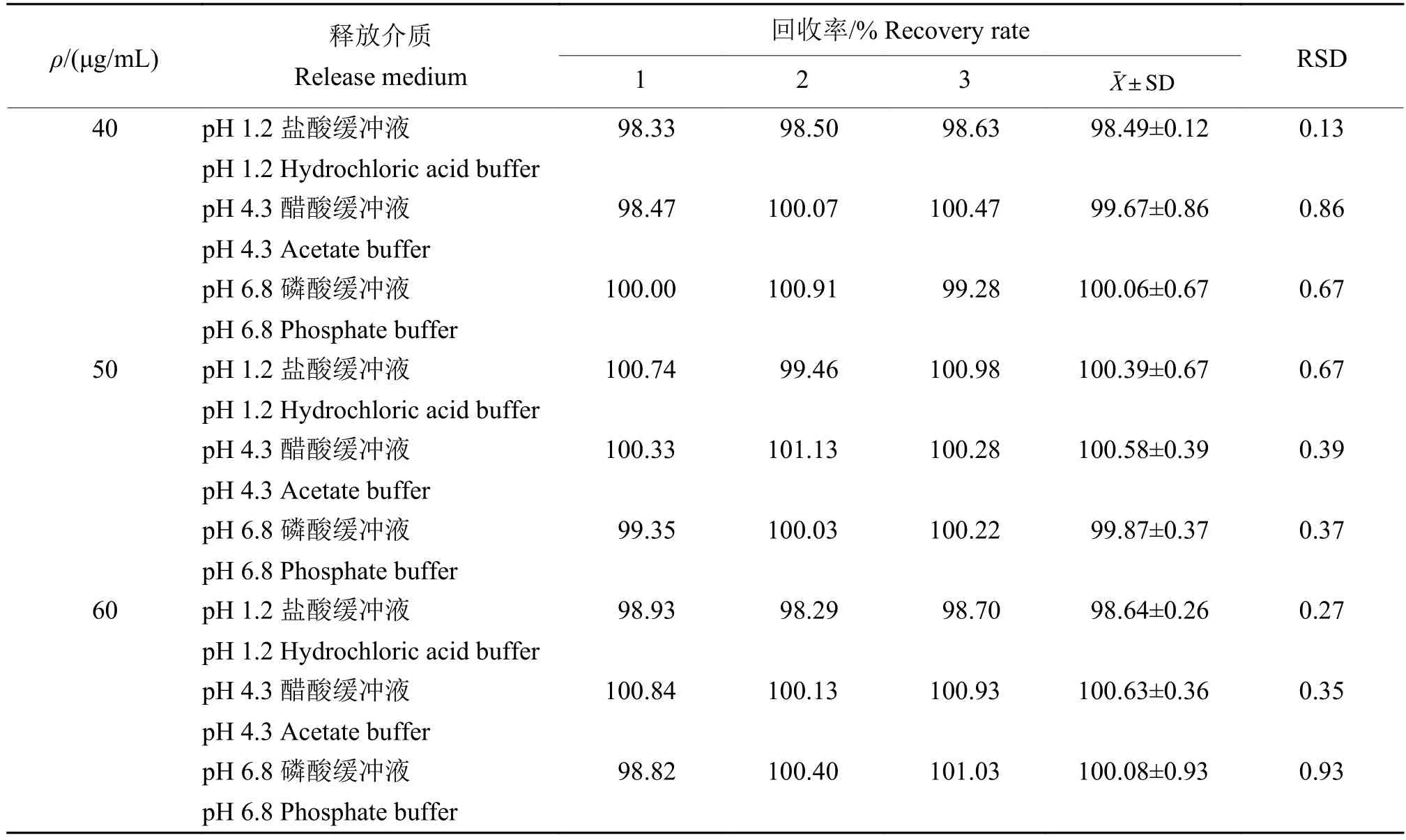
表1 添加制备氟苯尼考缓释颗粒空白辅料的药物回收率Table 1 Recovery rates of blank excipients for preparation of florfenicol sustained-release granules n=3
2.6 氟苯尼考缓释颗粒药物含量
氟苯尼考缓释颗粒药物含量测定结果(表4)显示,该提取方法能够完全提取制备的氟苯尼考缓释颗粒中的药物,缓释颗粒中的药物含量(w)分别99.19%、100.01%、97.45%、100.72%,符合《中华人民共和国兽药典》[11]中对待测成分含量和回收率限度的要求(95%~105%),且RSD均小于2.00%,表明氟苯尼考缓释颗粒中药物分布较均匀。
2.7 氟苯尼考缓释颗粒体外释放试验
以时间为横坐标,累计释放百分比为纵坐标,绘制在pH 1.2盐酸缓冲液、pH 4.3醋酸缓冲液、pH 6.8磷酸缓冲液各溶出介质中,氟苯尼考缓释颗粒和氟苯尼考粉在 0.25、0.5、1、2、3、4、5、6、7、8 h的时间点的释放曲线(图2)。
氟苯尼考缓释颗粒与氟苯尼考粉的体外释放曲线如图2所示,氟苯尼考粉在0.25 h时释放量已经接近90%,0.5 h后已经完全释放。氟苯尼考缓释颗粒在pH 1.2盐酸缓冲介质(模拟胃液)中,1 h前不释放,1 h后少量释放,8 h释放量仅为 6.13%;氟苯尼考缓释颗粒在pH 4.3、6.8的缓冲介质(模拟肠液)中缓慢释放,0.5 h释放量为35.42%和34.30%,2 h的释放量为80.16%和79.38%,5 h的释放量为98.99%和96.70%。此条件下制得的氟苯尼考缓释颗粒表现出良好的耐酸性以及在模拟肠液的环境下良好的释放性,达到了药物缓释的目的。
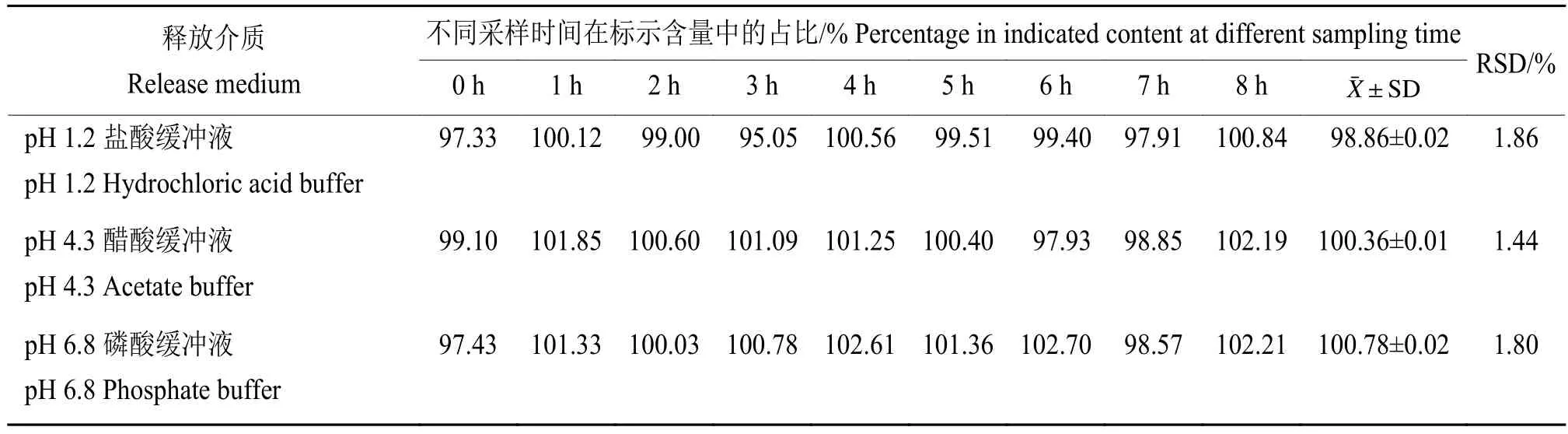
表3 氟苯尼考在不同释放介质溶液中的稳定性试验结果Table 3 Results of the stability test of florfenicol in different release medium solutions

表4 氟苯尼考缓释颗粒中药物含量的测定结果Table 4 Determination of drug content in fluorfenicol sustained-release granules %
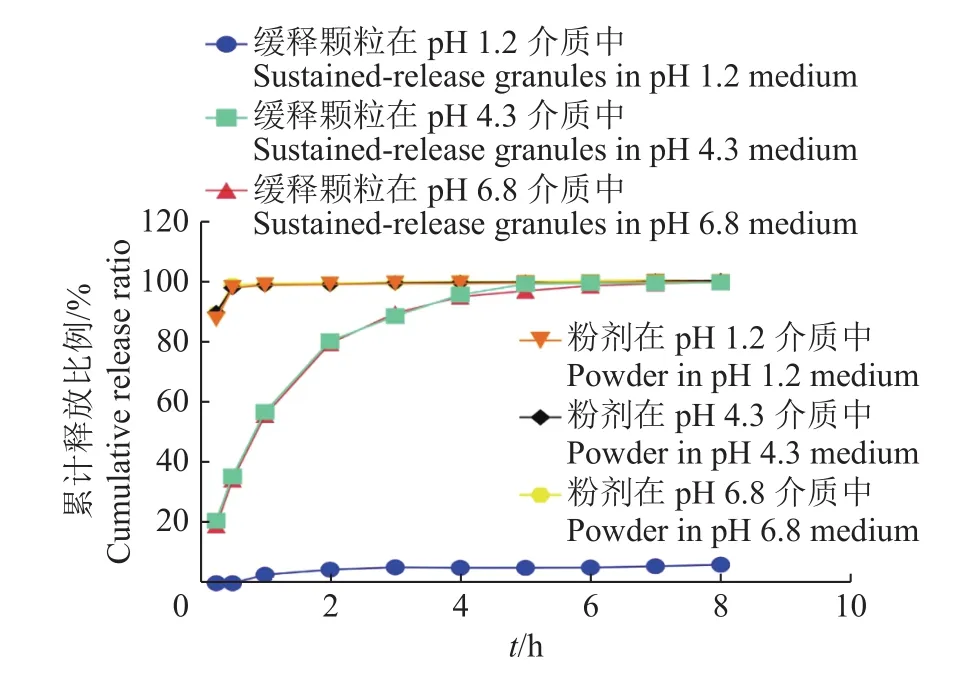
图2 氟苯尼考缓释颗粒和氟苯尼考粉在不同释放介质溶液中的累计释放量曲线Fig. 2 Cumulative release curves of florfenicol sustainedrelease granules and florfenicol powder in different release medium solutions
2.8 氟苯尼考缓释颗粒体外释放特性拟合方程
用Origin Pro 8.0对氟苯尼考缓释颗粒在不同时间点(t)的累计释放百分率(M)进行方程拟合。结果(表5)显示氟苯尼考缓释颗粒在pH 1.2盐酸缓冲液中R2均低于0.80,在pH 4.3醋酸缓冲液和pH 6.8磷酸缓冲液的条件下,药物释放曲线均与Firstorder方程拟合度较好,拟合方程分别为ln(1−M)=−0.771 85t−0.046 22(R2=0.998 96)和 ln(1−M)=−0.763 80t−0.030 72(R2=0.999 32)

表5 氟苯尼考缓释颗粒体外累积释放方程拟合Table 5 Fitting of cumulative release equations of florfenicol sustained-release granules
3 讨论与结论
本研究选用合适的辅料充分混合和乳化,通过离心喷雾干燥技术制得了一种高度分散的氟苯尼考缓释颗粒。氟苯尼考制剂配方中含有不能全部溶解于水或有机溶剂的辅料,为了完全提取缓释颗粒中的氟苯尼考,确保测定结果的准确性,本研究提高了提取液中有机相的比例。通过高效液相色谱法检测,不同批次制备的氟苯尼考缓释颗粒中氟苯尼考实际含量在标示含量中占的比例均在95%~102%之间,符合药典要求,RSD小于2.00%,表明氟苯尼考缓释颗粒中药物分布较均匀,制备氟苯尼考缓释颗粒的工艺可达到要求。
影响猪消化道pH的因素很多,正常胃肠道的pH在恒定范围内[12],猪胃部pH变化范围为1.0~3.5,小肠和大肠pH变化范围为4.0~7.0[13]。为更好地模拟胃肠道的酸碱环境,选择pH 1.2盐酸缓冲液、pH 4.3醋酸缓冲液和pH 6.8磷酸缓冲液作为体外溶出试验的释放介质。氟苯尼考在水中的溶解度很低,为满足漏槽条件,更好地模拟胃肠道环境,需在释放介质溶液中添加一定量的表面活性剂。本释放度试验中,因胃液只有少量的胃蛋白酶,模拟胃液的pH 1.2盐酸缓冲液在没有添加表面活性剂的情况下已满足漏槽条件,因此不需加表面活性剂;在pH 4.3醋酸缓冲液和pH 6.8磷酸缓冲液中均需要加入表面活性物质以满足漏槽条件和更好地模拟肠道环境。常用的表面活性剂有SDS和吐温−80,经过一系列摸索,发现即使高浓度的吐温−80也无法满足漏槽条件,因此本试验选择SDS作为表面活性剂。考虑到SDS有可能损害色谱柱,以及在低温状态下析出堵塞高效液相色谱仪管路。因此对溶出样品在上机检测前要先进行净化,4 ℃高速离心10 min,使SDS沉淀析出,弃沉淀物,得到澄清上清液,过0.45 μm孔径的滤膜后上机检测。经过一系列探索,发现5 g/L的SDS添加量满足漏槽条件,被本释放度试验采用。pH 1.2盐酸缓冲液作为模拟胃液的溶剂,猪体内肠道酸碱性条件及生物活性条件[14]模拟分别选择均添加了5 g/L SDS的pH 4.3醋酸缓冲液和pH 6.8磷酸缓冲液。
为评价研制的氟苯尼考缓释颗粒在体外的释放特征,将氟苯尼考缓释颗粒置于pH 1.2盐酸缓冲液、pH 4.3醋酸缓冲液和pH 6.8磷酸缓冲液的环境下考察其体外的释放特征。结果显示,氟苯尼考缓释颗粒在模拟胃液环境(pH 1.2盐酸缓冲液)中1 h内不释放,保证其在通过胃部的时候不受胃酸影响,避免在胃部因酸环境破坏微囊导致提前释放,无法达到缓释作用;在模拟肠液的环境(pH 4.3、6.8缓冲液)中,氟苯尼考缓释颗粒缓慢且完全释放,0.5 h释放量为35.42%和34.30%,没有出现突释情况,2 h 释放量为 80.16% 和 79.38%,5 h 释放量为98.99%和96.70%,延缓药物释放的同时能促进完全释放。相比于微球制剂,氟苯尼考缓释颗粒的释放时间更符合食物在猪消化道滞留的时间[15-16];相比于氟苯尼考肠溶缓释包衣微粒制剂[17],缓释颗粒的释放量更为完全。由各模型拟合结果可知氟苯尼考缓释颗粒的体外释放符合First-order模型。
本试验所用到的离心喷雾干燥制粒技术中的喷雾干燥过程中水分蒸发迅速,仅需数秒就能完成干燥,快速制备出缓释、稳定的氟苯尼考产品。工艺过程较简化,操作控制方便,节省了时间和工艺成本。此工艺制备的氟苯尼考缓释颗粒具有良好的过胃耐酸性能,保证药物不受胃酸影响的同时可使药物在肠道中缓慢且完全释放,延长药物有效血药浓度维持时间,提供持续稳定的抑菌作用。在多次临床给药应用中,该氟苯尼考缓释颗粒可缩小峰谷浓度差,维持平稳的有效血药浓度,达到长效的效果。因此可减少临床给药次数,进而减少药物在生产上的用量,达到减少使用抗生素、避免产生胚胎毒性和免疫抑制的目的,为后续的临床试验研究和临床使用药物提供参考依据。

