高灵敏、宽动态范围纳米流式检测装置的研制及应用
毛翠萍 林垚 牛倩 薛乘风 颜晓梅

摘要基于纳米颗粒固有的多分散性,对其粒径及分布快速地进行高分辨表征是纳米颗粒相关研究和产品开发所面临的重大挑战。与电子显微镜、原子力显微镜、动态光散射、纳米颗粒追踪分析等常规使用的纳米颗粒表征技术相比,流式细胞术具有可单颗粒检测、快速、多参数、统计精确性高等优势。然而,由于检测灵敏度的局限性,商品化流式细胞仪难以检测粒径小于200 nm的聚苯乙烯纳米颗粒。结合瑞利散射和鞘流单分子荧光检测技术,本研究组研制了纳米流式检测装置 (Nanoflow cytometer, nFCM),采用单光子计数雪崩光电二极管 (Single photon counting avalanche photodiode, APD) 作为检测器,低折射率二氧化硅纳米颗粒 (SiO2 NPs) 的检测下限可达到24 nm,可基线分辨47、59、74、94和123 nm的SiO2 NPs混合样本。由于nFCM散射光检测动态范围受限于单光子探测器的最大光子计数值,而纳米颗粒的散射光强度随粒径的增大呈指数上升,为实现纳米颗粒更全面的粒径分布检测,仪器的检测动态范围有待提升。本研究采用激光光束整形、双光阑降低背景信号、高量子效率光电倍增管检测器等策略对仪器进行多方位改进,以研制高灵敏、宽动态范围的nFCM。改进后的nFCM可实现直径59 nm SiO2 NPs的高信噪比检测 (S/N = 119),可基线分辨59、74、94、123、160、180和222 nm的SiO2 NPs混合样本,相比以APD为检测器的nFCM,粒径检测范围扩展约100 nm, 并成功用于鼠伤寒沙门氏菌外膜囊泡 (Outer membrane vesicles, OMVs) 粒径分布的快速测定。
关键词单颗粒检测; 光散射; 粒径分布; 纳米流式检测技术; 细菌外膜囊泡
1引 言
了解天然生物纳米颗粒(如病毒、细菌、亚细胞器、细胞外囊泡等)以及人工合成纳米颗粒(如纳米金、纳米银、二氧化硅纳米颗粒、納米药物等)的粒径大小及其分布,在生物医学、生化分析、能源材料、环境监测等领域的研究中具有重要意义[1~9]。虽然透射电子显微镜、扫描电子显微镜、原子力显微镜等显微技术能够直观、清晰地揭示纳米颗粒的粒径和形貌[10],但是存在样品制备繁琐、测量速度慢、粒径分布缺乏统计代表性等缺点。基于光子相关光谱分析的动态光散射技术 (Dynamic light scattering, DLS) 能够快速、准确地测定分散于液体中单分散颗粒,但是对于粒径分布范围较宽的颗粒系,测量结果和可靠性较差。基于单颗粒散射示踪的纳米颗粒追踪分析技术 (Nanoparticle tracking analysis, NTA) 采用激光照射纳米颗粒悬浮液,通过高速相机对视野中的颗粒进行拍照,从而对每个颗粒的布朗运动轨迹进行追踪和分析,计算各自的流体力学半径; 然而,颗粒粒径分布相比于真实分布存在展宽,其准确性和分辨率有待提升[11]。相较于上述技术,流式细胞术 (Flow cytometry, FCM) 是一种对细胞或同等大小的颗粒进行快速的单颗粒多参数检测的技术,具有统计精确性高、数据可靠等优点[12]。然而,商品化流式细胞仪的散射检测下限是200~500 nm聚苯乙烯颗粒,难以满足各种功能化纳米颗粒以及病毒、细胞外囊泡等纳米颗粒的粒径表征需求[11]。
根据瑞利散射定律,当球形纳米颗粒的粒径小于波长的1/5时,其散射光强度随粒径的六次方衰减,当纳米粒子的粒径从200 nm减小到40 nm或25 nm,其大小虽然只下降5倍或8倍,但是散射光强度却降低15625倍或262144倍。结合瑞利散射和鞘流单分子荧光检测技术,本研究组成功研制出纳米流式检测装置 (Nanoflow cytometer, nFCM),将二氧化硅纳米颗粒 (SiO2 NPs)、纳米金颗粒 (AuNPs) 的散射检测下限分别降低至24 nm和7 nm,较传统流式细胞仪的散射检测灵敏度提升4~5个数量级[13]。该装置成功用于SiO2 NPs、纳米金、细菌、线粒体、病毒、纳米药物、细胞外囊泡等纳米颗粒粒径及分布的高分辨表征[14~19]。nFCM通常使用光电倍增管 (Photomultiplier tubes, PMT) 或单光子计数雪崩光电二极管 (Single photon counting avalanche photodiode, APD) 作为检测器。APD虽然灵敏度高,但是其最大光子计数值受限于APD的输出脉冲宽度和死时间,在很大程度上限制了nFCM的动态检测范围,难以对粒径分布较宽的样本(如粒径分布30~1000 nm的细胞外囊泡)进行全面的粒径表征。相比之下,PMT虽然具有较宽的动态范围,但是量子效率较低,难以检测粒径小、低折射率的纳米颗粒[20]。
针对细胞外囊泡、纳米药物等粒径小、粒径分布较宽的纳米颗粒样本的检测,本研究研制了高灵敏、宽动态范围的纳米流式检测装置,主要策略包括:(1)将圆形激光光斑整形为准平顶光斑,以保证颗粒在通过激光探测区时受到强度更均一的照射; (2)联合使用孔径光阑与矩形光阑,最大程度抑制背景信号; (3)采用高量子效率PMT,在宽动态检测范围条件下实现弱散射光信号的检测。此装置成功地应用于折射率小、异质性大的细菌外膜囊泡 (Outer membrane vesicles, OMVs) 的粒径分布测定。
2实验部分
2.1仪器与试剂
nFCM的光路如图1A所示,488 nm 激光器(20 mW,美国Coherent公司)发出的高斯光束经过反光镜M反射后被二元光学元件 (Binary optical element, BOE)[21]整形,再经消色差胶合透镜L聚焦成为10 μm × 5 μm的准平顶光斑。单个纳米粒子穿越激光探测区所发出的光信号被显微镜物镜O(日本尼康公司,40×)收集后,由FF500Di01二向色分光镜DicF(美国Semrock公司)分为两束光路(根据实验需求,可旋转DicF,使光束进入相应检测器),波长<500 nm的光被反射至PMT R928或者H7422PA40(日本滨松公司)进行散射检测,而波长>500 nm的光经过FF01520/35带通滤波片BP(美国Semrock公司)后,被第二个PMT R928接收,进行荧光检测。各检测器输出的电信号经过数据采集卡(美国National Instruments公司)进行A/D转换,信号采集和数据处理软件均由LabVIEW语言编程。
FEITecnai F20透射电子显微镜(德国TVIPS公司);BC106NVIS/M光束质量分析仪(美国Thorlabs公司);5810R冷冻离心机(德国Eppendorf公司);OptimaTM XE90超速离心机(美国Beckman Coulter公司)。
磷酸盐缓冲液 (Phosphate buffer saline, PBS, pH 7.4)、LB肉汤培养基 (LB broth power)、LB肉汤琼脂 (LB agar power),均购自上海生工生物工程有限公司,实验用水为超纯水。
2.2实验方法
2.2.1激光光束整形应用于激光光束整形的二元光学元件 (BOE) 是一种具有台阶状表面浮雕结构的衍射光学器件,通过对入射光进行相位调制,从而在输出焦面上形成期望的光斑形貌,實验中所用BOE由清华大学尤政教授课题组馈赠[21]。实验操作: 将BOE固定于三维平移台上,并置于激光出射端,使用激光光束质量分析仪对整形后的激光光斑进行实时反馈,通过微调平移台获得期望的光斑形状。以PMT R928为检测器。
2.2.2双光阑降低背景信号使用的光阑分别为可调孔径光阑 (美国Thorlabs公司),最小孔径为800 μm; 可调矩形光阑(北京大恒光电公司),安装于检测器前端,最小边长为100 μm。采用整形后的激光光束为激发光源,PMT R928为检测器,且PMT增益电压与2.2.1节无对应关系。
2.2.3高量子效率PMT模块提升灵敏度和动态范围检测器为H7422PA40型PMT,光电阴极材料为GaAsP,在峰值波长的最高量子效率 (Quantum efficiency, QE) 为40%。此模块由电流输出型光电倍增模块及跨阻器构成。为了对比新型PMT H7422PA40与传统PMT R928(匹配高压管座C1365401)的性能,这两款PMT被对称放置于光路的两侧,通过对二向色分光镜顺时针/逆时针旋转相同角度, 将光信号反射至相应检测器,以相同的光程对同一样本进行检测。在此实验中,以相同电流倍增率为标准分别设置两款PMT的控制电压,通过对比信噪比评估两款PMT的灵敏度。采用整形后的激光光束为激发光源,两款PMT均使用双光阑降低背景信号。
2.2.4样本准备所使用的SiO2 NPs均由本研究组合成,检测前用超纯水稀释,待用; 细菌OMVs来自于鼠伤寒沙门氏菌 (CMCC50115),由本实验室分离纯化获得。
3结果与讨论
3.1激光光束整形
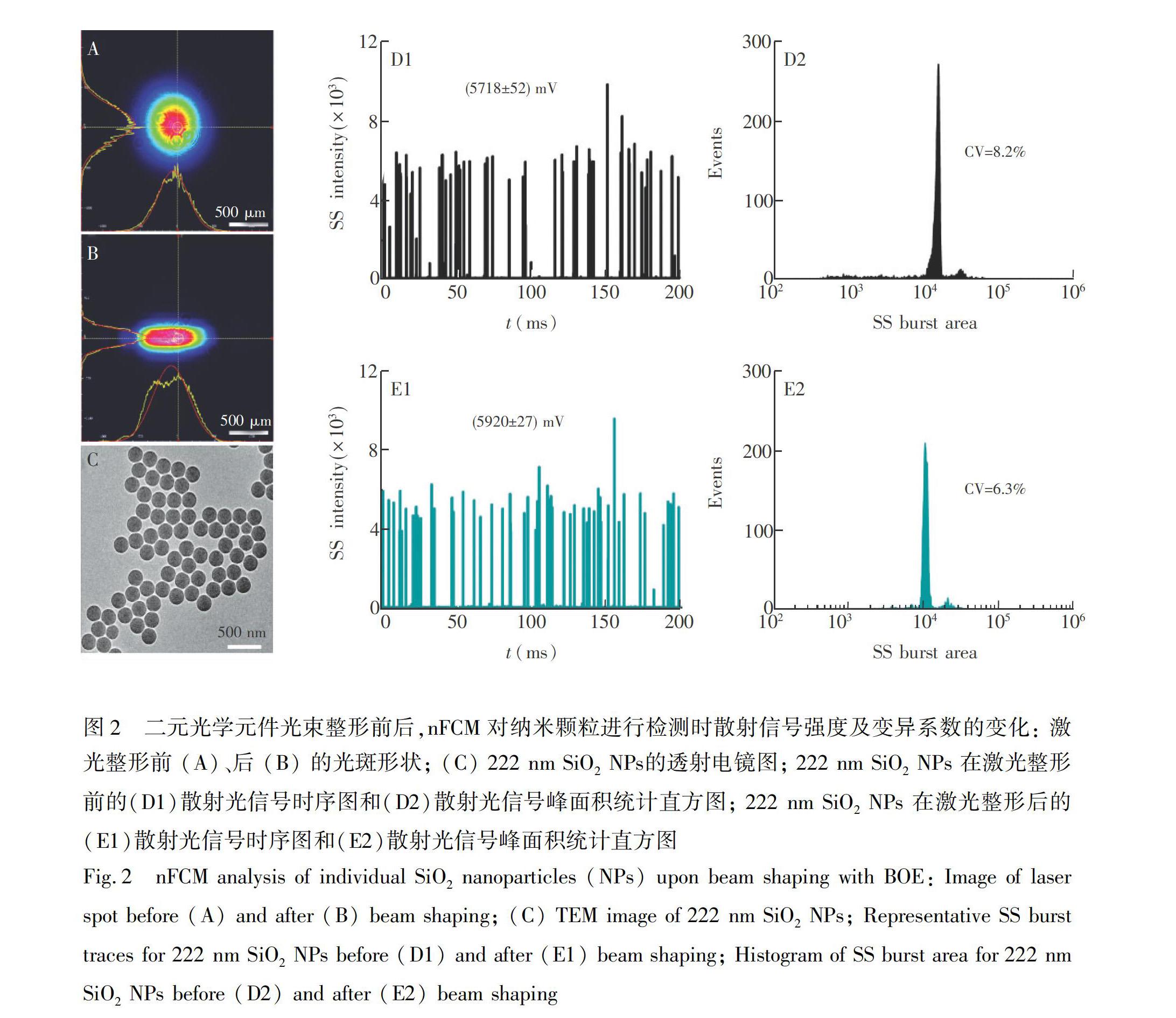
纳米流式检测装置使用的激光器的发射光束为光强呈高斯分布的圆形光斑,当样本颗粒经过流体动力学聚焦后, 穿越激光探测区时,如若偏离样品流中心线, 将会导致所受激光照射强度的差异,使得样品信号展宽,从而增大样品检测的变异系数 (Coefficient of variation, CV),导致仪器分辨率降低[22]。因此,为了提高仪器分辨率,使用BOE将直径为0.7 mm的圆形激光光束(图2A)整形为准平顶光束(图2B),并通过消色差双胶合透镜聚焦为10 μm × 5 μm光斑。以直径222 nm的SiO2 NPs为试样,考察激光整形前后nFCM的分辨率变化。透射电镜的实验结果表明,SiO2 NPs粒径非常均一((222 ± 3) nm, n=200), CV仅为1.4%(图2C)。图2D1为整形前SiO2 NPs的散射光 (Side scattering, SS) 信号时序图,每个峰代表单个纳米颗粒穿越激光探测区所发出的散射光信号,1 min内对上万个颗粒进行检测,散射信号强度为 (5718 ± 52) mV,散射信号峰面积的CV为8.2%(图2D2); 激光光束整形后,光强分布更加均一,SiO2 NPs散射信号强度略增((5920 ± 27) mV,图2E1),散射光信号峰面积统计直方图更加符合对称的正态分布且峰形变窄,CV下降至6.3%(图2E2)。实验结果表明,将圆形高斯光斑整形为准平顶光斑,可提升仪器的分辨率。
3.2双光阑降低背景信号
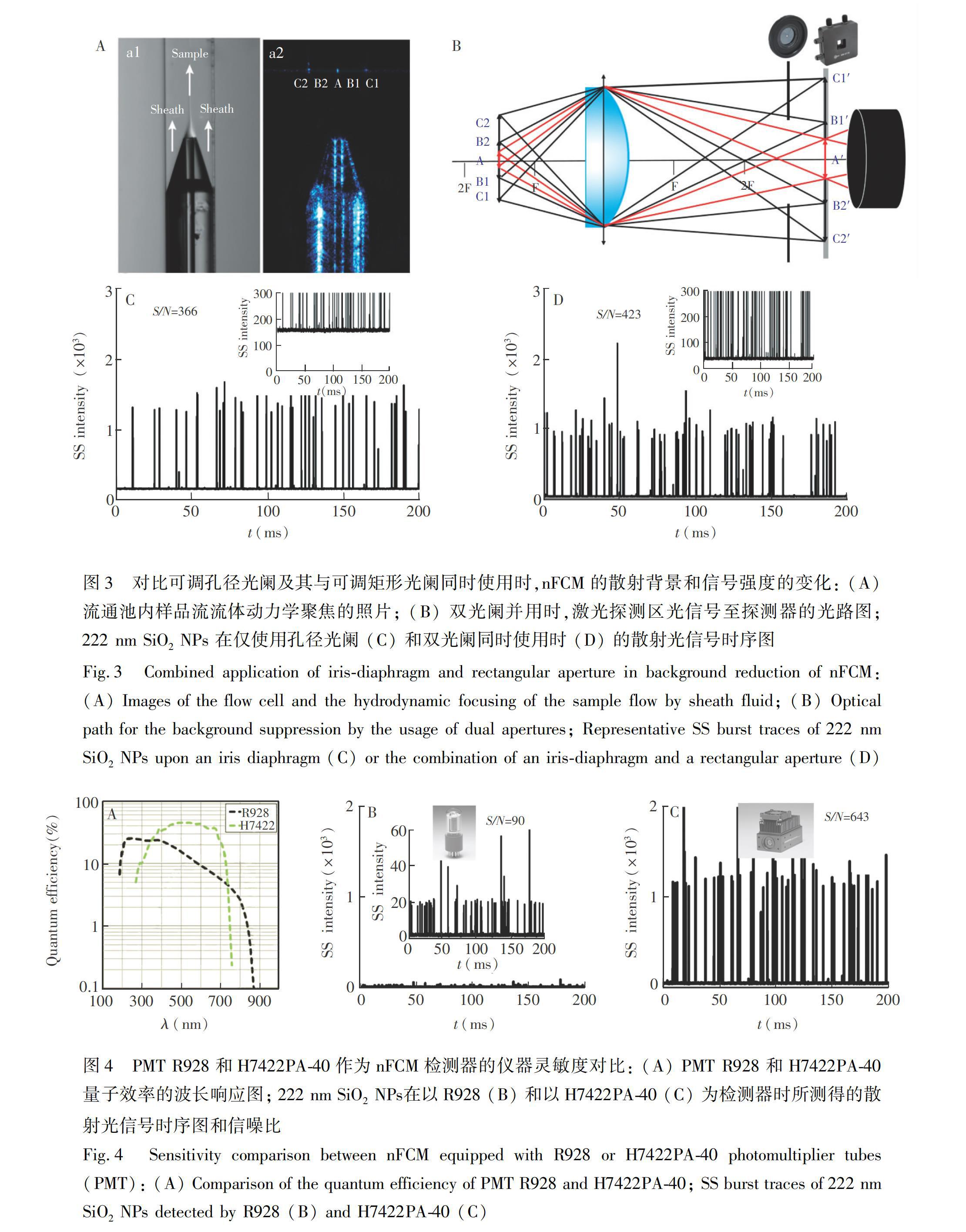
流式细胞仪的灵敏度主要取决于背景噪声和信号检测效率[23]。其中,散射通道的背景噪声主要来自于激光探测区的界面(如光窗)散射以及鞘液杂质颗粒的瑞利散射[12]。由于背景信号与探测区体积呈正比,研制纳米流式检测装置的主要策略是减小探测区体积,同时使用可调节式孔径光阑以限制石英池光窗散射信号进入检测器,从而提升检测信噪比。然而,在使用可调节式孔径光阑过程中,样品信号和背景信号随着光阑孔径的减小而同时下降,在保持纳米颗粒信号不变的情况下,最大程度降低背景信号是提升仪器灵敏度的关键。为了进一步减少激光探测区鞘液及样品流的瑞利散射背景,联合使用孔径光阑 (φ 0.8~12 mm) 和矩形光阑 (0.1 mm × 0.1 mm~12 mm × 12 mm)。由流通池照片(图3A)可见到石英池光窗侧壁(C1和C2)及样品流中心颗粒的散射信号。图3B为简化俯视光路图,A为纳米颗粒的有效信号点,B1AB2为样品流及部分鞘液区域,B1C1及B2C2为鞘液区域。激光探测区的光信号被40×显微镜物镜收集、经二向色滤光片(图中略去)和组合光阑后到达检测器。首先,使用孔径光阑限制来自于石英池两侧(C1和C2)及部分鞘液区域 (B1C1, B2C2) 的光线进入检测器,通过微调矩形光阑,仅使得样品液及部分鞘流发出的光线能进入检测器,当试样颗粒信号基本不变而背景信号最低时,确认为最佳光阑调节状态。以222 nm SiO2 NPs为试样,当仅使用孔径光阑时,背景信号强度≈180,样品检测信噪比为366(图3C); 同时使用孔径光阑和矩形光阑时,背景信号强度降低至约30,样品检测信噪比提升至423(图3D)。实验结果表明,孔径光阑及矩形光阑的联合使用可有效降低背景信号,提高nFCM检测装置的灵敏度。
4Beik J, Khateri M, Khosravi Z, Kamrava S K, Kooranifar S, Ghaznavi H, ShakeriZadeh A. Coord. Chem. Rev., 2019, 387: 299-324
5Wu Z P, Wang Y L, Liu X B, Lv C, Li Y S, Wei D, Liu Z F. Adv. Mater., 2019, 31(9): e1800716
6Li T T, Shi S X, Goel S, Shen X, Xie X X, Chen Z Y, Zhang H X, Li S, Qin X, Yang H, Wu C H, Liu Y Y. Acta Biomater., 2019, 89: 1-13
7Jin W, Maduraiveeran G. Trends Environ. Anal., 2017, 14: 28-36
8Bai X, Wang S Q, Yan X L, Zhou H Y, Zhan J H, Liu S, Sharma V K, Jiang G B, Zhu H, Yan B. ACS Nano, 2020, 14(1): 289-302
9Homaeigohar S, Kabir R, Elbahri M. Sci. Rep., 2020, 10: 5191
10Zhou J J, Chizhik A I, Chu S, Jin D Y. Nature, 2020, 579(7797): 41-50
11Vanderpol E, Coumans F A W, Grootemaat A E, Gardiner C, Sargent I L, Harrison P, Sturk A, van Leeuwen T G, Nieuwland R. J. Thromb. Haemost., 2014, 12(7): 1182-1192
12Shapiro H M. Practical Flow Cytometry; Hoboken: John Wiley & Sons, Inc., 2003
13Zhu S B, Ma L, Wang S, Chen C X, Zhang W Q, Yang L L, Hang W, Nolan J P, Wu L N, Yan X M. ACS Nano, 2014, 8(10): 10998-11006
14Zhu S B, Yang L L, Long Y, Gao M, Huang T X, Hang W, Yan X M. J. Am. Chem. Soc., 2010, 132(35): 12176-12178
15Yang L L, Zhu S B, Hang W, Wu L, Yan X M. Anal. Chem., 2009, 81(7): 2555-2563
16Zhang S Y, Zhu S B, Yang L L, Zheng Y, Gao M, Wang S, Zeng J Z, Yan X M. Anal. Chem., 2012, 84(15): 6421-6428
17Ma L, Zhu S B, Tian Y, Zhang W Q, Wang S, Chen C X, Wu L N, Yan X M. Angew. Chem. Int. Edit., 2016, 55(35): 10239-10243
18Chen C C, Zhu S B, Wang S, Zhang W Q, Cheng Y, Yan X M. ACS Appl. Mater. Interfaces, 2017, 9(16): 13913-13919
19Tian Y, Ma L, Gong M F, Su G Q, Zhu S B, Zhang W Q, Wang S, Li Z B, Chen C C, Li L H, Wu L N, Yan X M. ACS Nano, 2018, 12(1): 671-680
20Lawrence W G, Varadi G, Entine G, Podniesinski E, Wallace P K. Proc. SPIE, 2008, 6859: 68590M
21Zhao J J, You Z. Biomicrofluidics, 2016, 10(5): 054111
22Shapiro H M. In Current Protocols in Cytometry: John Wiley & Sons, Inc., 2001: 1.6.1-1.6.5
23Perfetto S P, Chattopadhyay P K, Wood J, Nguyen R, Ambrozak D, Hill J P, Roederer M. Cytometry A, 2014, 85(12): 1037-1048
24Zhang W Q, Tian Y, Hu X X, He S B, Niu Q, Chen C, Zhu S B, Yan X M. Anal. Chem., 2018, 90(21): 12768-12775
25The MicroPlus Flow Cytometer, Apogee Flow Systems, http://www.apogeeflow.com/products.php
26Roier S, Zingl F G, Cakar F, Durakovic S, Kohl P, Eichmann T O, Klug L, Gadermaier B, Weinzerl K, Prassl R, Lass A, Daum G, Reidl J, Feldman M F, Schild S. Nat. Commun., 2016, 7: 710515
27Schulz E, Goes A, Garcia R, Panter F, Koch M, Muller R, Fuhrmann K, Fuhrmann G. J. Control Release, 2018, 290: 46-55
28Berleman J, Auer M. Environ. Microbiol., 2013, 15(2): 347-354
29Toyofuku M, Nomura N, Eberl L. Nat. Rev. Microbiol., 2019, 17(1): 13-24