组织样品大气压质谱分析研究
王雨芬 卢海艳 张华 陈焕文

摘要组织样品中含有丰富的生物分子信息,是代谢组学、脂质组学、蛋白质组学等研究的物质基础。近年来,大气压质谱分析(AMS)技术因具有无需样品预处理即可直接获取组织样品中生物分子种类及含量信息的能力,在组织样品分析中突显了高通量、高灵敏度、高准确性、低样品耗量的特点,已逐渐成为分析组织样品不可或缺的手段。本文以常见的植物、动物和临床术后组织样品为代表,介绍了近年来AMS技术在组织样品分析中的应用进展,结合成像技术,讨论了组织样品AMS的发展趋势。
关键词大气压质谱; 组织分析; 质谱成像; 评述
1引 言
组织样品中含有丰富的代谢产物、蛋白质等生物分子,是采用质谱(MS)技术进行代谢组学、脂质组学、蛋白质组学等研究的物质基础[1]。传统质谱技术(包括液相色谱质谱(LCMS)技术和气相色谱质谱(GCMS)技术等)对组织样品分析时,需要对样品进行研磨、萃取、分离等预处理,极大地制约了样品高通量分析的实际需求。AMS技术为直接分析复杂基体样品提供了可能[2],例如,电喷雾解吸电离(DESI)技术[3]、空气动力辅助解吸电喷雾电离(AFADESI)技术[4]、表面解吸化学电离(DAPCI)技术[5]、实时直接分析(DART)技术[6]、智能手术刀(iKnife)[7]、SpiderMass[8]及“神笔”(MasSpec Pen)[9]等已广泛应用于各类组织样品的研究,并为组织样品的大气压质谱成像(MSI)提供了新的思路[10]。
大气压质谱分析的显著特点是:各种复杂实际样品无需预处理或仅需简单预处理,常温常压条件下对待测样本中目标分子进行电离,以质谱仪进行高灵敏、高选择性在线检测。因此,只要符合这一特征的技术,都可认为是大气压质谱分析的范畴。目前,已有很多综述对AMS技术原理及其发展历程做了详细介绍[11~13]。因此,本文介绍了近年来各种大气压质谱分析及成像技术在植物、动物和临床术后组织样品分析中的应用,展望了其在组织样品分析方面的发展趋势和面临的挑战。
2植物组织分析
植物组织的大部分天然产物在人们生产生活中发挥着重要的作用,是传统药物研制及香料、色素、调味品、化妆品等重要工业原料的来源,但是也包含了很多有害物质(如毒性成分或者农残),给人体健康带来了潜在的危险。传统分析方法耗时费力,不适合大量样品筛选。AMS技术可以快速、原位分析不同维度的组织样本,如部分组织的表层、浅表层甚至是组织内部,同时结合成像技术表征了组织中分子的分布信息。
2.1组织表层分析
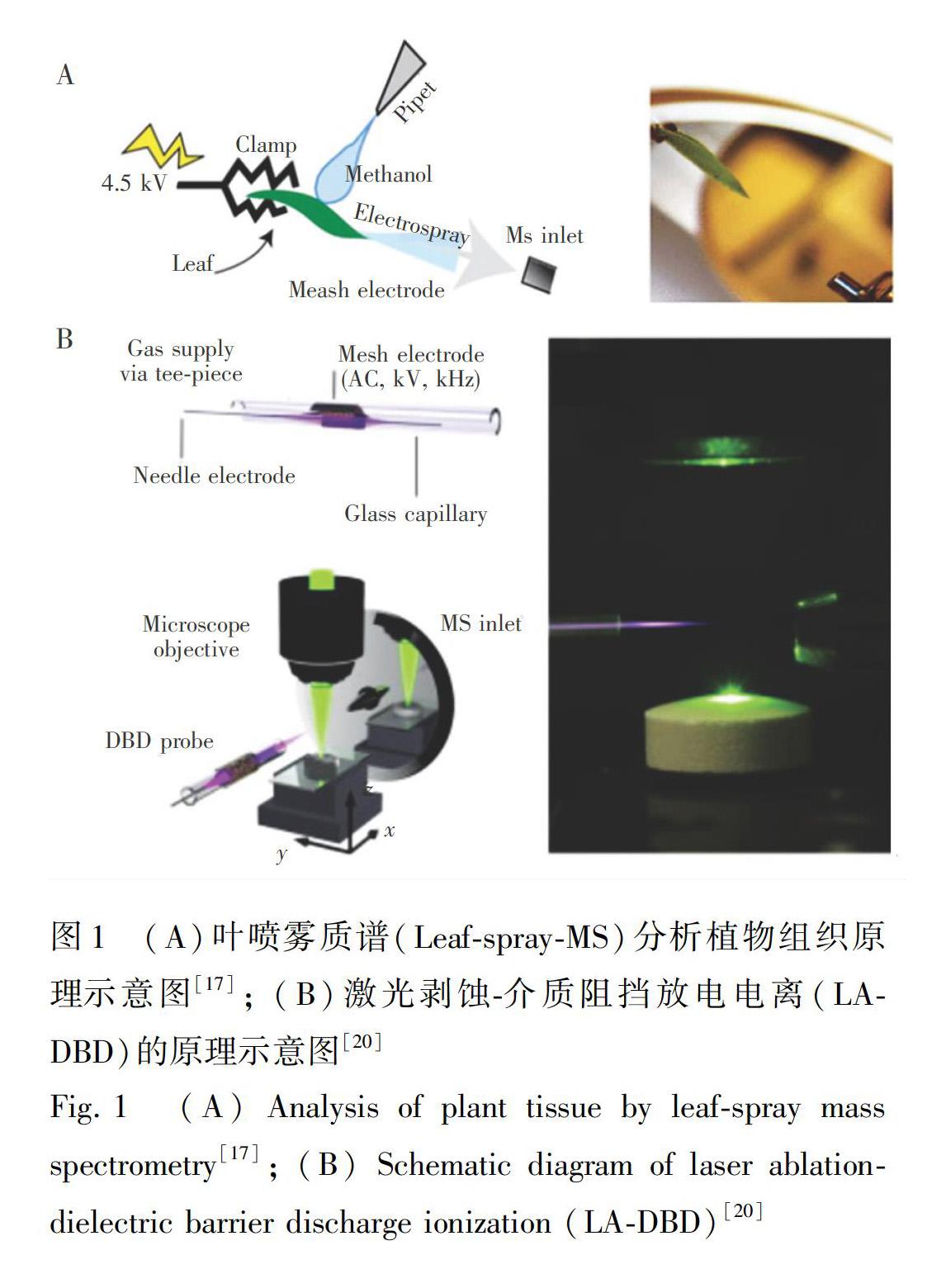
植物不同部位组织的质地及其含有的化合物在性质上具有一定的差异性,因此选择适宜的AMS技术对其进行灵敏检测是必要的。基于电喷雾离子化的DESI依靠喷雾溶剂从样品表面解吸目标物,是目前使用最广泛的一种技术。例如,部分植物组织质地相对较硬,传统质谱技术需进行常规研磨后再用溶剂进行萃取,操作过程比较耗时且费力。Klejdus等[14]首次对桂皮进行简单处理,运用DESIMS对其中的酚类代谢产物进行检测,为分析传统药物中的活性成分提供了有效手段。另外,AMS 技术还可鉴别植物表面的农残等有害物质,为保障农产品安全提供了技术支撑。例如,Rocca等[15]采用DESIMS定量测定了橄榄和葡萄藤叶片表面的乐果、肟菌酯、戊唑醇等农残。植物表皮细胞的腺毛能够分泌特殊的代谢产物,可根据检测的化合物推测且阐明细胞类型,为研究植物代谢新机制提供新手段[16]。传统的LCMS等使用研磨法进行预处理,不能实时在线分析,无法确定细胞类型。Freund等[17]利用叶喷雾质谱(LeafsprayMS)技术,直接分析了美国甘草完整叶片组织表面的异黄酮、黃酮等代谢成分,快速鉴定了腺毛层的代谢产物,有助于阐明细胞类型(图1A)。另外,基于等离子体的大气压电离方法(包括DART、介质阻挡放电电离(DBD)、低温等离子体探针电离(LTP)等),因其简单、便携、低功耗等特点被广泛应用到植物组织分析中。例如,Prchalova等[18]运用DARTMS直接表征了多种草药茶中不同部位的根、叶、花和果实中的糖苷、黄酮类、酚类和萜烯类成分,利用主成分分析法(PCA)区分了不同种类的中草药且有效监控其品质问题。采用激光促进样品解吸的大气压质谱离子源,其相比于单一的离子源(电喷雾或等离子体),将二者耦合不仅缩短了时间,还减少了所需样本量,更有效地促进解吸,具有更高的灵敏度[19]。例如,Bierstedt等[20]将激光剥蚀(LA)与DBDMS结合分析了辣椒中的生物碱,大大提高了灵敏度和响应时间等分析性能(图1B)。
目前,研究人员对植物防御功能的研究较多。AMS技术为从分子水平揭示植物防御功能机理提供了手段,其不仅为设计开发具备耐受环境侵害且高产量的农作物产生影响,一定程度上也为阐明人类疾病发生机制提供参考。如Martinez Jarquin等[21]采用LTPMS在线监测了烟草组织受损后尼古丁的生物合成途径,发现烟草组织受损后,其根部组织会合成尼古丁,然后运输到叶片,评估了其可能存在的生物防御效应。另外,植物防御机制涉及的有机硫化物,因其留存时间不长,在一般分析技术条件下容易降解,大气压质谱技术可以弥补其缺陷,对其进行原位追踪。He等[22]采用DARTMS技术成功追踪了部分葱属类中的硫化物,结合同位素标记对其进行了定量分析。
2.2组织内部分析
大气压质谱分析技术已广泛应用于分析植物组织的浅表层或表层,然而大部分常规离子源很难从组织内部获取生物信息,限制了其进一步应用。针对这些问题,本课题组于2013年提出了内部萃取电喷雾电离质谱(iEESIMS)技术[23,24],在不破坏样品的前提下直接获取凝聚态整体组织样品(如动植物和人体组织)内部的化学信息。例如, Zhang等[25]运用iEESIMS鉴定了脐橙中的高极性化合物(氨基酸、生物碱、糖)。另外,iEESIMS在监测组织中的不稳定活性物质体现了其优势。例如,Zhang等[26]运用iEESIMS对大蒜中酶促反应进行了直接表征,成功监测了不同外界刺激条件下蒜氨酸在蒜氨酸酶作用下转化为蒜素的动态代谢过程,拓展了大气压质谱分析技术的具体应用范围。然而,iEESIMS主要用于分析凝聚态软质固体样品。最近,本课题组Shen等[27]在电喷雾电离(ESI)的基础上设计了单粒电喷雾电离质谱(SGESI)技术,可以用来分析硬质固体样本,半定量分析了单粒水稻中的脂肪酸含量和有机农药等,检出限(LODs)为0.11~1.30 ng/g,区别了不同产地和储存时间水稻间的差异性,用于水稻的品质评价。
2.3组织大气压质谱成像分析
质谱成像是指将质谱技术和图像处理软件相结合的一种新型分子成像技术,能够直观提供样品中分子空间分布信息[28]。相比于传统的成像技术,大气压质谱成像无需荧光及同位素标记,能够保证样品原始的形态和特征无损,从而获取组织切片中的关键物质分布信息。同时,与二次离子质谱(SIMS)和基质辅助激光解吸质谱(MALDIMS)成像技术相比,大气压质谱成像技术不需要在高真空条件下进行测定,也不需要额外的基质辅助,可以进行实时原位分析,弥补了空间分析能力的局限性。
如前所述,植物中存在的天然活性成分,很多具有重要的生物学功能,研究其功能需了解这些物质在组织中的具体分布,大气压质谱成像技术可以原位对组织中的物质分布实现可视化。例如,Enomoto等[29]采用DESIMSI分析未成熟菜豆种子中的脱落酸(ABA)和12氧植物二烯酸(OPDA)的分布情况,利用大气压质谱成像技术首次实现了植物激素可视化分析。尽管成像技术弥补了AMS在空间可视化的缺陷,但是目前大气压质谱成像技术还尚未完全成熟,仍需提升空间分辨率和检测灵敏度等。激光剥蚀技术结合大气压离子源,具有较高空间分辨率且可以成像不规则表面,因其可以穿透组织细胞壁、角质层等表面而被广泛应用[30]。最近,Fowble等[31]基于DART开发了激光剥蚀实时在线分析(LADIMS)技术,首次分析了罂粟、木曼陀罗等中阿托品和东莨菪碱等物质合成过程中精氨酸、托品酮等的分布情况。Stopka等[32]在激光剥蚀电喷雾电离成像(LAESIMSI)技术上结合21特斯拉傅里叶变换离子回旋共振质谱(21TFTICR),提高了分辨率,监测了叶片组织叶绿素a的同位素结构信息及其分布情况,为识别同位素分子提供了新的平台。Moreno等[33]在LTPMSI系统上安装了激光解吸(LD),对仙人掌中的麦司卡林、曼陀罗种子中的阿托品及烟草幼苗中的尼古丁等空间分布情况进行了分析,研究结果表明,生物碱可能主要富集在害虫出现的区域,揭示了植物防御中的生物学功能。
3动物组织分析
大气压质谱结合成像技术用于动物组织分析主要包括监测动物组织中内源性物质及外源性物质,具体在病理研究、药物研究、环境监测和食品安全等领域研究颇多。
3.1内源性物质分析
目前,对动物组织中的内源性物质进行分析常涉及病理研究,实时检测生物体内内源性物质的动力学特征是分析检测和生物领域的挑战之一[34]。大气压质谱为活体生物分析提供了可能,能够在活体内原位检测内源性物质。例如,Zaitsu等[35]采用探针电喷雾串联质谱(PESIMS/MS)实时分析了注入1型大麻素受体(CB1R)后小鼠脑组织中能量代谢物的动力学特征,发现CB1R会破坏大脑脑组织中的能量代谢过程。通常,大脑组织具有区域功能,因此, 对不同区域的代谢产物进行研究是必要的。Hayashi等[36]采用PESIMS/MS直接分析了小鼠大脑海马区和额叶皮中25种代谢产物,MS/MS提高了检测的灵敏度,运用PCA很好地区别了海马区和额叶皮组织,同时揭示了额叶皮质和海马区组织代谢水平的差异性,为病理研究提供全面有效的参考价值。近年来,越来越多的研究表明生物体内的脂质常常和某些疾病的发生密切相关,如阿尔兹海默症病、糖尿病及癌症等[37]。利用大气压质谱成像技术,根据生物体内代谢产物的含量和分布,进一步推测代谢途径及病理关系。Bergholt等[38]运用 DESIMSI分析了大鼠脑组织中的脂质和多发性硬化症的关系,首次表明多发性硬化癥中的再生髓鞘和正常髓鞘中的磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)的差异性。Wang等[39]将三氟乙酸作为添加剂提高DESIMS检测脑组织中胆固醇和其它代谢产物的灵敏度,发现阿尔兹海默症病(AD)小鼠脑组织切片中胆固醇含量相对偏高。结合成像技术发现小脑、脊髓、髓质等区域的胆固醇含量增加,还发现大脑不同区域的天冬氨酸、谷氨酸及次黄嘌呤等分布的差异性, 揭示其在神经学科等领域的潜在应用,为寻找AD潜在生物标记物提供了有价值的信息。Yin等[40]等运用纳米解吸电喷雾电离质谱成像(nanoDESIMSI)技术对小鼠胰岛中的PC、鞘磷脂(SM)、磷脂酰肌醇(PI)等脂质进行空间定位,分辨率可以达到11 μm,发现胰岛和其周围组织中的脂质存在差异性,这可能与胰岛素的分泌过程有关,有望揭示疾病发生的基本机制。然而, 脂质物质包含着大量的同分异构体,不同结构的异构体在疾病的发生发展过程中可能发挥不同的作用[41]。近年来,对不饱和脂质异构体中双键位置进行研究成为脂质组学研究的热点。例如,Tang等[42]利用液相微临界表面取样探针质谱(LMJSSPMS)耦合PaternòBüchi(PB)光反应分析正常小鼠乳腺组织和乳腺癌小鼠中不饱脂质位置异构体的差异性,结合MS/MS研究发现,磷脂(PC16∶0/18∶1)位置异构体中(9Z)/(11Z)含量的比值明显存在差异。最近,Waldchen等[43]运用基质MALDIMSI耦合PB光反应,用二苯甲酮作为新型反应基质,分析了小鼠脑组织白质和灰质中不饱和脂质位置异构体分布的差异性。然而,目前利用大气压质谱成像技术分析组织中脂质异构体的分布相关研究甚少,此方法的进一步发展将会成为很有前途的脂质组学研究手段。
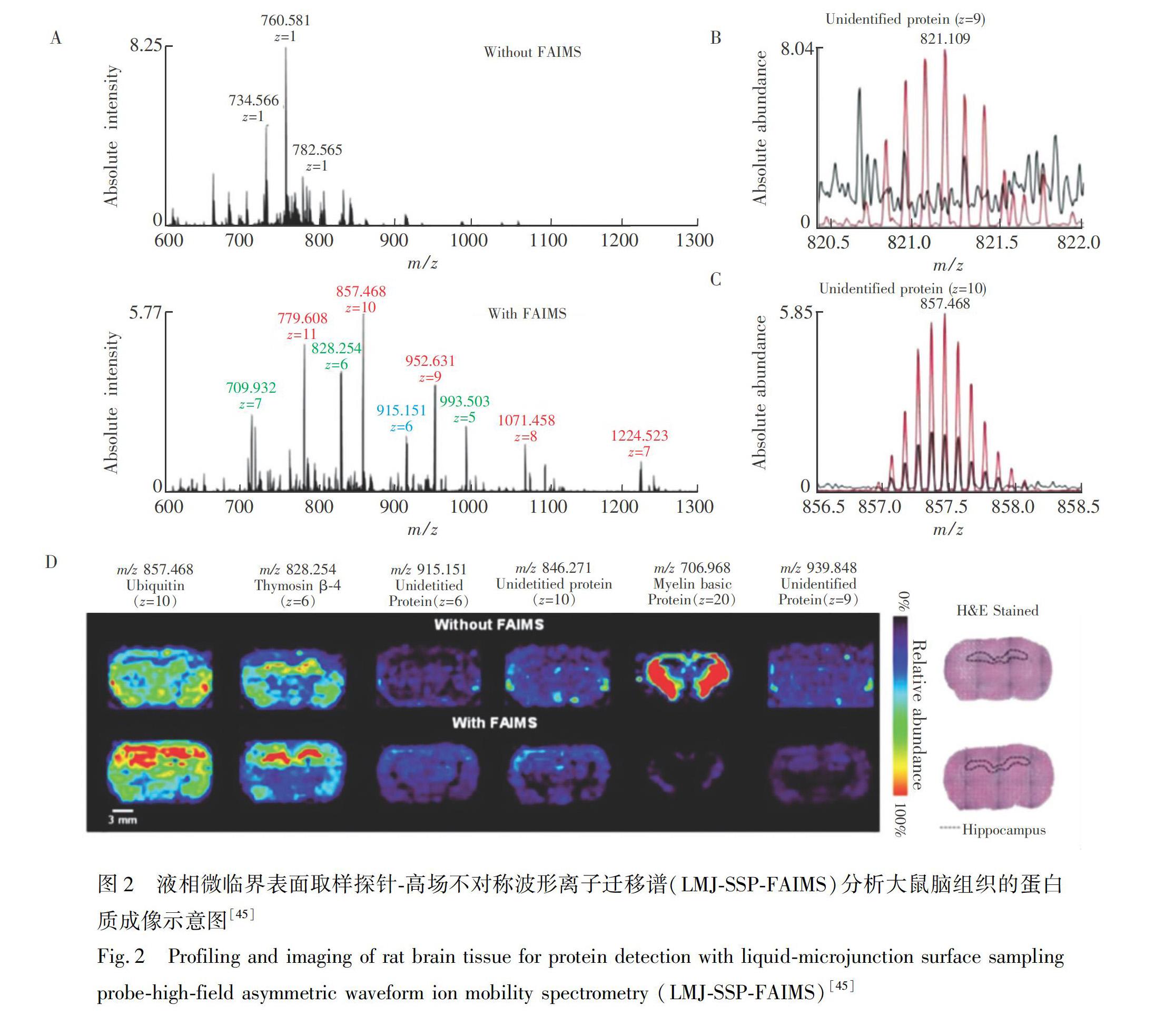
基于质谱的疾病蛋白组学研究也是当前的研究热点,通过寻找疾病特应性蛋白可以为药物设计提供丰富的靶点,在新药物开发中具有重要意义。但是,蛋白质等大分子很难从样品中解吸,同时也受到小分子物质的抑制作用,因此直接在生物样品上鉴定蛋白质等大分子信息仍然具有挑战性[44]。目前,MALDIMSI在组织切上可以得到单电荷蛋白质大分子的空间部分情况,但是其需要另外的基质辅助,具有一定的局限性。大气压质谱成像可以直接对生物样品上的大分子蛋白成像,而且可以检测多电荷的离子,扩大了分析范围。 例如,Feider等[45]将LMJSSP和高场不对称波形离子迁移谱(FAIMS)结合对大鼠脑组织进行二维(2D)成像,FAIMS可以明显增强生物组织中的多电荷蛋白成像能力,可视化大鼠脑组织中的84种多电荷蛋白质,图像清楚地显示了大鼠脑白质中含有更多的蛋白质(图2)。Hsu等[46]无需胰蛋白酶前期处理,将显微镜和nanoDESIMS结合自上而下分析了成年水蛭神经节中的多电荷神经血红蛋白,同时结合肽序列标签法确定了编码多肽的基因。
近年来,仿生材料已成为材料科学与工程发展的重要研究方向之一,且仿生材料的一个重要应用领域就是生物医用材料[47]。自然界中生物的表面具有特殊性质,对材料科学领域提供了新的思路,因此对其进行直接分析十分必要。Roman等[48]运用LAESIMSI对干燥、薄的生物样品表面直接分析成像,鉴别了蝉的翅膀中烃类、脂质、酯类、胺类、酰胺类等化合物的分布情况, 用于阐明天然生物材料的物理结构化学成分生物功能间的关系,为研究功能生物材料奠定了一定的基础(图3A)。
3.2外源性物质分析
3.2.1药物研究及环境监测药物研发过程中,了解药物在动物组织的靶向分布及原位信息对于药物吸收、代谢等情况具有重要意义,同时对药效动力学及毒理学评价等研究也具有指导作用,大气压质谱成像技术为其提供了技术支撑[49]。例如,Xu等[50]采用液相萃取表面串联质谱分析(LESAMS/MS)分析了罗替戈汀在大鼠脑组织不同区域的分布情况,最低定量限(LLOQ)为0.05 ng/mL,结合成像技术表明罗替戈汀分布在大脑中的海马区和纹状体区域。此外,Burns等[51]采用LMJSSPMS非靶向快速筛选和鉴定了牛肝、猪肾、马脾、马肾中的氟尼辛、替米考星、氯胺酮、戊巴比妥等的残留情况,用以兽医毒理学诊断。当今环境问题日益严峻,大气压质谱分析还可通过检测动物组织中积累的有毒化合物来监测环境污染程度。Perez等[52]运用DESIMSI首次报道了毒性液体季铵盐离子液体(AMMOENG 130)在斑马鱼全身的分布和代谢情况,用来监测环境中的污染物,为研究小型水生生物的生态毒理学开辟新的途径(图3C)。
3.2.2食品安全分析当今,人们对食品的安全及品质要求越来越高,大气压质谱技术为食品安全提供了有效可行的手段,在原位监测食品安全和质量等方面具有广阔的应用前景。Chakrabarty等[53]基于大气固体分析探针(ASAPMS)技术和改良电喷雾电离质谱(MDESIMS)技术快速半定量分析了羊肉切片中齐帕特罗的含量,结果表明, ASAP检测的LOD为0.4~1.0 ng/g,LOQ为0.4~1.2 ng/g,MDESI的LOD为0.2~0.6 ng/g,LOQ为0.5~2.1 ng/g,体现了其在食品安全质控方面的潜在应用价值。卢海艳等[54]运用iEESIMS技术定性检测了猪肉中的克伦特罗和丙卡特罗,Xu等[55]定量分析了猪肉中6种瘦肉精的含量,线性检测范围0.01~1000 ug/kg(R2>0.9994),LOD為2 ng/kg(图3B)。另外,Lu等[56]直接从分子水平研究了克伦特罗和沙丁胺醇代谢对猪肉品质的影响,研究发现磷脂酰胆碱的含量与猪肉品质密切相关。
4临床术后组织分析
当前, 在中国,80%的疾病死亡率是由癌症引起的[57]。基于大气压质谱成像分析的性能优势,目前已应用到临床术后多种癌症类型组织的研究中(如脑胶质瘤、甲状腺癌、食管癌、乳腺癌、卵巢癌、前列腺癌、大肠癌、皮肤癌等),利用其对组织进行原位代谢、蛋白组学等的研究,进而更全面、高通量地表征肿瘤微区域环境代谢等的变化,为在临床上对肿瘤边缘进行评估、潜在标志物的寻找、研究肿瘤代谢机制、靶向肿瘤药物研制等提供新的视角,作为癌症诊断的潜在临床新方法,大气压质谱成像技术为其诊断提供了广阔前景[58,59]。
4.1体外分析
当前,临床术中边缘评估操作流程繁琐,需要冷冻切片、染色和显微镜观察,而且只能在形态上识别癌症边缘,难免存在人为误判断的潜在风险,也无法提供分子水平的信息。常规的质谱技术(LCMS)处理组织样本不仅费时,而且处理后的样本无法再进行后续的组织学研究。AMS技术能对新鲜或冷冻的组织样品进行原位分析,保留了样品的关键特征的同时还可进行后续的组织学研究[60]。 Pirro等[61]在手术室中仅用3 min,直接对脑胶质瘤新鲜组织切片进行了边缘评估,无需冷藏切片,直接分析了样本中的脂质,研究发现, DESIMS具有93%的敏感性和83%的特异性。Ashizawa等[62]建立了一种快速准确的术中评估方法(该过程仅需约5 min),运用PESIMS识别头颈部鳞状细胞癌的肿瘤边缘,结合偏最小二乘回归(PLS)统计学方法和逻辑回归分类(LR)模型算法,在正离子和负离子模式下,该方法的准确率分别为临床病理诊断的90.48%和95.35%。目前,小型质谱仪也运用到疾病诊断中。Zou等[63]将纳升电喷雾电离(nanoESI)和Mini 12小型质谱结合,实时检测了脑胶质瘤活检组织样品中的2羟基戊二酸(2HG),充分展现其在医疗检测领域的巨大潜力。然而,小型质谱仪的灵敏度和特异性不高,对组织样品直接进行鉴定具有一定的局限性。
肿瘤细胞通过代谢重新编程以适应其恶性增殖,是区别于正常细胞的重要特征[64]。因此癌变组织与健康组织间存在复杂的代谢差异,大气压质谱成像可以量化这些化学差异,是在分子水平上对肿瘤组织可视化的有力工具,从样品上挖掘出更多的信息,获取待测分子间的空间关系,对肿瘤代谢进行深入表征, 能够为研究其发病机制及发现潜在诊疗靶点提供新的契机。例如,Margulis等[65]采用DESIMS对微米级别的基底细胞瘤(BCC)中的脂质和代谢产物进行二维(2D)成像,并采用最小绝对收缩和选择算子(Lasso)对健康皮肤组织和BCC进行了区别。Zhang等[66]运用DESIMS对甲状腺组织进行2D成像,发现心磷脂在癌变组织中含量相对较高,可以作为潜在的生物标志物。Sun等[67]提出了“下游代谢物关联上游代谢酶”的肿瘤代谢表征策略,利用空气动力辅助解吸电喷雾电离质谱成像(AFADESIMSI)技术在空间上对256例食管鳞状细胞癌(ESCC)患者组织中的各种代谢途径进行了研究,发现了与代谢途径改变密切相关的异常表达的代谢酶,它们广泛参与ESCC的癌变过程,首次发现PYCR2和UPase1在ESCC组织中差异表达(图4A)。Banerjee等[68]运用DESIMS结合成像技术分析了54例前列腺正常和癌变组织中的小分子脂质和代谢产物差异性,同时监测了三羧酸循环过程的中间体物质,发现与正常组织相比,利用癌变组织中葡萄糖和柠檬酸根离子强度的比值可以区分前列腺癌变组织与正常组织(图4B)。
此外,直接对组织的天然蛋白进行成像是目前研究的重点,同时也是所面临的挑战之一,寻找特异性蛋白对于临床上诊断癌症有着重要的意义。例如,Feider等[45]采用LMJSSPFAMSIMS对高级别浆液性卵巢癌(HGSC)组织中的蛋白质(泛素、胸腺素β4、血红蛋白、钙周期蛋白)进行2D成像,研究发现肿瘤区域的泛素、胸腺素β4及钙周期蛋白等相对含量多,这是首次在人类癌症组织进行蛋白成像的研究。之后,Garza等[69]采用DESIFAMSIMS结合紫外光解离(UVPD)和碰撞诱导解离(CID)自上而下鉴定了乳腺组织中的16种蛋白质,分析了Her2导管乳腺癌和正常组织,发现正常组织中的前纤维蛋白1和血红蛋白α等相对含量较高,而S100蛋白在肿瘤组织含量较高(图4C)。目前,大部分成像技术还是基于2D成像,如果能够在三维(3D)空间内对肿瘤中化学成分进行描述,就有可能对其生物组成、相互作用和异质性原因做出解释。例如,Inglese等[70]运用DESIMS结合成像技术分析直肠癌组织,将其得到的2D代谢产物图像进行3D重建,对研究肿瘤异质性、研发肿瘤靶向药物及个体化肿瘤治疗具有重要意义。
4.2体内分析
大气压质谱在临床上潜在的应用须使其在术中发挥作用,运用到体内分析,进而实时诊断,而大气压质谱离子源的不断开发是非常必要的。目前,iKnife、SpiderMass及MasSpec Pen等方法有望用于体内实时诊断。iKnife 是目前开发的第一个手持式质谱分析仪,其能够通过外科设备产生的热进而诱导样品分子气化和电离,进而对手术过程中产生的烟雾实时分析,能帮助外科医生切除更多的癌变组织,同时还可以降低对肿瘤周边组织的伤害,用于体内癌症诊断[71]。例如,John等[72]采用REIMS分析了正常乳腺和癌变乳腺组织中脂质代谢化合物的不同,研究发现, 癌症组织中的磷脂(m/z 600~850)物质含量较高,甘油三酸脂(m/z 850~1000)的含量相对较低,同时提出了体内实时评估肿瘤边缘的概念模型,具有提升术中肿瘤边缘评估的精准率的潜在能力。Alexander等[73]开发了一种内窥镜REIMS,实时分析了大肠癌中的脂质信息,并提出了该装置在术中对5名患者进行体内分析的可行性。Phelps等[7]預先使用冷冻的卵巢组织建立模型,然后再用新鲜组织进行验证。运用REIMS对良性卵巢组织、交界性肿瘤和癌组织诊断的敏感性分别为87.0%、71.4%和87.2%,一定程度上说明了REIMS作为术中卵巢癌诊断的可行性(图5A)。与iKnife分析系统不同,SpiderMass的主要优势是侵入性较小,所需要的组织样本量仅为0.1~0.3 mm3。Fatou等[8]运用SpiderMass系统体外对正常卵巢组织和卵巢癌组织进行了研究,发现癌变组织中磷脂的相对丰度很高,具有在术中评估肿瘤边缘的潜在能力。此外,利用其在体内对手指表面的皮肤组织与损伤组织进行了分析,说明SpiderMass能够在微创条件下进行体内实时分析(图5B)。Zhang等[9]运用MasSpec Pen离体分析253个组织样本,包括正常和癌变的肺、卵巢、甲状腺及乳腺组织,能够在短时间(几秒钟)区分癌变组织和正常组织,是目前病理诊断手段所需时间的1/150(图5C)。
5总结和展望
本文主要对大气压质谱分析技术在植物、动物和临床术后组织方面的研究进展进行了总结,结合成像技术开展大量与组织样本相关的研究工作,主要应用集中在药物研发、疾病诊断、食品安全、环境监测等领域。然而,大气压质谱和成像技术在某些方面还面临着严峻的挑战,例如,对没有预处理的组织样本直接定量分析是当前亟需解决的问题。在定性分析的基础上,实现精准定量依然是核心研究领域。 今后,大气压质谱技术完全运用到临床癌症诊断中,必需解决如何定量的问题,精确判定“量变到质变”的分子界限; 其次,仪器分析的灵敏度、分辨率等需要进一步提高。围绕这些挑战,大气压质谱和成像技术在当前需要重点研究的内容包括以下几个方面: 首先,需进一步开发新型的大气压质谱电离平台以及小型化的质谱仪,尤其能够实现采样过程自动化,灵敏地对组织中的各类物质进行有效电离并且检测的质谱仪,同时向小型、便携、简单的方向发展,对现场实现真正的原位分析,尤其在临床疾病诊断中,使其能够适用于体内分析; 其次,大气压质谱成像作为新型的质谱成像技术,需进一步提高成像的空间分辨率、灵敏度及自动化程度等; 再者,有必要开发更有效的软件和统计方法,更好地解释成像数据,结合目前计算机科学领域中的人工智能,对质谱成像图像进行更智能地解释。因此,推动大气压质谱新型离子化技术、精准分析、质谱成像及仪器小型智能化仍是当前的研究重点。
References
1LU HaiYan, ZHANG Hua, XIAO YiPo, LI Yi, GU HaiWei, CHEN HuanWen. J. Instrum. Anal., 2017, 36(2): 152-160
卢海艳, 张 华, 肖义坡, 李 毅, 顾海巍, 陈焕文. 分析测试学报, 2017, 36(2): 152-160
2Hsu C C, Dorrestein P C. Curr. Opin. Biotechnol., 2015, 31: 24-34
3Margulis K, Zhou Z P, Fang Q Z, Sievers R E, Lee R J, Zare R N. Anal. Chem., 2018, 90(20): 12198-12206
4He J M, Sun C L, Li T G, Luo Z G, Huang L J, Song X W, Li X, Abliz Z. Adv. Sci., 2018, 5(11): 1800250
5Yue H, Ma L, Pi Z F, Chen H W, Wang Y, Hu B, Liu S Y. Planta Med., 2013, 79(2): 169-174
6Gross J H. Anal. Bioanal. Chem., 2014, 406(1): 63-80
7Phelps D L, Balog J, Gildea L F, Bodai Z, Savage A, ElBahrawy M A, Speller A V M, Rosini F, Kudo H, McKenzie J S, Brown R, Takats Z, GhaemMaghami S. Brit. J. Cancer, 2018, 118(10): 1349-1358
8Fatou B, Saudemont P, Leblanc E, Vinatier D, Mesdag V, Wisztorski M, Focsa C, Salzet M, Ziskind M, Fournier I. Sci. Rep., 2016, 6: 25919
9Zhang J L, Rector J, Lin J Q, Young J H, Sans M, Katta N, Giese N, Yu W D, Nagi C, Suliburk J, Liu J S, Bensussan A, DeHoog R J, Garza K Y, Ludolph B, Sorace A G, Syed A, Zahedivash A, Milner T E, Eberlin L S. Sci. Transl. Med., 2017, 9(406): eaan3968
10Wu C P, Dill A L, Eberlin L S, Cooks R G, Ifa D R. Mass Spectrom. Rev., 2013, 32(3): 218-243
11Huang M Z, Yuan C H, Cheng S C, Cho Y T, Shiea J. Annu. Rev. Anal. Chem., 2010, 3: 43-65
12Weston D J. Analyst, 2010, 135(4): 661-668
13Huang M Z, Cheng S C, Cho Y T, Shiea J. Anal. Chim. Acta, 2011, 702(1): 1-15
14Klejdus B, Kovacik J. Ind. Crop. Prod., 2016, 83: 774-780
15Rocca L M, Cecca J, L'Episcopo N, Fabrizi G. J. Mass Spectrom., 2017, 52(11): 709-719
16Schilmiller A L, Last R L, Pichersky E. Plant J., 2008, 54(4): 702-711
17Freund D M, Martin A C, Cohen J D, Hegeman A D. Planta, 2018, 247(1): 267-275
18Prchalova J, Kovarik F, Rajchl A. J. Mass Spectrom., 2017, 52(2): 116-126
19Shiea J, Huang M Z, Hsu H J, Lee C Y, Yuan C H, Beech I, Sunner J. Rapid Commun. Mass Spectrom., 2005, 19(24): 3701-3704
20Bierstedt A, Riedel J. Methods, 2016, 104: 3-10
21MartinezJarquin S, HerreraUbaldo H, de Folter S, Winkler R. Talanta, 2018, 185: 324-327
22He T Y, Chambers M I, Musah R A. Anal. Chem., 2018, 90(21): 12802-12809
23Zhang H, Gu H W, Yan F Y, Wang N A, Wei Y P, Xu J J, Chen H W. Sci. Rep., 2013, 3: 2495
24Xu J Q, Chen H W. Bioanalysis,2018, 10(8): 523-525
25Zhang H, Bibi A S, Lu H Y, Han J, Chen H W. J. Mass Spectrom.,2017, 52(8): 526-533
26Zhang H, Chingin K, Zhu L, Chen H W. Anal. Chem., 2015, 87(5): 2878-2883
27Shen S S, Zhang H, Huang K K, Chen H W, Shen W X, Fang X W. New J. Chem., 2019, 43(5): 2118-2125
28Boughton B A, Thinagaran D, Sarabia D, Bacic A, Roessner U. Phytochem. Rev., 2016, 15(3): 445-488
29Enomoto H, Sensu T, Sato K, Sato F, Paxton T, Yumoto E, Miyamoto K, Asahina M, Yokota T, Yamane H. Sci. Rep., 2017, 7: 42977
30Bong Y, Li B, Malitsky S, Rogachev L, Aharoni A, Kaftan F, Svatos A, Franceshi P. Front. Plant Sci., 2016, 7: 60
31Fowble K L, Teramoto K, Cody R B, Edwards D, Guarrera D, Musah R A. Anal. Chem.,2017, 89(6): 3421-3429
32Stopka S A, Samarah L Z, Shaw J B, Liyu A V, Velickovic D, Agtuca B J, Kukolj C, Koppenaal D W, Stacey G, PasaTolic L, Anderton C R, Vertes A. Anal. Chem., 2019, 91(8): 5028-5035
33MorenoPedraza A, RosasRoman I, GarciaRojas N S, GuillenAlonso H, OvandoVazquez C, DiazRamirez D, CuevasContreras J, Vergara F, MarschMartinez N, MolinaTorres J, Winkler R. Anal. Chem., 2019, 91(4): 2734-2743
34Jeong S, Eskandari R, Park S M, Alvarez J, Tee S S, Weissleder R, Kharas M G, Lee H, Keshari K R. Sci. Adv.,2017, 3(6): e1700341
35Zaitsu K, Hayashi Y, Murata T, Yokota K, Ohara T, Kusano M, Tsuchihashi H, Ishikawa T, Ishii A, Ogata K, Tanihata H. Anal. Chem., 2018, 90(7): 4695-4701
36Hayashi Y, Zaitsu K, Murata T, Ohara T, Moreau S, Kusano M, Tanihata H, Tsuchihashi H, Ishii A, Ishikawa T. Anal. Chim. Acta,2017, 983: 160-165
37Harayama T, Riezman H. Nat. Rev. Mol. Cell Biol., 2018, 19(5): 281-296
38Bergholt M S, Serio A, McKenzie J S, Boyd A, Soares R F, Tillner J, Chiappini C, Wu V, Dannhorn A, Takats Z, Williams A, Stevens M M. ACS Central Sci., 2018, 4(1): 39-51
39Wang X Q, Hou Y W, Hou Z H, Xiong W, Huang G M. Anal.Chem.,2019, 91(4): 2719-2726
40Yin R C, Kyle J, BurnumJohnson K, Bloodsworth K J, Sussel L, Ansong C, Laskin J. Anal. Chem., 2018, 90(11): 6548-6555
41Ma X X, Xia Y. Angew. Chem.Int. Edit., 2014, 53(10): 2592-2596
42Tang F, Guo C G, Ma X X, Zhang J, Su Y, Tian R, Shi R Y, Xia Y, Wang X H, Ouyang Z. Anal. Chem.,2018, 90(9): 5612-5619
43Waldchen F, Spengler B, Heiles S. J. Am. Chem. Soc., 2019, 141(30): 11816-11820
44Douglass K A, Venter A R. J. Mass Spectrom., 2013, 48(5): 553-560
45Feider C L, Elizondo N, Eberlin L S. Anal. Chem., 2016, 88(23): 11533-11541
46Hsu C C, Baker M W, Gaasterland T, Meehan M J, Macagno E R, Dorrestein P C. Anal. Chem., 2017, 89(16): 8251-8258
47Shin H, Jo S, Mikos A G. Biomaterials, 2003, 24(24): 4353-4364
48Roman J K, Walsh C M, Oh J, Dana C E, Hong S, Jo K D, Alleyne M, Miljkovic N, Cropek D M. Anal. Bioanal. Chem., 2018, 410(7): 1911-1921
49Willmann J K, van Bruggen N, Dinkelborg L M, Gambhir S S. Nat. Rev. Drug Discov., 2008, 7(7): 591-607
50Xu L X, Wang T T, Geng Y Y, Wang W Y, Li Y, Duan X K, Xu B, Liu C C, Liu W H. Anal. Bioanal. Chem., 2017, 409(22): 5217-5223
51Burns L E, Borts D J. Anal. Chim. Acta, 2019, 1063: 75-81
52Perez C J, Tata A, de Campos M L, Peng C, Ifa D R. J. Am. Soc. Mass Spectrom., 2017, 28(6): 1136-1148
53Chakrabarty S, Shelver W L, Hakk H, Smith D J. J. Agric. Food Chem., 2018, 66(41): 10871-10880
54LU HaiYan, ZHANG Hua, ZHOU Wei, CHEN HuanWen. Mod. Food Technol., 2016, 32(06): 298303
盧海艳, 张 华, 周 炜, 陈焕文. 现代食品科技, 2016, 32(06): 298-303
55Xu J Q, Xu S R, Xiao Y P, Chingin K, Lu H Y, Yan R H, Chen H W. Anal. Chem., 2017, 89(21): 11252-11258
56Lu H Y, Zhang H, Zhu T G, Xiao Y P, Xie S X, Gu H W, Cui M, Luo L P. Sci. Rep., 2017, 7: 5136
57Chen W Q, Sun K X, Zheng R S, Zeng H M, Zhang S W, Xia C F, Yang Z X, Li H, Zou X N, He J. Chin. J. Cancer Res., 2018, 30(1): 1-12
58Zhang J L, Yu W D, Suliburk J, Eberlin L S. Clin. Chem., 2016, 62(9): 1172-1174
59Banerjee S. J. Biosci., 2018, 43(4): 731-738
60Ferreira C R, Yanne K E, Jarmusch A K, Pirro V, Ouyang Z, Cooks R G. Clin. Chem., 2016, 62(1): 99-110
61 Pirro V, Alfaro C M, Jarmusch A K, Hattab E M, CohenGadol A A, Cooks R G. Proc. Natl. Acad. Sci. USA,2017, 114(26): 6700-6705
62Ashizawa K, Yoshimura K, Johno H, Inoue T, Katoh R, Funayama S, Sakamoto K, Takeda S, Masuyama K, Matsuoka T, Ishii H. Oral Oncol., 2017, 75: 111-119
63Zou R, Cao W B, Chon L, Hua W, Xu H, Mao Y, Page J, Shi R Y, Xia Y, Hu T Y, Zhang W P, Ouyang Z. Anal. Chem., 2019, 91(1): 1157-1163
64Lu J R, Tan M, Cai Q S. Cancer Lett., 2015, 356(2): 156-164
65Margulis K, Chiou A S, Aasi S Z, Tibshirani R J, Tang J Y, Zare R N. Proc. Natl. Acad. Sci. USA, 2018, 115(25): 6347-6352
66Zhang J L,Yu W D, Ryu S W, Lin J, Buentello G, Tibshirani R, Suliburk J, Eberlin L S. Cancer Res.,2016, 76(22): 6588-6597
67Sun C L, Li T G, Song X W, Huang L J, Zang Q C, Xu J, Bi N, Jiao G G, Hao Y Z, Chen Y H, Zhang R P, Luo Z G, Li X, Wang L H, Wang Z H, Song Y M, He J M, Abliz Z. Proc. Natl. Acad. Sci. USA, 2019, 116(1): 52-57
68Banerjee S, Zare R N, Tibshirani R J, Kunder C A, Nolley R, Fan R, Brooks J D, Sonn G A. Proc. Natl. Acad. Sci. USA, 2017, 114(13): 3334-3339
69Garza K Y, Feider C L, Klein D R, Rosenberg J A, Brodbelt J S, Eberlin L S. Anal. Chem., 2018, 90(13): 7785-7789
70Inglese P, McKenzie J S, Mroz A, Kinross J, Veselkov K, Holmes E, Takats Z, Nicholson J K, Glen R C. Chem. Sci.,2017, 8(5): 3500-3511
71Schaefer K C, Denes J, Albrecht K, Szaniszlo T, Balog J, Skoumal R, Katona M, Toth M, Balogh L, Takats Z. Angew. Chem. Int. Edit., 2009, 48(44): 8240-8242
72John E R, Balog J, McKenzie J S, Rossi M, Covington A, Muirhead L, Bodai Z, Rosini F, Speller A V M, Shousha S, Ramakrishnan R, Darzi A, Takats Z, Leff D R. Breast Cancer Res.,2017, 19: 59
73Alexander J, Gildea L, Balog J, Spelle A, McKenzie J, Muirhead L, Scott A, Kontovounisios C, Rasheed S, Teare J, Hoare J, Veselkov K, Goldin R, Tekkis P, Darzi A, Nicholson J, Kinross J, Takats Z. Surg. Endosc., 2017, 31(3): 1361-1370