蓝舌病毒结构与组装机制研究进展
易华山,赵 瑶,马鲜平,2,王芝英,2,张德志,2,李前勇,3,左福元,3
(1.西南大学 动物科学学院,重庆 402460;2.重庆市兽医科学工程研究中心,重庆 402460;3.重庆市肉牛工程技术研究中心,重庆 402460)
蓝舌病(Blue tongue, BT)是由蓝舌病病毒(Bluetongue virus, BTV)引起的、以昆虫(库蠓)为传播媒介的反刍动物的一种非接触性传染病,其易感动物为绵羊、山羊、牛和鹿及野生反刍动物,是OIE划定为A类、我国列为一类的重要动物疫病[1]。蓝舌病毒(Bluetongue virus,BTV)属于呼肠孤病毒科(Reoviridae))环状病毒属(Orbivirus)的双股RNA (dsRNA)病毒,BTV粒子呈圆形、二十面体对称,无囊膜,10条分节段的dsRNA包含19 219个核苷酸,编码7种结构蛋白(VP2、VP5、VP7、VP3、VP1、VP4和VP6)和5种非结构蛋白(NS1、NS2、NS3、NS3a和NS4)[1-2]。BTV完整病毒粒子(~550S)外层衣壳由VP2和VP5组成,VP7与VP3构成内层衣壳,包裹着病毒的10条分节段的dsRNA和三种具有酶催化活性的VP1、VP4和VP6蛋白组成病毒核心颗粒(470S)[3]。亚核心颗粒是缺失外层衣壳和VP7蛋白层的中间结构,VP3是亚核心颗粒唯一主要结构蛋白,是颗粒装配的支架;装配好的亚核心结构必须包被VP7三聚体才能形成成熟的核心颗粒,然后核心颗粒进一步被外层蛋白外衣壳层修饰形成成熟的病毒粒子[1,3]。BTV(~550S)感染首先是吸附易感宿主细胞后较大的VP2蛋白(110 kDa)与某种细胞表面糖蛋白结合并促进网格蛋白介导的病毒内吞作用,而具有膜融合作用的VP5蛋白(60 kDa)将470S核心颗粒从细胞内吞体内释放,随着外层VP2和VP5蛋白的解体,启动BTV基因组RNA转录、蛋白的合成与病毒的组装[1,3]。
1 BTV颗粒主要的蛋白
1.1 BTV外衣壳VP2和VP5蛋白
利用低温电子显微镜(Cryo-EM)和图像分析表明,BTV外壳有60个类三角蛋白复合体(triskelion-like)的VP2纤突(spikes),围绕120个膜穿透蛋白VP5的球形三聚体(图1A)[3-4]。Zhang Xing等[5]以(3.5 Å)近原子分辨率定义了VP2和VP5蛋白的详细结构(图1B,图2),以揭示每种蛋白在BTV进入细胞过程中的作用。BTV病毒结合宿主细胞表面唾液酸受体的VP2单体分为四个不同的区域,即中心蛋白质(hub),发夹(hairpin),金字塔形体(body)和高度柔性的外部顶点(tip),VP2也是宿主中和抗体结合位点[5]。Hub结构域有一个10股血凝素样β折叠桶,驱动单体相互作用的三聚体以及具有唾液酸受体结合的口袋(pocket)[5]。在hub和body结构域的交界面,发现了典型的锌指基序CCCH的四面体,负责早期内吞体(endosome)中pH触发的VP2蛋白构象的变化[3,5]。Hassan、Forzan等研究表明,膜穿透/融合蛋白VP5三聚体具有高度致密的球状折叠结构,以α螺旋和位于中心的卷曲螺旋结构促进VP5三聚体的形成,类似于人类免疫缺陷病毒(HIV)gp41膜病毒融合蛋白。每个VP5单体都有三个不同的结构域组成,一个位于核心表面下方裂隙中的柔性匕首结构域(a hidden dagger domains)、一个富含螺旋的伸展结构域(unfurling domains)和一个带有膜相互作用元件的锚定结构域(anchoring domains)(图2)[3]。VP5蛋白在病毒粒子中以三聚体形式存在(图2B),其中匕首结构域中两个螺旋结构 (α1 and α2)与相邻的内层衣壳VP7蛋白的三聚体发生相互作用(图2C)[3]。当BTV暴露于早期内吞体(Early endosome,pH 6.0~6.5)低pH环境下,VP5 N端匕首结构域发生构象变化而使其M1-S41基序及WHXL脂质作用、W411-L414基序与内吞体膜发生膜融合作用。随着VP2蛋白的完全拆卸、降解, VP5蛋白的匕首(dagger domain)蛋白和伸展结构域(unfurling domains)可实现显著重折叠[1,5-6]。VP5蛋白锚定结构域中的β-折叠片(β-meander motif)基序含有组氨酸簇,可感知晚期内吞体pH(Late endosome,pH 5.5)以释放四个假定的膜相互作用蛋白而从晚期内吞体内释放,实现具有转录活性的病毒颗粒进入细胞质内[3]。研究表明,VP5可利用一种晚期的内吞体特异性脂质来实现膜的渗透,这一过程类似于某些囊膜病毒,如流感病毒的HA2蛋白,通过晚期内吞体而进入细胞,并利用组氨酸残基作为pH传感器,随后在感应晚期内吞pH后发生显著构象变化[7-9]。
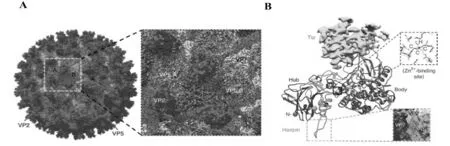
图1 低温电镜技术重建BTV病毒
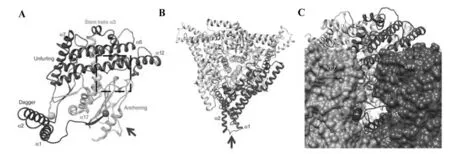
图2 BTV病毒VP5结构域示意图
1.2 病毒核心颗粒及其组成部分
1.2.1 BTV VP7与VP3蛋白结构 不同于病毒完整粒子(550S),对纯化的BTV病毒通过蛋白水解可产生非常稳定的由VP7、VP3、VP1、VP4、VP6及病毒基因组组成的核心粒子(470S)[3]。研究表明,BTV二十面体核心颗粒的三维(3D)结构显示三角剖分数为13(T=13),由260个VP7(38 kDa)三聚体形成,似六元环排列在132个通道上,五个环结构排列在顶点;五个准等价三聚体形成明显的原体单元,每个三聚体由两个不同的结构域组成,“上段”(反向β-sandwich)和“下段”(主要是α-螺旋)[3,10]。一种单体的顶部区域靠近相邻单体的下部区域,可使单体之间具有广泛的相互作用。VP7下部结构域连接到由VP3蛋白(103 kDa)60个二聚体形成的病毒内层衣壳,VP3结构层具有T=2对称性; 每个二聚体由“A”和“B”型构象组成,每个构象具有三个结构域,刚性“壳”,“顶端”和“二聚化”结构域[3]。 病毒内层衣壳的VP3层由12个十聚体通过“二聚化”结构域的互连形成,每个十聚体由五重的“A”型分子与周围5个顶点的五重“B”型VP3分子组成[10-13]。在三重轴的VP3层中也有一些孔隙,但在完整的核心粒子中,这些孔隙被VP7三聚体完全填塞;在存在Mg2+和NTP的情况下,VP3和VP7在五重轴周围向外移动,这可能是由于聚合酶复合物的激活,从而允许VP3层中存在的孔打开而使病毒mRNAs进入细胞质内进行病毒蛋白的合成及病毒基因组的复制[14]。迄今为止,包括酵母病毒L-A在内,大多数分节段dsRNA基因组的病毒都含有120个VP3亚基T = 2基本亚单位,这种结构可能是为了基本的生物学功能而保留的,比如在不同的病毒中保持转录复合物和基因组的正确结构[2-3,15]。
1.2.2 病毒三蛋白转录复合物(TC)结构 在BTV病毒颗粒内层核衣壳内部由VP1、VP4和VP6蛋白构成病毒三蛋白转录复合物(Viral tri-protein transcriptase complex,TC)结构[3]。 VP1 蛋白(150 kDa)由 L1 基因编码,类似于λ3结构模型, VP1蛋白是BTV病毒依赖的RNA聚合酶(Viral RNA-dependent RNA polymerases,RdRp)具有中心聚合酶、N端和C端结构域[16-17],具有 RNA 依赖的 RNA 聚合酶活性,以病毒ssRNA为模板合成病毒dsRNA[18]。VP4(78 kDa)蛋白具有mRNA加帽酶活性,在RNA三磷酸酶,鸟苷酸转移酶和两种甲基化酶的协同作用下,催化在核心颗粒内的RNA转录物的5'末端形成cap1(m7GPPPNm)结构[19-20]。重组VP4的晶体结构显示该蛋白呈细长的沙漏形态,具有不同的结构域,每个功能结构域依次排列以促进酶催化活性[21]。VP6 (36 kDa)是RNA包装中必不可少的ATP依赖性RNA解旋酶,可促进VP1的转录活性,其高分辨率结构尚不清楚;然而,核磁共振分析揭示了具有两个大的环状结构域,其显示出非常容易与各种大小RNA的分子作用[1,3]。同时,VP6蛋白具有 ATP 结合活性,依赖 RNA ATP 酶活性和解旋功能,能使 BTV 的双链RNA解螺旋并辅助 mRNA的合成等[1,3]。
2 核心蛋白的组装途径
病毒包涵体(Virus inclusion body,VIBs)或病毒蛋白聚集体是BTV和呼肠孤病毒科家族成员的标志,是基因组复制和亚病毒装配的功能位点[3]。新合成的病毒蛋白与病毒RNA分子相互作用优先于病毒衣壳组装和dsRNA合成[3]。在BTV感染细胞中, NS1蛋白优先促进BTV ssRNA的翻译,促进病毒蛋白质合成;而NS2形成纤维网络状的VIBs,募集基因组组装、复制和核心组装所需的病毒ssRNA和蛋白质组分[1,22-23]。新产生的亚核蛋白(VP1、VP4、VP6和VP3)和10个节段的RNA转录物由NS2直接募集到VIBs中,并在VIBs中与VP3组装成亚核心颗粒,然后再获得VP7蛋白生成稳定的病毒核心粒子。尽管还没有确定VP3与VP7组装的确切机制,但目前的研究表明,NS2与这些组分中的每一种蛋白直接或间接发生相互作用,特别是与BTV ssRNA的相互作用,具有高度特异性[1,3]。因此,一系列基于RG的研究证明,在BTV复制的早期阶段,NS2促进了三种酶蛋白和VP3形成起初的复制酶复合物,VP7不直接参与复制酶复合物,仅用于稳定复制酶复合物[24-25]。重组结构蛋白的共表达能使缺乏RNA基因组的CLPs组装成为可能,表明这些蛋白具有内在的自组装途径,该系统使得VP3和VP7组装过程的更精细阶段得以解析[26-27]。例如,一个缺失VP3二聚化结构域的缺失突变体可以破坏亚核的形成,但却可以生成VP3的十聚体和二聚体,这说明VP3二聚体形成了一个二聚体中间体的装配途径,并且通过二聚化结构域使十聚体与十聚体相互作用而参与整个VP3亚核的装配[28]。
Sung等[29]应用体外转录/翻译,无细胞装配(CFA)系统进一步支持了重组蛋白装配机制,首先在体外翻译BTV聚合酶复合蛋白,然后与10个ssRNA转录物一起孵育,然后再依次与VP3和VP7一起孵育,所生成的产物具有完整的10个节段的ssRNA的BTV核心颗粒;并且添加NTPs和二价阳离子优于VP7蛋白产生的BTV核心颗粒,包装的ssRNA可以充当BTV dsRNA合成的模板,而且这种组装的颗粒在易感细胞中具有感染性[3]。Sung等[29]研究还表明,VP6对于ssRNA包装是必需的, VP7为亚核提供稳定性,保护包装的ssRNA免受RNA酶活性的影响[3,29]。显然,在没有非结构蛋白的情况下, BTV结构蛋白和RNA区段可以组装形成感染性颗粒[3]。 随着组装过程,新合成的核心颗粒从VIBs中释放,并利用细胞内囊泡分选和胞外途径来继续完成病毒组装及出芽过程并传播具有感染性的成熟病毒颗粒[3,30-31]。
3 基因组RNA的组装与包装
BTV 10个RNA节段(3.95 kb~0.8 kb)可分为大、中、小三大类,每个节段的序列不同,在不同RNA截短可变区都具有互补的短5`和3`端UTRs及两端高度保守的六核苷酸,正是通过这些UTRs,BTV和其他相关病毒开始分类募集各自基因组ssRNA 节段[32-34]。病毒基因组装配开始于VP1聚合酶和VP4加帽酶的相互作用,同时VP6六聚体与10个ssRNA复合物相互作用,它们一起形成聚合酶复合物,并在五重轴上与VP3十聚体相互作用,随着12个十聚体形成的亚核心粒子内层衣壳的形成及160个VP7三聚体依次沉积而形成BTV二十面体核心颗粒,在核心颗粒的表面再沉积120个VP5蛋白三聚体和60个VP2蛋白的三聚体形成完整的病毒粒子(图3)[3]。研究表明,复杂RNA网络节段间相互作用是病毒ssRNA分选、募集、包装正确基因组区段的驱动力,并且从最小ssRNA节段S10开始按特定节段的顺序募集,引发RNA-RNA与其他节段的相互作用以形成起始复合体;随后,招募中等至较大的ssRNA,直到将完整的基因组包装到衣壳中(图3)[3]。在整个组装的过程中,每一节段的组装信号具有高度的特异性,不仅在UTRs中,在基因编码区域中也有高度特异性的序列分布。而且,UTRs,特别是S10 UTRs,负责触发装配所需的正确的二级结构;寡核糖核苷酸、ORNs与BTV RNA的3'UTR互补的寡核糖核苷酸等,如果这些RNA网络被扰乱,可阻止BTV体外衣壳化并能抑制体内病毒的复制[1,3]。
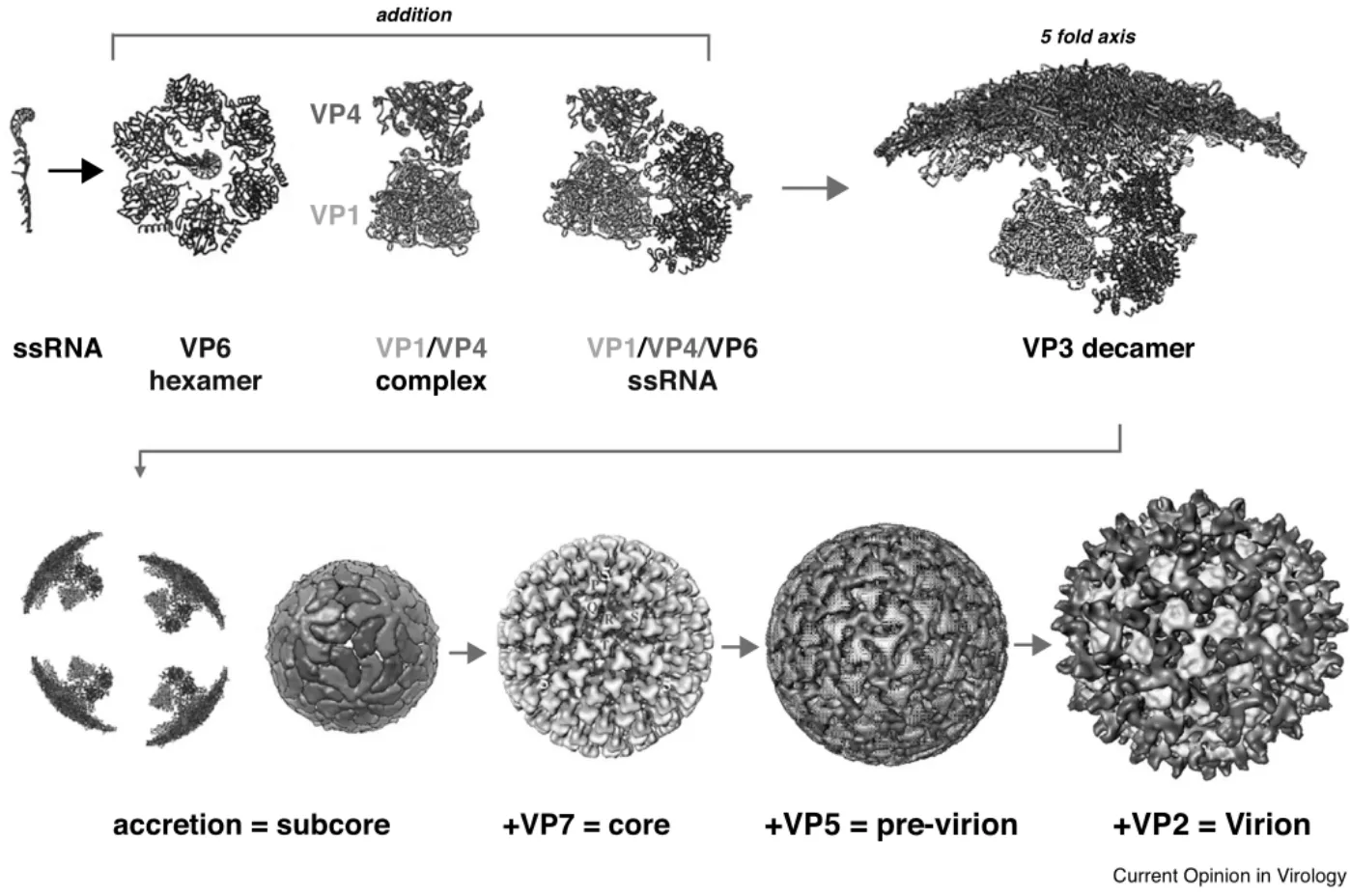
图3 BTV粒子各组分时序组装示意图[3]
4 内外衣壳之间的相互作用
BTV新组装的核心颗粒必须离开VIBs以获得两个外衣壳蛋白(VP2和VP5)并形成成熟的病毒颗粒,因此,核心颗粒及时从VIBs中释放是病毒粒子成熟过程中必须调控的一个重要步骤[3]。NS2蛋白通过细胞磷酸化激酶而磷酸化,通过蛋白构象改变,成为核心颗粒从VIBs释放而进入细胞质的关键调控因子[7]。研究表明,BTV VP2和VP5蛋白均可见于VIBs外周区域而有利于释放核心颗粒获得外层衣壳。通过杆状病毒表达系统或体外转录 - 翻译系统研究证实,在病毒组装反应中VP2和VP5蛋白与核心颗粒表面蛋白VP7相互作用;并且VP2与VP5可分别与核心颗粒表面独立地结合而直接连接到核心颗粒上[11,35-36]。一旦BTV核心颗粒获得外层的VP2和VP5蛋白,核心颗粒就不再具有转录活性,因为在VP7蛋白三角形顶部作为VP2和VP5蛋白沉积的平台而使VP7顶点处的孔被封闭[4-5]。每个VP2三聚体通过中心蛋白体和发夹结构域的基部(具有两个组氨酸羧基末端)与四个VP7三聚体接触, VP2发夹结构域的环也可以与VP7三聚体的胶冻卷顶部结构域相互作用[3,5]。VP5与VP7之间的相互作用更为广泛,涉及到VP5的三个结构域[3]。重组表达研究的结果进一步证实了, VP2与VP5三聚体的N末端螺旋和VP2发夹环锚定结构域与VP5三聚体之间的相互作用较弱,这与BTV侵入细胞期间VP2在内吞体低pH环境下的脱离相一致,也就是VP2解离以VP5的匕首蛋白和伸展结构域构象变化而实现[3]。
5 展 望
BTV作为一种重要的dsRNA媒介病毒和病毒研究的模型系统已被广泛研究,对BTV组装路径及其复制周期深入研究(图3)[3],为开发新的诊断试剂,蛋白质和衣壳疫苗以及符合DIVA标准的新型减毒病毒BTV疫苗提供了基础。虽然BTV基因组前体RNA在衣壳内的确切位置及其详细的装配机制仍不清楚,包装的RNA的精确位置和TC复合物在二十面体衣壳中的作用机制?病毒基因组各节段的精确筛选募集与精确组装机制等? 但是在不久的将来,单粒子低温电子显微镜、低温层析成像技术及单分子荧光光谱等将可能解决这些问题,为研究病毒与宿主适应性之间的共同机制,探索新的抗病毒策略,研究新型的具有广泛活性的抗病毒制剂。

