超声微泡联合EPO对大鼠心肌梗死后非梗死区心肌OPN表达的影响及其与心室重构的相关性
任云霞,潘龙飞,李丽君,高彦霞*
(1西安市胸科医院浆膜腔科,西安 710000;2西安交通大学第二附属医院急诊科;3西安交通大学第二附属医院心血管内科;*通讯作者,E-mail:972264140@qq.com;#共同通讯作者,E-mail:lilijun3162003@aliyun.com)
急性心肌梗死是严重危害人类健康的疾病,每年估计有超过3百万人发生ST段抬高的心肌梗死,有超过4百万人发生非ST段抬高的心肌梗死[1]。尽管再灌注治疗使心肌梗死患者的死亡率下降,但急性心肌梗死后心衰的患者是增加的[2],心肌梗死后的心室重构、心力衰竭严重影响了患者的生存质量。目前证实促红细胞生成素(erythropoietin,EPO)除了能促进红细胞生成外,在心肌细胞的凋亡、炎症反应及心室重构方面有抑制作用,进而改善心脏功能[3,4]。超声辐照联合静脉输注微泡有辅助溶栓、促进血管新生和改善心肌微循环等作用[5,6]。但对于超声微泡联合EPO是否可以改善心室重构、缩小梗死面积及其机制,目前研究较少。骨桥蛋白(osteopontin,OPN)作为一种重要的细胞外基质蛋白,因参与骨基质矿化和重吸收过程,介导骨组织细胞与骨基质连接而得名。研究发现,随着心室重构的进展,OPN的表达明显上调,与心室重构存在显著的相关性[7]。本研究通过超声介导微泡联合EPO干预心肌梗死大鼠,观察心肌梗死后OPN表达的变化和心室重构情况,并进一步探讨影响心室重构的机制。
1 材料与方法
1.1 实验试剂与仪器
微泡采用SonoVue(意大利Bracco公司产,无菌冻干粉状,打开包装后注入10 ml生理盐水摇匀,微泡的浓度为(2-5)×107个/ml,微泡平均直径为2.5 μm左右);超声诊断仪(Sonosite180 Plus,美国,C60/5-2 MHz 60 mm凸阵探头,频率3.5 MHz,机械指数1.3),由西安交通大学第二附属医院超声科提供。重组人促红细胞生成素(3 000 IU/支,山东阿华生物药业有限公司),鼠单抗OPN抗原抗体(北京中杉金桥生物有限公司),兔抗鼠Ⅰ型胶原单克隆抗体(北京博奥森生物技术有限公司)Image Pro Plus 4.5图像分析系统(美国MediaCybernetics公司)。
1.2 动物分组及心肌梗死模型制备
105只雄性10周龄SD大鼠,动物生产许可证号:SCXK(陕)2012-003,清洁级,体质量(300±30)g,由西安交通大学医学院动物中心提供。参照文献制作急性心肌梗死模型[6]。将造模成功的90只大鼠随机分为超声+微泡+EPO组、EPO组及单纯心肌梗死组。超声+微泡+EPO组和EPO组心肌梗死模型制备后立即经腹腔注射给予EPO(3 000 IU/kg),而单纯心肌梗死组则经腹腔给予等量生理盐水。分别在心肌梗死后24 h和48 h,用10%水合氯醛0.03 ml/kg腹腔注射麻醉后,固定于手术台,用1 ml注射器抽取配好的微泡造影剂1 ml,经舌下静脉缓慢给予超声+微泡+EPO组1 ml的超声微泡造影剂(浓度为2×107-5×107/ml),静推时间为10 min,同时按超声作用5 s,停5 s方式,用诊断超声仪探头照射心肌梗死区,共10 min。而EPO组和单纯心肌梗死组则经舌下静脉缓慢给予1 ml生理盐水,静推时间为10 min,超声照射方式同前。
1.3 心脏标本的采集与固定
于心肌梗死后28 d处死大鼠,取出心脏,去除左右心房及血管组织,并用生理盐水冲洗干净,于心尖与结扎线连线中点处用刀片沿着与左心室长轴垂直的切面将心脏成3-4 mm厚的组织片,用4%多聚甲醛固定24-48 h,石蜡包埋。切成5 μm厚度的切片,用多聚赖氨酸处理。对心肌梗死后28 d大鼠心肌组织切片行Masson染色,光学显微镜下获取10倍图像,并用Image-Pro Plus 4.5软件分别测量梗死区面积、整个左心室面积和左心室腔面积,按梗死面积百分比=梗死区面积/(整个左心室面积-左心室腔面积)×100%的公式计算梗死面积百分比。免疫组化检测Ⅰ型胶原、骨桥蛋白的含量,用Image Pro Plus 4.5分别计算OPN和Ⅰ型胶原的总IOD值,计算平均值,并进行相关性分析。
1.4 统计学分析
2 结果
2.1 Masson染色结果
10倍光学显微镜下获取的图像见图1。超声+微泡+EPO组梗死面积百分比最小(P<0.05),单纯心肌梗死组最大(P<0.05,见表1)。
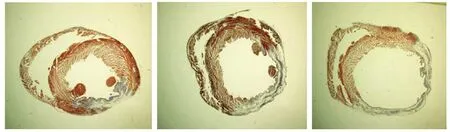
A.超声+微泡+EPO组 B.EPO组 C.单纯心肌梗死组图中红色为心肌组织,蓝色为胶原图1 梗死后28 d心肌Masson染色 (×10)Figure 1 Masson staining of myocardium at 28 d after myocardial infarction (×10)



组别梗死面积(%)超声+微泡+EPO组15.82±1.18∗#EPO组21.69±0.78#单纯心肌梗死组28.66±2.26
与EPO组比较,*P<0.05;与单纯心肌梗死组比较,#P<0.05
2.2 免疫组化结果
2.2.1 骨桥蛋白 心肌梗死后28 d大鼠心肌组织行骨桥蛋白免疫组化检测,骨桥蛋白阳性表达为位于细胞胞质内的棕黄色颗粒(见图2)。用Image-Pro Plus 4.5软件计算骨桥蛋白的平均IOD值,超声+微泡+EPO组与EPO组与单纯心肌梗死组相比,OPN含量明显降低,差异具有统计学意义(P<0.01,见表2)。

A.超声+微泡+EPO组 B.EPO组 C.单纯心肌梗死组图2 梗死后28 d免疫组化图像分析OPN含量 (×400)Figure 2 Analysis of OPN content by immunohistochemical image at 28 d after myocardial infarction (×400)



组别IOD值超声+微泡+EPO组230320.6±16512.9∗∗##EPO组293543.4±28224.2##单纯心肌梗死组356809.9±15318.9
与EPO组比较,**P<0.01;与单纯心肌梗死组比较,##P<0.01
2.2.2 Ⅰ型胶原 心肌梗死后28 d大鼠非梗死区心肌组织行Ⅰ型胶原免疫组化检测,Ⅰ型胶原阳性表达位于细胞间质、呈棕黄色(见图3),用Image-Pro Plus 4.5软件计算Ⅰ型胶原的平均IOD值,超声+微泡+EPO组和EPO组较单纯心肌梗死组Ⅰ型胶原含量明显降低,差异具有统计学意义(P<0.01,见表3)。而超声+微泡+EPO组Ⅰ型胶原含量最少,差异具有统计学意义(P<0.01)。

A.超声+微泡+EPO组 B.EPO组 C.单纯心肌梗死组DAB显色(黄色),松木苏复染(蓝色),图中箭头所示即为Ⅰ型胶原阳性表达,位于细胞间质,呈棕黄色图3 梗死后28 d非梗死区大鼠心肌组织Ⅰ型胶原含量 (免疫组化染色,×400)Figure 3 Immunohistochemical staining of type Ⅰ collagen in myocardium of non-infarcted area at 28 d after infarction (×400)


组别IOD值超声+微泡+EPO组172136.8±17323.6∗∗##EPO组284949.9±18539.9##单纯心肌梗死组364585.9±22947.3
与EPO组比较,**P<0.01;与单纯心肌梗死组比较,##P<0.01
2.2.3 骨桥蛋白与Ⅰ型胶原的相关性分析 用线性相关进行分析发现,Ⅰ型胶原的IOD值与骨桥蛋白的IOD值之间存在相关性,且呈正相关(r=0.897,P<0.01,见图4)。

图4 非梗死区Ⅰ型胶原的平均IOD值与OPN平均IOD值之间相关性的散点图Figure 4 Scatter plot of the correlation between the average IOD value of type Ⅰ collagen and the average IOD value of OPN in non-infarct area
3 讨论
心室重构是急性心肌梗死发展成为心衰的重要病理生理基础,参与了整个病程的始终,是影响急性心肌梗死预后的主要原因[8]。如何减少心肌梗死后心力衰竭的发生率和死亡率,改善心肌梗死患者的预后已成为心血管领域研究重点之一[9]。研究显示,EPO除促进红细胞生成外,还具有如抗凋亡、促进血管新生、调节炎症反应等作用,对脑组织[10]、肾脏[11]、肝脏[12]和心脏[13]等多个器官都有保护作用。Lu等[14]通过离体心脏模型研究发现,EPO能减轻心肌缺血再灌注损伤,并可减少心肌梗死面积。EPO可以刺激血管新生,进而增加心肌供血[15],减少心肌梗死面积、抑制心室重构进而提高心功能。心肌梗死面积的大小与血流动力学紊乱和神经内分泌激活密切相关,可作为预测心室重构和心衰进展的重要指标[16]。王琬婷等[17]通过体内动物模型研究发现,EPO对压力负荷过重所引起的的小鼠左心室重构具有抑制作用,并可降低死亡率。有实验证实[18],促红细胞生成素联合左卡尼汀可有效改善肾性贫血,降低血浆内皮素水平,抑制左心室重构且安全性较高,临床价值较高。本实验发现,超声+微泡+EPO组梗死面积百分比最小(P<0.05),单纯心肌梗死组梗死面积百分比最大(P<0.05),说明超声微泡联合EPO及EPO二者均可减少心肌梗死面积,但超声微泡联合EPO联合使用效果明显强于单用EPO,推测其可能通过刺激新生血管的形成,增加心肌血液供应,从而减少心肌梗死面积。
OPN是一种多功能蛋白,在多种生物学过程中起着重要作用,包括骨吸收、免疫细胞激活、抑制血管钙化和细胞外基质重构[19]。心肌梗死后梗死区和非梗死区OPN含量都明显增加[20]。在AMI后的心室重构中,在AngⅡ、缺氧、细胞因子等作用下,OPN及整合素合成过量增加,调节成纤维细胞增殖、迁移和分泌过量的Ⅰ型胶原和Ⅲ型胶原等大分子物质,进一步加重心室重构。
在急性心肌梗死后心室重构中,胶原沉积为决定性影响因素[21],是心室重构的重要环节,所以减少胶原沉积对预防和逆转心室重构起着非常重要的作用。Ⅰ型胶原的大量沉积会导致心室顺应性减低、僵硬度增加、心肌细胞供血障碍及心功能减退等,所以预防和逆转胶原沉积很有必要。Nishiya等[22]发现,在心肌梗死后给予EPO,能减轻非梗死区心肌纤维化和抑制相关基因的表达。本实验发现,与单纯心肌梗死组相比,EPO组及超声+微泡+EPO组的OPN含量及Ⅰ型胶原含量明显较低,差异具有统计学意义(P<0.01),说明EPO及超声+微泡+EPO均可抑制组织中OPN及Ⅰ型胶原的表达;而超声+微泡+EPO组OPN及Ⅰ型胶原含量最少,差异具有统计学意义(P<0.01),说明超声+微泡+EPO三者联合较单用EPO抑制OPN及Ⅰ型胶原表达效果更加显著,验证了EPO具有抑制OPN表达及减少Ⅰ型胶原含量,从而抑制心室重构的作用,而超声介导微泡可增强EPO的抑制心室重构的作用,其机制可能为超声介导微泡爆破时产生的冲击波和微射流,可使周围组织中细胞膜产生可逆或不可逆的穿孔,使细胞膜及血管壁的通透性增加;同时冲击波及微射流可以直接促进药物及基因等物质进入周围组织或细胞内,增强细胞对药物的摄入能力,从而提高药物在靶组织的浓度,提高药物疗效,减少药物的使用量。另OPN的表达与Ⅰ型胶原含量呈正相关,推测EPO通过下调OPN表达进而抑制Ⅰ型胶原的表达来减轻心室重构。
综上所述,超声介导微泡联合EPO干预心肌梗死大鼠,发现EPO可减少心肌梗死面积和减少Ⅰ型胶原含量,进而减轻心室重构,且发现OPN的表达下调可能为EPO治疗心肌梗死后心室重构的机制之一。超声介导微泡可增加EPO的上述治疗作用。但EPO下调OPN的具体机制是什么?是通过何种信号途径?还需进一步探讨。

