miR-152靶向IRS-1对结肠癌细胞增殖、迁徙及侵袭的影响
代 莹,包 骥,许 波,姜媛媛,邱海燕,黄 艺,詹发平
(1兴义市人民医院肿瘤科,兴义 562400;2四川大学华西临床医学院病理科;3兴义市人民医院普通外科)
结肠癌是世界范围内最常见的消化道恶性肿瘤,发病率居所有恶性肿瘤的第3位,病死率位居第2位[1,2]。近年来,结肠癌发生率逐年升高,已成为我国发病率最高的恶性肿瘤之一,严重威胁人民生命健康[3],患者5年生存率不足60%[4]。因此,探讨结肠癌发生发展的分子机制,对肿瘤的靶向治疗具有重要意义。微小RNA(microRNA,miRNA)是内源性的长度为19-25个核苷酸的小分子单链非编码RNA,通过抑制靶基因翻译或降解靶基因mRNA,参与机体多种生物学过程,如细胞增殖、迁移、凋亡、分化等[5]。miR-152是miR-148/152的成员之一,参与一系列细胞活动,例如细胞增殖、入侵等,在多种恶性肿瘤中发挥抑癌作用[6,7]。胰岛素受体底物1(insulin receptor substrate 1,IRS-1)是胰岛素受体、类胰岛素生长因子Ⅰ受体的重要底物,通过将细胞外的信号传递到细胞内,调控细胞的代谢、生长、存活、分化和恶性转化[8]。目前,miR-152和IRS-1对结肠癌发生发展的影响尚不明确。本研究旨在探讨miR-152与IRS-1的关系及对结肠癌SW480细胞增殖、迁徙、侵袭的影响。
1 材料与方法
1.1 试剂与仪器
人结肠癌细胞株SW480、胰蛋白酶、化学发光试剂盒购自上海泽叶生物科技有限公司;胎牛血清、DMEM培养基、Lipofectamine 2000转染试剂、蛋白提取试剂盒、BCA蛋白检测试剂盒、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、IRS-1抗体、基质金属蛋白酶-2(MMP-2)抗体、MMP-9抗体、β-actin抗体购自上海恒斐生物科技有限公司;荧光定量PCR试剂盒购自北京拜尔迪生物技术有限公司;TRIzol试剂、CCK-8试剂、羊抗兔IgG抗体购自北京百奥莱博科技有限公司;Transwell小室购自上海研卉生物科技有限公司;MatrigelTM基质胶购自广州威佳科技有限公司。荧光定量PCR仪(ABI 7500)为美国Applied Biosystems公司产品;全自动酶标仪(ELX800)为美国BIO-TEK公司产品;化学发光成像系统(ChemiDocXRS)为美国Bio-Rad公司产品。
1.2 细胞培养与分组
将结肠癌细胞SW480接种于含10%胎牛血清、1%双抗的DMEM培养基中,37 ℃、5% CO2的恒温饱和湿度培养,细胞融合率达到约80%时,用胰蛋白酶消化、传代培养。取对数期SW480细胞(1×105个/ml)接种于96孔培养板,每孔100 μl,用Lipofectamine 2000转染试剂分别将nonsense siRNA载体和miR-152 siRNA载体转入到SW480细胞中,分别命名为无义转染组和miR-152 siRNA组,不转入任何载体的SW480细胞为对照组。转染24 h将各组SW480细胞正常培养,待后续实验使用。
1.3 qRT-PCR法检测SW480细胞中miR-152和IRS-1 mRNA表达
将对照组、无义转染组和miR-152 siRNA组SW480细胞培养24 h,收集细胞,使用TRIzol试剂提取总RNA,逆转录合成cDNA,采用qRT-PCR法检测miR-152和IRS-1 mRNA表达水平,内参基因为β-actin。反应程序:95 ℃ 15 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 40 s,循环45次;72 ℃ 10 min。Ct值为扩增产物的荧光信号达到临界阈值时对应的循环数,miR-152和IRS-1 mRNA相对表达量以2-ΔΔCt表示。
1.4 CCK-8法检测SW480细胞增殖
将对照组、无义转染组和miR-152 siRNA组SW480细胞培养48 h,加入CCK-8试剂后继续培养2 h,使用全自动酶标仪于波长为450 nm处检测各孔吸光度值(OD)。
1.5 Transwell法检测SW480细胞迁徙
用无血清培养液将对照组、无义转染组和miR-152 siRNA组SW480细胞稀释为2.5×105个/ml的细胞悬液,分别向Transwell小室上层加入200 μl,下室中均加入500 μl 10%胎牛血清的培养液,置于37 ℃、5% CO2培养24 h,用无菌棉签擦去小室膜上未穿膜的细胞,用4%多聚甲醛固定下层迁徙细胞10 min,PBS洗涤,用0.5%结晶紫染液染色20 min,PBS洗涤。倒置显微镜随机选取6个视野(×200)观察拍照,统计迁徙细胞数并计算平均值。
1.6 Transwell法检测SW480细胞侵袭
用无血清培养基稀释Matrigel基质胶(1 ∶8),向每个Transwell小室中加50 μl,37 ℃ 1 h凝固。后续操作均与1.5中检测细胞迁徙情况步骤相同,随机选6个视野统计侵袭细胞数。
1.7 Western blot法检测SW480细胞IRS-1、PCNA、MMP-2和MMP-9蛋白表达
将对照组、无义转染组和miR-152 siRNA组SW480细胞培养48 h,收集细胞,使用蛋白提取试剂盒提取各组细胞总蛋白,使用BCA蛋白检测试剂盒测定蛋白浓度并定量。电泳分离、转膜、封闭后,分别加入IRS-1、PCNA、MMP-2、MMP-9、β-actin抗体(1 ∶500),4 ℃孵育过夜,TBST洗涤,加辣根过氧化物酶标记的羊抗兔IgG二抗(1 ∶1 000),室温孵育1 h,免疫反应化学发光法进行显色,Tanon 600图像分析系统拍摄图像并分析,目的蛋白相对表达水平=目的蛋白灰度值/内参β-actin灰度值。
1.8 统计学分析
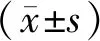
2 结果
2.1 SW480细胞中miR-152和IRS-1 mRNA表达水平
对照组和无义转染组SW480细胞中miR-152、IRS-1 mRNA表达水平差异无统计学意义(P>0.05)。与对照组和无义转染组相比,miR-152 siRNA组SW480细胞中miR-152表达水平显著降低(P<0.05),IRS-1 mRNA表达水平显著升高(P<0.05,见图1)。
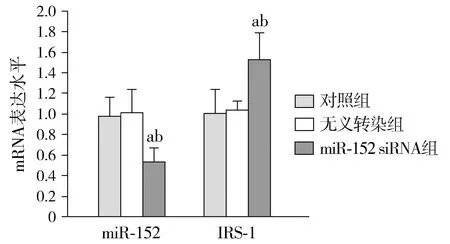
2.2 SW480细胞增殖情况
对照组和无义转染组SW480细胞OD值差异无统计学意义(P>0.05)。与对照组和无义转染组相比,miR-152 siRNA组SW480细胞OD值显著升高(P<0.05,见图2)。
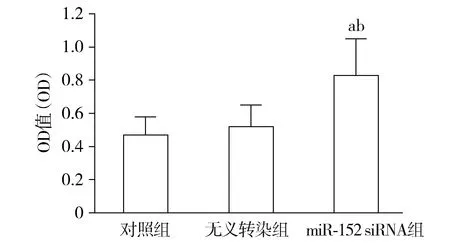
2.3 SW480细胞迁徙情况
对照组和无义转染组SW480细胞迁徙细胞数差异无统计学意义(P>0.05)。与对照组和无义转染组相比,miR-152 siRNA组SW480细胞迁徙细胞数显著升高(P<0.05,见图3)。
与对照组相比,aP<0.05;与无义转染组相比,bP<0.05图1 各组SW480细胞中miR-152、IRS-1 mRNA表达水平比较Figure 1 Expression levels of miR-152 and IRS-1 mRNA in SW480 cells after different treatment
与对照组相比,aP<0.05;与无义转染组相比,bP<0.05图2 各组SW480细胞OD值比较Figure 2 OD values in SW480 cells after different treatment
2.4 SW480细胞侵袭情况
对照组和无义转染组SW480细胞侵袭细胞数差异无统计学意义(P>0.05)。与对照组和无义转染组相比,miR-152 siRNA组SW480细胞侵袭细胞数显著升高(P<0.05,见图4)。
与对照组相比,aP<0.05;与无义转染组相比,bP<0.05图3 各组SW480细胞迁徙细胞数比较Figure 3 Migrated cell numbers in SW480 cells after different treatment
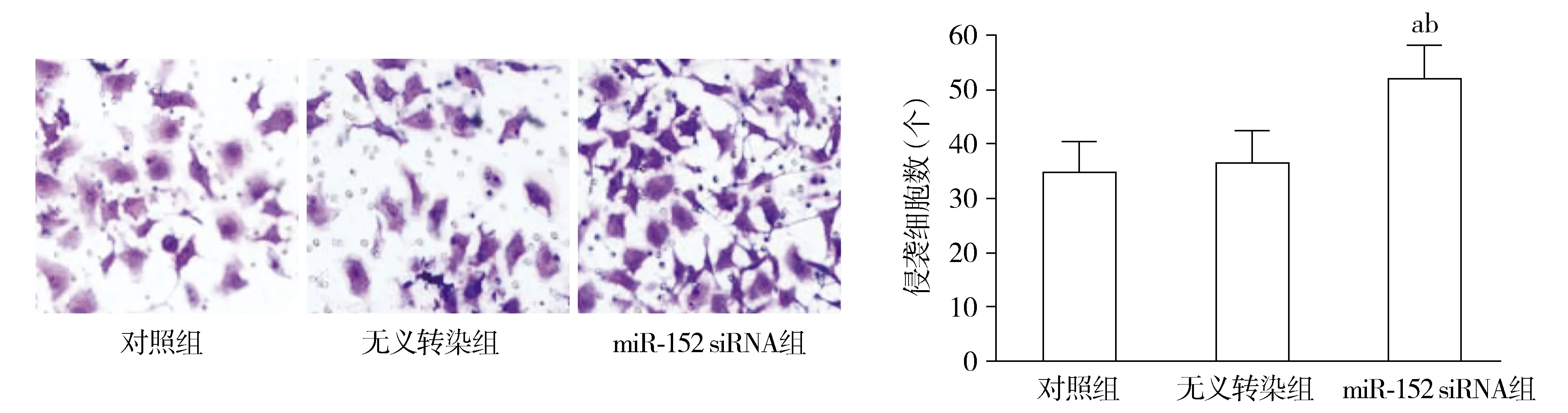
与对照组相比,aP<0.05;与无义转染组相比,bP<0.05图4 各组SW480细胞侵袭细胞数比较Figure 4 Invasion cell numbers in SW480 cells after different treatment
2.5 SW480细胞中IRS-1、PCNA、MMP-2和MMP-9蛋白表达情况
对照组和无义转染组SW480细胞中IRS-1、PCNA、MMP-2和MMP-9蛋白表达水平差异无统计学意义(P>0.05)。与对照组和无义转染组相比,miR-152 siRNA组SW480细胞中IRS-1、PCNA、MMP-2和MMP-9蛋白表达水平显著升高(P<0.05,见图5)。
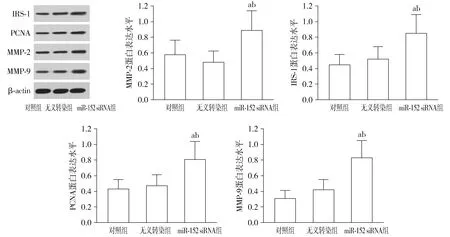
与对照组相比,aP<0.05;与无义转染组相比,bP<0.05图5 SW480细胞中IRS-1、PCNA、MMP-2、MMP-9蛋白表达情况Figure 5 Expression levels of IRS-1,PCNA,MMP-2 and MMP-9 protein in SW480 cells after different treatment
3 讨论
结肠癌是原发于直肠或结肠的恶性肿瘤,中、晚期极易发生侵袭、转移,但是由于结肠癌早期容易被忽视,多数患者确诊时伴有局部或远处侵袭、转移[9,10]。临床研究表明,已经发生转移的结肠癌患者通常无法治愈,目前主要依靠手术和化疗改善生活质量、延长生存时间,但平均总生存时间依旧偏低[5]。相对于传统化疗药物,分子靶向治疗的特异性更强、副作用更小,但临床上缺乏结肠癌的有效分子靶向药物[11,12]。因此,调控结肠癌侵袭、转移的作用机制和治疗结肠癌的有效靶点的研究仍是目前结肠癌研究领域的热门区域。
结肠癌细胞的侵袭、转移是一个复杂的过程,涉及到多种癌基因和抑癌基因的表达异常[13]。而miRNA表达异常是其中的重要环节,已被证实参与癌症发生发展过程,通常能作为肿瘤早期诊断标志物和肿瘤靶向治疗靶点[14]。研究表明,miRNA与靶基因mRNA上的非编码区域(R内含子区域或3′-UT)不完全或完全互补配对,通过降解靶基因或抑制靶基因的翻译,参与调控细胞增殖、分化、凋亡、组织发育等多种生理病理过程[5]。miR-152是miR-148/152家族的一员,据报道,miR-152在多种癌症中发挥抑癌作用。倪莎等[15]研究表明,miR-152可能通过靶向调节Mirk/Dyrk1B影响人卵巢癌干细胞球对紫杉醇的敏感性。研究[16,17]表明,miR-152通过抑制CDC25B或WNT1、ERBB3的表达,抑制人子宫内膜癌细胞和宫颈癌细胞增殖。本研究结果显示,沉默SW480细胞中miR-152表达后,SW480细胞OD值、迁徙细胞数、侵袭细胞数显著升高,提示miR-152在结肠癌SW480细胞中同样发挥抑癌作用,抑制miR-152表达后可促进SW480细胞的增殖、迁徙与侵袭,但在SW480细胞中的具体调控机制尚不明确。
IRS-1是胰岛素底物家族中的胰岛素受体酪氨酸激酶底物,是胰岛素样生长因子Ⅰ信号转导途径中最重要的底物,参与激活下游转导通路,发挥促进肿瘤细胞增殖、分化及迁移的作用[18]。李楠等[19]研究表明,IRS1可被miR-126靶向调控表达下调,抑制结肠癌增殖、侵袭及转移。Xu等[20]研究表明,过度表达miR-148a/mir-152通过靶向IGF-IR、IRS-1并抑制其下游AKT、MAPK/ERK信号通路,显著抑制乳腺癌细胞增殖、集落形成和肿瘤血管生成。本研究结果显示,沉默SW480细胞中miR-152表达后,SW480细胞中IRS-1 mRNA水平显著上升,提示结肠癌中miR-152可能靶向调控IRS-1 mRNA表达发挥作用,这与Xu等[20]在乳腺癌细胞中的研究一致,当沉默SW480中miR-152表达后,IRS-1表达上调参与SW480细胞增殖、迁徙、侵袭。
PCNA是增殖相关基因,参与SW480细胞增殖过程[21]。MMP-2、MMP-9是锌离子依赖的蛋白水解酶家族MMP家族成员,在肿瘤细胞侵袭中发挥重要作用[22]。本研究结果显示,沉默SW480细胞中miR-152表达后,SW480细胞中IRS-1、PCNA、MMP-2和MMP-9蛋白表达水平均显著升高,提示沉默SW480中miR-152表达后,上调IRS-1表达的同时,影响PCNA、MMP-2和MMP-9蛋白表达水平,促进SW480细胞增殖、迁徙与侵袭。
综上所述,miR-152可能靶向IRS-1表达,抑制结肠癌细胞增殖、迁徙及侵袭过程。但结肠癌增殖、迁徙、侵袭途径复杂,还需进一步探究miR-152靶向IRS-1过程涉及到的细胞内信号通路,及在不同结肠癌细胞中的作用途径,以期为治疗结肠癌提供有效靶点。

