主动脉瓣置换术后再发急性A型主动脉夹层手术治疗
杨灵波,王学宁,郑志发,张忠杰,张立魁,宗俊青,王 栋
(山西医学科学院,山西白求恩医院心脏大血管外科,太原 030032;*通讯作者,E-mail:wangxuening-2004@126.com)
据报道,主动脉瓣置换术(AVR)后A型主动脉夹层的发生率可达0.6%[1-3],手术治疗难度明显增加,术后重要脏器功能不全等并发症的发生率高,现将我院近期手术治疗的1例AVR后再发A型主动脉夹层患者情况报道如下,并对其发生的危险因素及术中要点进行总结分析。
1 病例简介
患者,男性,65岁,因“突发胸背部疼痛6 h”入院。患者于入院前6 h爬楼梯时突然出现胸背部撕裂样疼痛,伴出汗,持续不能缓解,急诊于当地医院转入我院。入院查体:平卧位,神志清楚,血压125/75 mmHg左右,心率85次/min左右,律齐,心前区可闻及机械瓣音,腹平软,周围征阳性。高血压病史15年,否认糖尿病病史。曾于2年前(2017年8月)因主动脉瓣狭窄伴关闭不全行主动脉瓣机械瓣置换术,术前超声心动图示,主动脉瓣中度狭窄伴中度关闭不全,升主动脉内径44 mm。本次入院超声心动图示:升主动脉扩张,内径53 mm,升主动脉内可见细线样内膜回声,将管腔分为真、假两腔,提示主动脉夹层(Stanford A型);主动脉瓣机械瓣启闭正常,未见瓣周漏;左房扩大,前后径38 mm;左室扩大,舒张末期内径(LVEDD)56 mm;心包腔少量积液(前心包腔液深0.6 cm)。入院主动脉CTA示,主动脉升、弓、降各段内膜撕裂,假腔大,真腔小,升主动脉管径5.5 cm,头臂干夹层受累,腹腔干及肠系膜上动脉起自假腔,左肾动脉闭塞,提示主动脉夹层(Stanford A型)(见图1)。实验室检查示:白细胞计数8.2×109/L,谷丙转氨酶(ALT)125.7 IU/L,谷草转氨酶(AST)211.2 IU/L,肌酸激酶(CK)310.5 IU/L,肌红蛋白147.8 ng/ml,血肌酐(Scr)95.6 μmol/L。血栓弹力图试验示:凝血因子活性8.9 min,纤维蛋白原功能2.2 min,60.3 deg,血小板功能59.4 mm。

图1 主动脉瓣置换术后再发A型主动脉夹层患者术前主动脉CTA检查结果
入院后施行急诊手术。采用静吸复合麻醉,中心静脉穿刺,同时建立上下肢动脉监测,监测鼻温及肛温,消毒铺单,备好股动静脉插管,游离腋动脉备用,随时做好紧急转机降温的准备。适当降低血压后正中开胸,仔细游离心脏,显露右心房、右上肺静脉入口、心尖等部位,游离弓部各分支,全身肝素化,经腋动脉插主动脉供血管,经右心房插腔房双极静脉管,经右上肺静脉插左心引流管,开始转机降温。头部放置冰帽。阻断升主动脉,切开升主动脉经冠脉开口行心肌保护,探查,升主动脉前外侧壁可见内膜破口,长约3.5 cm,升主动脉假腔形成,原主动脉机械瓣启闭正常,未见瓣周漏,夹层未累及左、右冠脉开口。取26#人工血管,用4-0 prolene线将人工血管、主动脉瓣环及机械瓣缝合环进行连续缝合,行升主动脉置换。在人工血管与左冠脉开口对应部位打孔,移植左冠脉开口。在人工血管与右冠脉开口对应部位打孔,取8 mm人工血管长约6 mm,移植右冠脉开口(见图2)。继续降温至26 ℃,停循环,经腋动脉施行选择性顺行脑保护,完成主动脉弓人工血管置换及降主动脉内支架置入术(即“孙氏”手术)。术毕行原主动脉外膜的包裹分流。深低温停循环时间32 min,体外循环时间178 min。
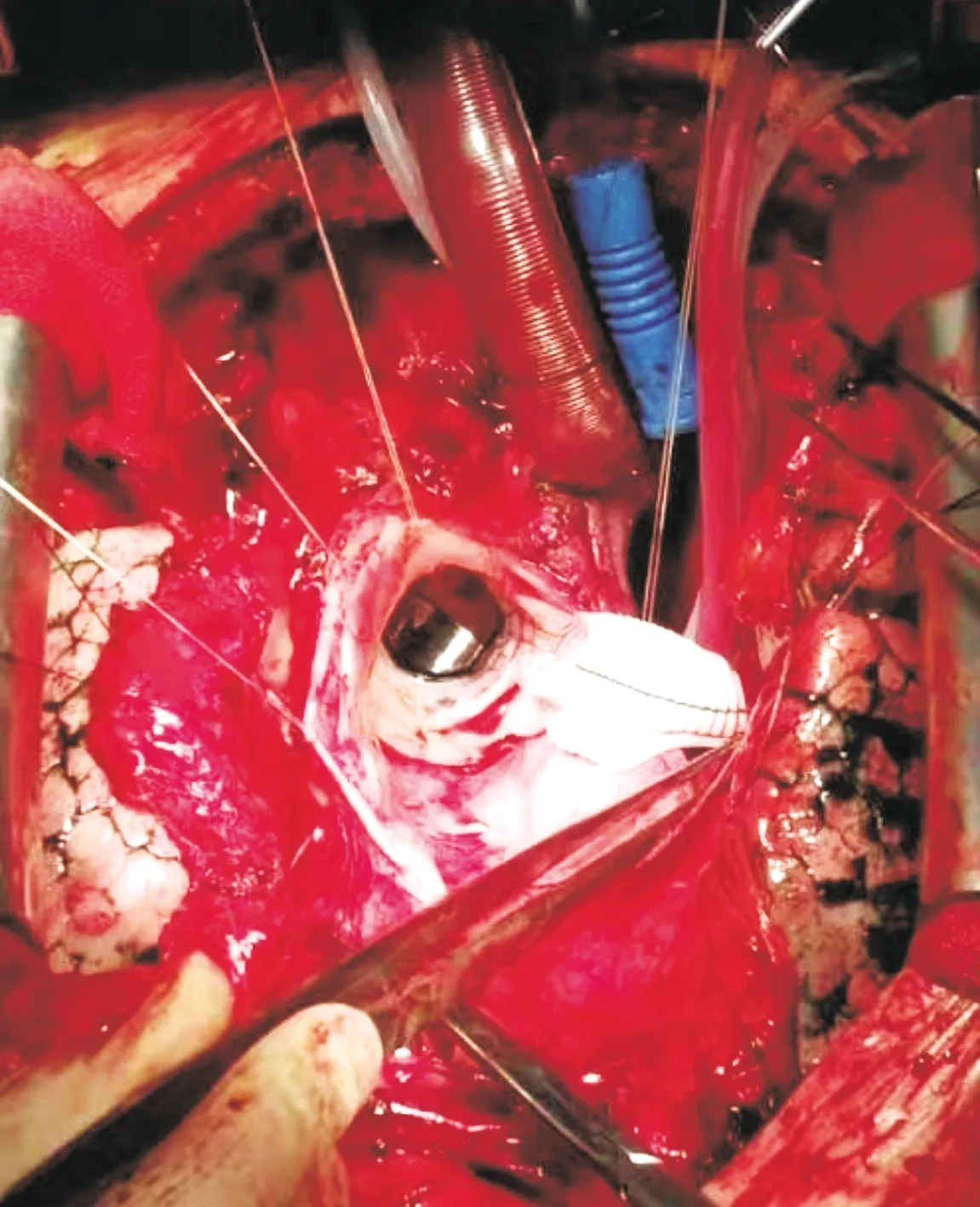
图2 主动脉瓣置换术后再发A型主动脉夹层患者术中所见
术后予呼吸机辅助,心率65-110次/min,血压90-150/50-95 mmHg,术后8 h起尿量呈减少趋势,30-60 ml/h,ALT 265.5 IU/L,AST 284.8 IU/L,CK 2 592 IU/L,Scr 259.8 μmol/L,尿素29.7 mmol/L,SpO292%-98%,使用连续性肾脏替代(CRRT)48 h,尿量逐渐恢复至100-150 ml/h。术后第3天ALT 97.4 IU/L,AST 91.2 IU/L,CK 428.5 IU/L,Scr 102.4 μmol/L,停用CRRT。术后呼吸机辅助70 h,ICU时间4 d,共引流1 050 ml,术后12 d治愈出院。
2 讨论
心脏直视术后发生Stanford A型主动脉夹层较为罕见,发生率为0.06%-0.23%,多见于主动脉瓣置换术(AVR)后,发生率可达0.6%[1-3]。心脏术后发生A型主动脉夹层有两种情况:①术中即刻发生;②术后数月或数年发生。前者需术中即刻处理,后者一旦诊断明确也需紧急手术干预。对于术后迟发的A型主动脉夹层,有报道其病死率可高达50%,手术难度增加,术后重要脏器功能不全等并发症的发生率较自然发生的A型主动夹层明显增高[1],此类病例预防意义大于治疗。
回顾性研究显示,AVR后迟发主动脉夹层的独立危险因素包括:主动脉壁脆弱、主动脉瓣反流、主动脉壁薄,危险度分别为22%,14%和7%,而如果三者均有则风险增加96%[4]。以往大多数研究者认同升主动脉直径>5.0 cm时,需在AVR中同时替换升主动脉,特别是合并主动脉瓣二瓣化畸形、主动脉瓣返流、常年高血压、男性、动脉粥样硬化、术中见动脉壁纤薄及弹性明显下降时,升主动脉直径>4.5 cm,即应该积极处理[5,6]。2010年美国和2014年欧洲主动脉疾病指南建议,对于主动脉瓣病变合并升主动脉扩张,直径>4.5 cm时即应同期行升主动脉替换,同时还需综合考虑患者年龄、体格、瓣膜疾病病理情况、手术中的情形、主动脉壁的厚薄、脆弱性等,如升主动脉最大直径或主动脉根部截面积(cm2)除以患者身高(m)超过10,可考虑行升主动脉置换[7,8]。另外研究发现,主动脉瓣关闭不全患者较主动脉瓣狭窄患者行AVR后更易发主动脉夹层[9]。对于主动脉瓣狭窄伴升主动脉扩张者,若患者高龄、合并症多,且升主动脉扩张范围局限于主动脉窦部至头臂动脉之间,可于AVR时行升主动脉成形加升主动脉包裹,但不包括主动脉瓣二叶畸形患者;对于主动脉瓣关闭不全伴升主动脉扩张者,应积极行升主动脉置换[10-13]。本例患者术前升主动脉直径扩大(44 mm),长年高血压病史,主动脉瓣狭窄合并关闭不全,因此我们认为AVR当时应积极行升主动脉置换,以防止继发主动脉夹层或升主动脉瘤。
AVR术后发生主动脉夹层,手术难度及病死率明显上升,我们总结二次主动脉手术方案的要点如下:①术前准备。行主动脉CTA明确主动脉病变,判断动脉瘤与胸骨的距离,超声心动图明确心脏功能及人工主动脉瓣情况,决定手术入路及体外循环方式,制定详尽手术方案,备体外除颤电极板,备血小板。②再次开胸。仔细操作,避免大出血,如主动脉与胸骨间有足够缝隙,可常规开胸及建立体外循环,粘连较紧,应果断先行股动脉或右腋动脉主动脉插管及股静脉插管,运转体外循环,降温至鼻温32 ℃左右,心脏停搏放空后再行开胸和游离,以降低主动脉破裂风险。③体外循环。推荐先考虑采用右腋脉插管行术中脑保护,右上肺静脉游离困难,可打开右侧胸膜,经胸腔置入右上肺静脉左心插管。④手术方式。根据人工瓣膜状态及主动脉病变范围决定手术方式,本例人工瓣启闭正常,夹层未累及冠脉开口,根部予施行升主动脉置换,而夹层累及主动脉弓部及降主动脉,予施行孙氏手术,将左冠状动脉开口直接与人工血管吻合,而右冠状动脉则通过一段8 mm人工血管与升主动脉人工血管相吻合,以防止吻合张力过大、冠状动脉扭曲导致冠状动脉供血障碍;另外手术吻合口较多,术前使用抗凝药物,二次手术创面广泛,因此术中将吻合口用原主动脉外膜包裹并引流至右心房,减少止血时间,防止术后感染。⑤术后处理。AVR再发主动脉夹层,术后重要脏器功能不全等并发症发生率高,需积极处理,本例患者术后早期出现尿量少,肝肾功能指标升高,及时给予CRRT,术后恢复顺利。
总之,AVR术中应根据升主动脉直径等情况决定是否同期行升主动脉替换;而AVR术后一旦发生主动脉夹层,应紧急施行手术,根据术前判断和术中情况,慎重选择手术方式,术后积极处理合并症。

