前列腺癌干细胞CD147的表达及与患者细胞免疫水平的相关性
李苏亮,刘 冰,袁小华,相 莲,王雨琛,叶 芸
(西安医学院第一附属医院输血科,西安 710077;*通讯作者,E-mail:yeyun236@163.com)
前列腺癌(prostate cancer,PCa)是男性泌尿系统较常见的恶性肿瘤之一,在欧美人群中的发病率高居首位,死亡率仅次于肺癌[1,2]。亚洲地区被认为是前列腺癌低发区,但随着我国人口老龄化的发展以及饮食结构的改变,前列腺癌的发病率呈现逐年升高的趋势[3]。目前临床选用的前列腺特异性抗原(PSA)等标志物的敏感性和特异性较差,难以满足临床需要[4]。因此,选择具有高敏感性和特异性的肿瘤标志物对于PCa的诊断和治疗具有重要意义。CD147作为免疫球蛋白家族的一员,在多种肿瘤细胞表面表达[5,6]。CD147通过刺激基质金属蛋白酶的合成,以不同的方式参与肿瘤的侵袭和转移[7]。研究表明CD147可能与PCa的发病机制密切相关[8],但是关于前列腺癌干细胞CD147的表达情况及CD147与细胞免疫水平之间的关系仍需进一步研究。因此,本研究选择2016-03~2019-06入院的60例前列腺癌患者作为对象,探讨CD147在前列腺癌干细胞中的表达及其与患者细胞免疫水平之间的相关性。
1 材料与方法
1.1 一般资料
收集2016-03~2019-06西安医学院第一附属医院接受手术治疗的转移性前列腺癌患者和未转移性前列腺癌患者各30例,患者一般资料见表1。术中收集患者的肿瘤组织,两组人群均空腹采集静脉血5 ml,室温静置30 min,3 000g离心15 min分离血清,-80 ℃冻存。本研究得到西安医学院第一附属医院伦理委员会批准。
表1 纳入患者的一般资料
Table 1 Characteristics of the included patients
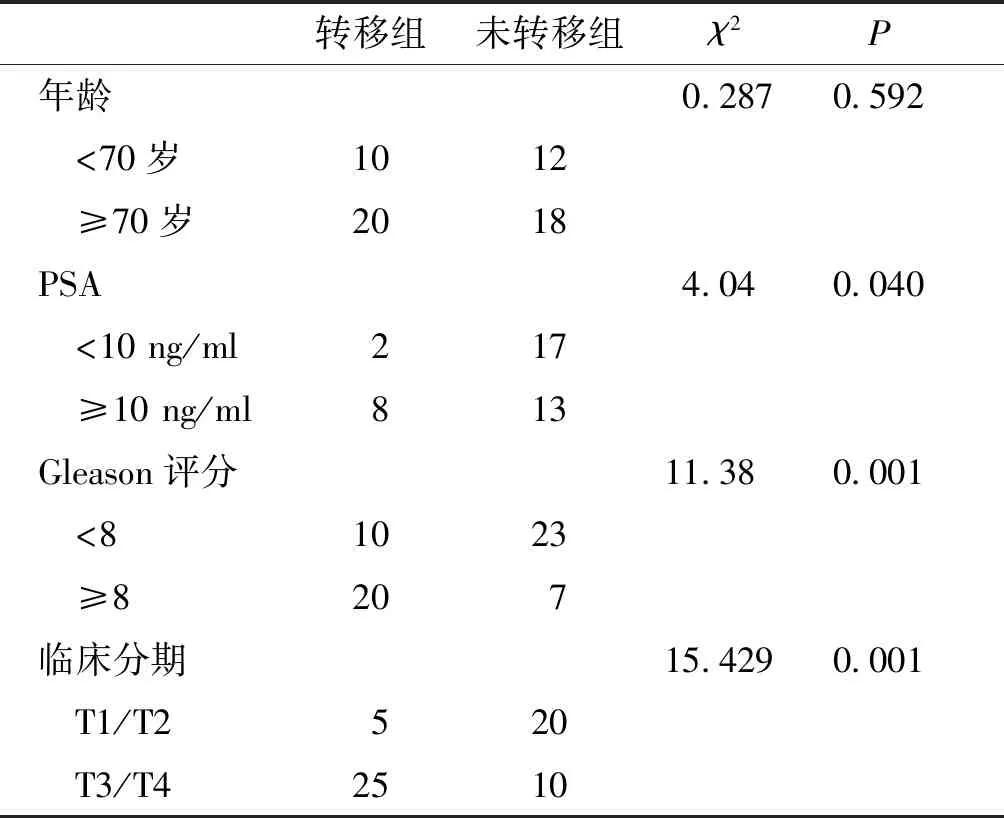
转移组未转移组χ2P年龄0.2870.592 <70岁1012 ≥70岁2018PSA4.040.040 <10 ng/ml217 ≥10 ng/ml813Gleason评分11.380.001 <81023 ≥8207临床分期15.4290.001 T1/T2520 T3/T42510
1.2 前列腺癌干细胞的分离培养
所有患者均行手术治疗,取前列腺癌癌病灶组织,采用差速离心法完成细胞分离。具体方法如下:将其放在含有10.0%胎牛血清的DMEM培养液中浸泡5 min,PBS反复冲洗后去除脂肪等组织,利用10 ml注射器抽取含有10.0%胎牛血清的培养基,4 500 r/min离心20 min,结束后用吸管轻轻吹打细胞,加入10 ml生理盐水进行重悬沉淀。对悬液再次离心,500 r/min离心5 min,加入10 ml生理盐水,以1.0×106/ml密度接种在培养瓶中,于37 ℃,5% CO2培养。
1.3 CD147阳性表达细胞数的测定
根据细胞的形态、生长曲线及流式细胞结果完成肿瘤干细胞鉴定[9]。取采集的前列腺癌干细胞,4 000 r/min离心15 min,采用流式细胞仪测定两组细胞中表达CD147的细胞数。取上述分离、制备的干细胞2×106/ml,加入24孔培养板中,将其放置在37 ℃ 5%CO2培养箱中培养,分别加入10 ml CD3-APC和CD4-FITC抗体,室温避光孵育30 min。洗涤后去除上清液,4%多聚甲醛进行固定,放置20 min。0.1%皂素进行10 min穿膜,去除上清液后每管留穿膜液重悬细胞200 μl;向实验管中加入10 μl Foxp3抗体,避光孵育1 h,洗涤后穿膜液重悬细胞500 μl后放入流式细胞仪上测定。
1.4 细胞因子检测
两组患者分别取空腹静脉血5ml,4 500 r/min离心15 min,血清分离完毕后采用酶联免疫吸附试验测定白细胞介素-2(IL-2)、干扰素-γ(INF-γ)水平、白细胞介素-10(IL-10)和白细胞介素-6(IL-6),操作步骤均按照试剂盒说明书完成。
1.5 统计学分析
2 结果
2.1 前列腺癌干细胞鉴定
倒置显微镜下前列腺癌干细胞接种在10%胎牛血清的DMEM培养基中,细胞生长曲线显示细胞第3天进入对数增长期,第9天进入平台期。流式细胞仪测定结果表明:前列腺癌干细胞表面标志物CD133+细胞群含量达到83.2%(见图1)。
2.2 转移组和未转移组CD147表达水平比较
转移组CD147阳性表达率33.7%(10/30),未转移组CD147阳性表达率6.7%(2/30),两组之间差异有统计学意义(χ2=6.667,P=0.01)。
2.3 转移组与未转移组炎症因子水平比较
转移组IL-2和INF-γ水平高于未转移组,转移组IL-10和IL-6水平低于未转移组(P<0.05,见表2)。
2.4 CD147的表达与细胞免疫水平相关性分析
转移组患者CD147的表达与IL-2和INF-γ水平呈正相关,但与IL-10和IL-6呈负相关(均P<0.05,见表3)。
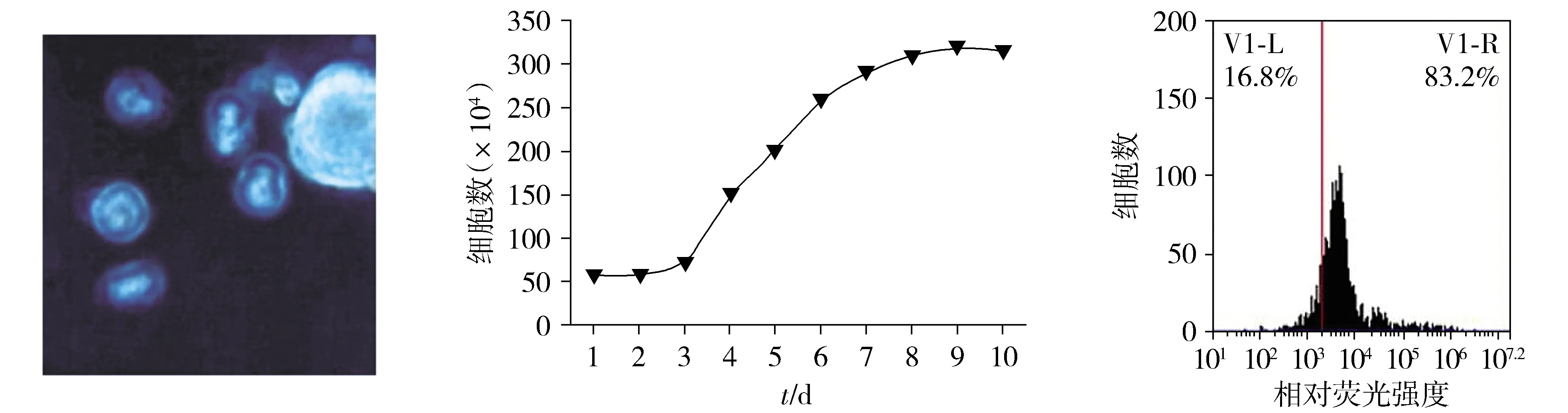
A.倒置显微镜结果 B.细胞生长曲线C.流式细胞术检测CD133的表达图1 前列腺癌干细胞的鉴定Figure 1 Identification of prostate cancer stem cells
表2 转移组与未转移组炎症因子水平比较
Table 2 Comparison of inflammatory factor levels between metastatic and non-metastatic prostate cancer patients
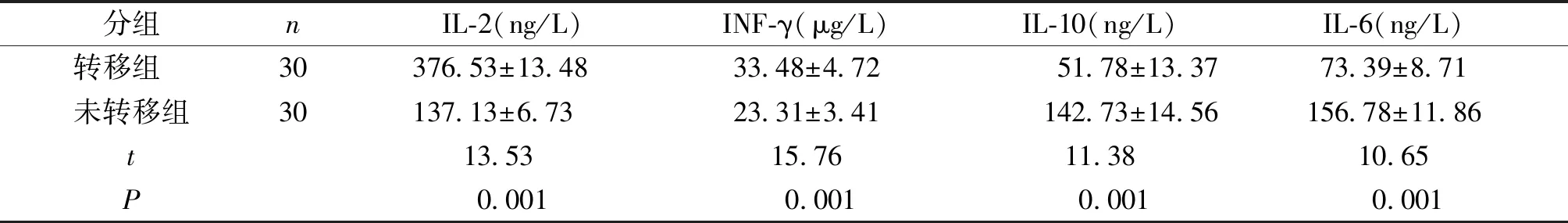
分组nIL-2(ng/L)INF-γ(μg/L)IL-10(ng/L)IL-6(ng/L)转移组 30 376.53±13.4833.48±4.7251.78±13.3773.39±8.71未转移组30 137.13±6.7323.31±3.41142.73±14.56156.78±11.86t13.53 15.7611.3810.65P0.0010.0010.0010.001
表3 CD147的表达与细胞免疫水平相关性分析
Table 3 Correlation analysis of CD147 expression and the level of cellular immunity

统计参数CD147与IL-2CD147与INF-γCD147与IL-10CD147与IL-6转移组未转移组转移组未转移组转移组未转移组转移组未转移组r0.4810.2530.6720.189-0.516-0.207-0.768-0.154P0.0180.1650.0230.2080.0190.1270.0120.196
3 讨论
2005年,Collins等[9]首次从前列腺癌组织中分离出肿瘤干细胞,其增殖和分化能力远大于其他前列腺肿瘤细胞,并可在雄激素缺乏条件下存活。肿瘤干细胞与肿瘤发生转移密切相关,该细胞不同于普通癌细胞,具有自我更新、无限分化潜能,是前列腺癌治疗失败的根本原因[10]。前列腺癌的发生、常伴有机体免疫系统与肿瘤细胞之间的相互作用,免疫系统通过重塑肿瘤细胞抗原性,影响机体免疫功能的正常发挥[11]。本研究从前列腺癌组织中分离获得前列腺癌干细胞,前列腺癌干细胞表面标志物CD133+细胞群含量达到83.2%;细胞生长曲线显示细胞第3天进入对数增长期,第9天进入平台期;流式细胞仪测定结果进一步确定本研究分离制备的干细胞为前列腺癌干细胞,能为本研究下一步实验的进行奠定基础。
CD147是属于免疫球蛋白超家族的一种高度糖基化Ⅰ型跨膜蛋白,其主要功能包括参与细胞间或者细胞和基质之间的黏附作用[12]。同时,CD147表达于所有的淋巴细胞表面,参与淋巴细胞的分化,作为细胞外基质金属蛋白酶的诱导剂发挥免疫调节作用[13,14]。研究发现CD147是肿瘤预后的指标,其可增强基质金属蛋白酶活性进而促进癌细胞迁移、入侵和转移,实现肿瘤细胞的自我更新并有助于肿瘤干细胞继续生长、发展[15]。CD147介导的糖酵解代谢可能在肿瘤微环境中诱导免疫逃逸,通过免疫机制逃避机体的免疫监视,从而提高了免疫耐受作用[16]。本研究中,转移性前列腺癌组CD147阳性表达率33.7%,未转移组CD147阳性表达率6.7%,两组之间差异有统计学意义(P<0.05)。
前列腺癌的发生、发展常伴有免疫水平的变化及炎症因子的共同参与[17]。根据分泌细胞因子不同将辅助性T淋巴细胞分为Th0、Th1、Th2及Th3四种不同的类型,而在人体中主要以Th1、Th2为主[18]。Th1细胞主要分泌IL-2和INF-γ等,能介导细胞毒作用,其表达水平与机体局部免疫应答有关,能辅助相关抗体的生成,直接参与细胞免疫。Th2主要分泌IL-4、IL-5、IL-6及IL-10等炎症因子,其表达水平多与体液免疫水平有关。Th1与Th2处于一个动态平衡,共同维持机体细胞免疫与体液免疫[19]。但是,前列腺癌患者由于癌细胞的持续增殖、生长,导致机体的免疫平衡被打破。本研究中,转移组IL-2和INF-γ水平高于未转移组(P<0.05);而转移组IL-10和IL-6水平低于未转移组(P<0.05)。进一步提示前列腺癌患者中伴有免疫水平失衡且与转移的发生发展有关。本研究中进一步分析了CD147的表达水平与前列腺癌患者细胞免疫水平的关系,结果显示转移性前列腺癌CD147在干细胞中表达与IL-2和INF-γ水平呈正相关性,而与IL-10和IL-6水平呈负相关(P<0.05)。结果说明转移性前列腺癌患者肿瘤干细胞CD147高表达进而促进Th1细胞活性导致机体细胞免疫与体液免疫失衡。80%-90%的前列腺癌患者晚期均有不同程度的转移,约50%的转移患者在确诊后30-35个月内死亡。因此,前列腺癌患者的CD147及细胞免疫水平的定期监测可有助于及时判断转移的发生与否并采取有效的措施进行治疗、干预。
综上所述,CD147在转移性前列腺患者的PCa干细胞中呈高表达,且与患者细胞免疫水平具有相关性。CD147表达水平及患者细胞免疫水平相关指标的检测对前列腺癌的病情判定及治疗、预后评估具有一定的临床指导价值。

