超声处理对红豆蛋白-叶黄素复合物结构和功能性质的影响
杜 琛,尹欢欢,赵城彬*,许秀颖,曹 勇,吴玉柱,张 浩,刘景圣*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
叶黄素是一种具有抗氧化作用的天然类胡萝卜素,广泛存在于绿色植物中,在玉米、万寿菊中含量丰富。有越来越多的证据表明叶黄素可以改善人体健康,延缓老化,并且能够抑制白内障和黄斑变性这两种常见眼病的发生[1]。红豆(Phaseolus angularis)又名赤豆,是一种高蛋白、低脂肪、营养丰富的食品。Meng等[2]对红豆中的蛋白质做了详细的研究,发现红豆中约50%的蛋白质为球蛋白,其中7S球蛋白为主要的组成成分,11S球蛋白次之;红豆球蛋白的氨基酸组成优于联合国粮食及农业组织/世界卫生组织的标准,通过圆二色谱研究发现,红豆蛋白富含α-螺旋和β-转角。
近年来,蛋白质与具有抗氧化作用的小分子如茶多酚、花青素、姜黄素、槲皮素等物质结合后发生物理化学性质的变化以及发生变化后的蛋白质对于健康的影响已经成为研究的一大热点。Chen Gang等[3]发现添加0.08%的茶多酚能够使大豆蛋白溶解度增加至0.50 g/mL,乳化活性提高约3 倍,达43.5%。Sui Xiaonan等[4]指出花青素的加入改变了大豆分离蛋白的二级结构,导致β-折叠含量减少,β-转角和无规卷曲含量增加。Chen Feiping等[5]报道了超声处理下大豆分离蛋白与姜黄素络合显著增加了蛋白质的粒径和ζ-电位,但导致表面疏水性的降低。Wang Yufang等[6]研究发现槲皮素与大豆蛋白结合后,其2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)自由基清除能力优于游离槲皮素。目前,蛋白质与小分子结合的研究多集中于动物蛋白,如乳蛋白、鱼类蛋白、牛血清白蛋白等,植物蛋白主要是大豆蛋白,而与红豆蛋白结合的研究相对较少。
超声波处理技术引起了食品工业的日益关注。超声波在食品中可用于辅助提取、灭菌、乳化、结晶、干燥等,主要是利用超声波的空化作用、机械效应及热效应等。Hu Hao等[7]报道大豆蛋白的游离巯基含量、表面疏水性和溶解度经超声波处理后均增加,而这些性质的改变可能有利于蛋白质与叶黄素的结合。为研究超声处理能否促进红豆蛋白与叶黄素的结合,从而提高叶黄素对红豆蛋白的修饰和功能改善作用,本实验采用超声处理制备红豆蛋白-叶黄素复合物,采用差示扫描量热仪(differential scanning calorimeter,DSC)和傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪分析其热特性和二级结构,并研究其表面疏水性、巯基含量、溶解度、起泡和乳化特性,试图探究结构变化与功能性质改善之间的构效关系,从而为研发功能性红豆蛋白及其产业化应用提供理论参考。
1 材料与方法
1.1 材料与试剂
实验材料所用红豆为‘白红11号’(蛋白质21.59%(质量分数,下同)、淀粉56.82%、脂肪0.74%、纤维7.98%、水分8.12%、灰分3.43%),购自吉林省白城市,将红豆中不完整的、有虫眼的颗粒及杂质除去,挑选颗粒光滑饱满、大小均匀的籽粒作为实验材料。玉米叶黄素为小麦和玉米深加工国家工程实验室自制。
8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonate,ANS) 上海源叶生物科技有限公司;溴化钾、5,5’-二巯基-2-硝基苯甲酸(5,5’-dithiobis-2-nitrobenzoic acid,DTNB) 美国Sigma公司;三羟甲基氨基甲烷(Tris) 美国Genview公司;乙酸乙酯(纯度99.5%)、无水乙醇等试剂均为国产分析纯。
1.2 仪器与设备
高速离心机 上海安亭科学仪器厂;ST300 pH计奥豪斯仪器(常州)有限公司;PC-620D磁力搅拌器美国Corning公司;723PC可见分光光度计 上海欧茂仪器有限公司;JY98-IIIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;K1100全自动凯氏定氮仪济南海能仪器股份有限公司;FLUO star Omega多功能酶标仪 德国BMG LRBTECH公司;Alpha1-4LDplus冷冻干燥机 德国Christ公司;Q2000 DSC 美国TA公司;VERTEX 70 FTIR仪 德国Bruker公司;FA28间歇式高剪切机 德国Fluko公司。
1.3 方法
1.3.1 红豆蛋白提取
根据徐向东[8]的方法,并稍作修改。称取豆粒,按1∶5(m/V)的比例加入蒸馏水在室温下浸泡24 h。将浸泡过的豆瓣去除种皮和胚芽,并冲洗干净。分批按质量比1∶3加入蒸馏水后利用打浆机将其充分打磨成浆,将豆渣和豆浆的混合物过100 目筛,此步骤重复3~4 次,弃去筛上物。用NaOH溶液调节pH值至8~9,室温下搅拌4 h,使蛋白质充分溶解,用离心机4 000 r/min离心15 min。分离上清液,将沉淀重复以上步骤,合并上清液。将所得溶液用HCl溶液调节pH值至4.5,室温下搅拌30 min,4 000 r/min离心15 min,将沉淀复溶后用HCl、NaOH溶液调节至pH值为7,然后冷冻干燥即得到红豆蛋白。采用凯氏定氮法(GB/T 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》)测定蛋白质量分数,得到红豆蛋白中蛋白质量分数为79.87%。
1.3.2 红豆蛋白-叶黄素复合物制备
将红豆蛋白溶解于pH 7.4、10 mmol/L磷酸盐缓冲液中,用磁力搅拌器搅拌4 h形成1 g/100 mL的蛋白溶液,保存在4 ℃下。将叶黄素分散在乙醇中使其浓度为2 mmol/L,贮存在4 ℃下备用。在磁力搅拌下将叶黄素溶液逐渐滴加到红豆蛋白溶液中,使叶黄素浓度为60 μmol/L,而蛋白质量浓度保持不变,在室温下继续搅拌1 h,得到红豆蛋白-叶黄素混合液。将混合液置于冰浴中,使其温度低于2 ℃,然后将超声探头插入液面以下,距离溶液底部1 cm处,在20 kHz的频率下按表1进行超声处理,超声处理采用间歇式,即每次超声4 s,间隔2 s。对超声处理后的溶液一部分进行结合率的测定,另一部分溶液冷冻干燥,贮存在室温下的密封袋中备用。对照组为未经过超声处理的红豆蛋白-叶黄素混合液,其他操作与超声处理的样品相同。
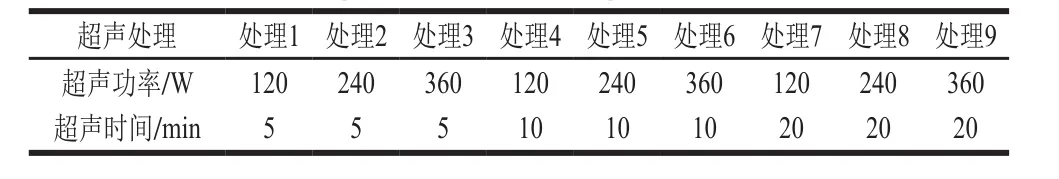
表1 红豆蛋白-叶黄素复合物制备的超声处理条件Table 1 Ultrasonic treatment conditions for preparation of red bean protein-lutein complexes
1.3.3 结合率的测定
将超声处理后的溶液在5 000 r/min下离心20 min,取上清液进行萃取。在搅拌条件下,按体积比为1∶3的比例加入乙酸乙酯萃取溶液30 s,然后静置30 min,使其完全分离成乙酸乙酯和水层,测定上清液在500 nm波长处的吸光度。将2 mmol/L的叶黄素醇溶液加入到一定体积的乙酸乙酯中,使乙酸乙酯中叶黄素浓度分别为25、50、75、100、200 μmol/L,然后测定溶液在500 nm波长处的吸光度,得到以叶黄素浓度为x、吸光度为y的标准曲线:y=0.009 2x+0.012 8(R2=0.999 2)。通过标准曲线得到上清液的叶黄素浓度,再通过公式(1)计算叶黄素的结合率。

1.3.4 热特性的测定
样品的热特性通过DSC测定,参考赵城彬等[9]的方法。称取2 mg样品粉末于铝盘中,密封压片后,放入DSC中准备测定,以空铝盘为对照,测定条件为扫描速率10 ℃/min,扫描范围25~200 ℃。
1.3.5 FTIR光谱的测定
根据Zhao Chengbin等[10]的方法,使用FTIR仪分析样品蛋白的二级结构。将样品与KBr以1∶100(m/m)混合均匀,并进行压片。光谱记录在600~4 000 cm-1的范围内,并且以4 cm-1的分辨率进行11 次扫描。通过Peakfit 4.12软件拟合α-螺旋、β-折叠、β-转角和无规卷曲的特征峰。
1.3.6 表面疏水性的测定
按照Zhao Chengbin等[11]的方法并进行了一些修改,使用荧光探针ANS测定样品的表面疏水性。用10 mmol/L磷酸盐缓冲液(pH 7.4)稀释样品得到0.01、0.02、0.05、1.00 mg/mL溶液,取8 mmol/L的ANS溶液20 μL与蛋白质溶液2 mL混合,并在25 ℃下静置3 min。将试样(200 μL)置于96 孔酶标板中用于荧光强度(fluorescence intensity,FI)的测定。建立以蛋白质量浓度为横坐标、FI值为纵坐标的曲线,并将这些曲线的初始斜率作为表面疏水性。
1.3.7 巯基含量的测定
用Ellman试剂法[12]测定巯基含量。总巯基含量测定:用Tris-Gly缓冲液(含0.086 mol/L Tris、0.09 mol/L Gly、0.04 mol/L EDTA,pH 8)配制质量浓度为4 mg/mL的DTNB溶液,即Ellman试剂。测定时,将15 mg样品溶于5 mL Tris-Gly缓冲液,加入50 μL Ellman试剂,在25 ℃条件下保温反应1 h,5 000×g离心10 min,取上清液在412 nm波长处测定吸光度,以等量蒸馏水替代样品作为空白对照。游离巯基含量测定:除Tris-Gly缓冲液(0.086 mol/L Tris、0.09 mol/L Gly、0.04 mol/L EDTA、8 mol/L尿素,pH 8)与总巯基含量测定时不同,其余步骤均相同。
1.3.8 溶解度的测定
将样品溶液(5 mg/mL)以10 000×g离心20 min,收集上清液,通过凯氏定氮法测定氮含量/(g/g),蛋白质溶解度通过公式(2)计算。

1.3.9 乳化性及乳化稳定性测定
取10 mL 0.1 g/100 mL待测样品溶液(样品溶于pH 7的磷酸盐缓冲液中),加入大豆油3 mL,在室温下用均质机以10 000 r/min的转速搅拌1 min,迅速从底部取样,用0.1 g/100 mL的十二烷基硫酸钠溶液将其稀释100 倍,然后在500 nm波长处测定其吸光度(A0),以A0表征乳化性;在25 ℃下放置30 min后,再测500 nm波长处的吸光度(A30)。乳化稳定性通过公式(3)计算。
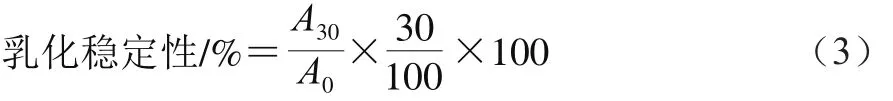
1.3.10 起泡性及泡沫稳定性测定
取20 mL 1 g/100 mL的样品溶液使用均质机以10 000 r/min搅打2 min产生泡沫。记录刚形成泡沫的样品溶液的体积(V0/mL);静置30 min后,记录体积(V30/mL)。起泡性和泡沫稳定性分别通过公式(4)、(5)计算。

1.4 数据统计与分析
所有测定至少设3 个平行,结果均以平均值±标准差表示。利用SPSS软件进行单因素方差分析和Duncan检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同超声处理下复合体系中红豆蛋白与叶黄素的结合率

图1 红豆蛋白-叶黄素复合物的结合率Fig. 1 Binding rate of red bean protein-lutein complexes
如图1所示,与未进行超声处理的对照组相比,在不同超声处理条件下,红豆蛋白与叶黄素的结合率得到不同程度的提高,由65.18%(对照组)提高到71.70%~91.82%,在240 W超声处理10 min(处理5)时结合率达到最大,表明超声处理可以促进叶黄素与红豆蛋白的结合。无论超声功率的强弱,随着超声时间的延长,结合率先升高后下降;而超声时间较短(5 min)时,结合率随超声功率升高而升高,超声10 min时,呈先增加后减少的趋势,超声时间达20 min时,超声功率越大其结合率反而越小。原因可能是适度的超声处理会导致蛋白质分子结构的展开,使疏水基团更多地暴露,从而导致超声促进了叶黄素与蛋白质的结合;而过度超声处理严重破坏了蛋白质的结构,可能会导致蛋白质分子重新聚集[13],阻碍了其与叶黄素的结合。
2.2 不同超声处理下红豆蛋白-叶黄素复合物的热特性分析结果

图2 红豆蛋白-叶黄素复合物的DSC图Fig. 2 Differential scanning calorimetric thermograms of red bean protein-lutein complexes
峰值温度(Tp)反映蛋白质的变性温度,热焓变(ΔH)表示诱导蛋白质变性所需的热量,而蛋白质有序构象的情况可以通过ΔH反映[14]。由图2可知,所有红豆蛋白-叶黄素复合物与红豆蛋白都是在100 ℃附近出现一个吸收峰,经过超声处理的复合物比对照组的图谱稍向左偏移。叶黄素晶体在157 ℃出现熔融峰,而复合物在此温度未见熔融峰,说明叶黄素以无定形形式存在于粉末颗粒中,表明红豆蛋白-叶黄素复合物的形成。
表2为红豆蛋白-叶黄素复合物的热力学参数。与红豆蛋白相比,对照组的Tp由108.34 ℃下降至101.10 ℃,ΔH从283.90 J/g减少至270.90 J/g,说明红豆蛋白-叶黄素复合物的变性温度降低,在变性时所需的热量减少。超声处理后复合物的Tp和ΔH进一步降低,但是Tp下降得并不显著(P>0.05),而ΔH显著下降(P<0.05),且在240 W超声处理10 min(处理5)时Tp和ΔH达到最低,这可能与此超声条件下较高的结合率有关。此外,Nazari等[15]对超声处理谷子蛋白的功能性质和结构进行研究,发现超声作用也能够促使蛋白质结构变得松散和无序化,这有可能利于蛋白质功能性质的改善。然而,高功率长时间的超声处理(360 W、20 min)又会使ΔH有所上升,这可能是蛋白质分子重新聚集导致的[16]。
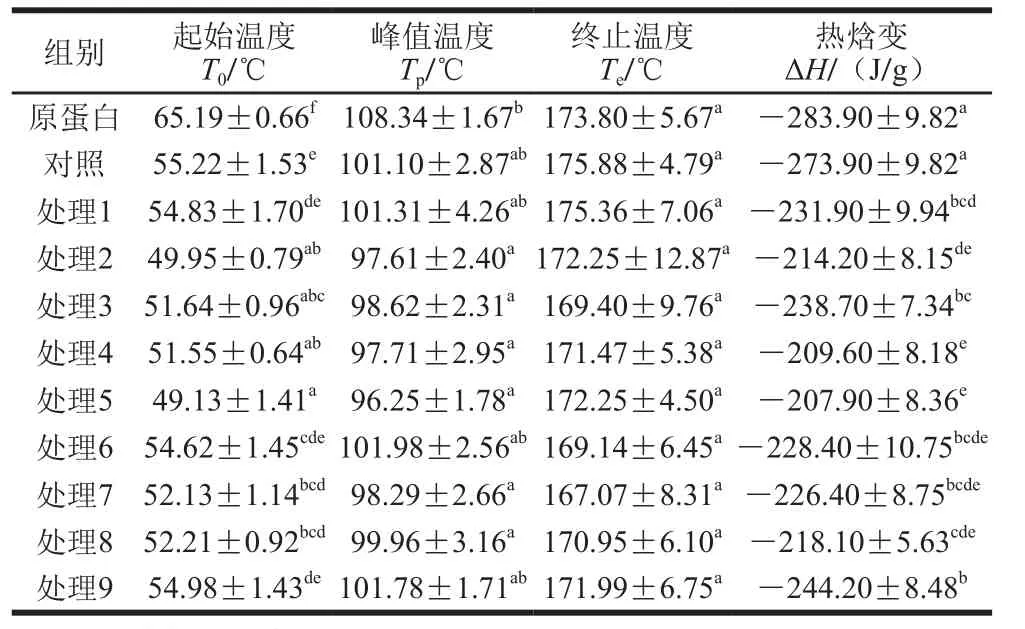
表2 红豆蛋白-叶黄素复合物的热力学参数Table 2 Thermodynamic parameters of red bean protein-lutein complexes
2.3 不同超声处理下红豆蛋白-叶黄素复合物的FTIR分析结果
由图3可知,红豆蛋白的FTIR光谱与红豆蛋白-叶黄素复合物不同,主要是在3 100~3 600 cm-1波数范围内,复合物形成了较宽的强吸收峰,表明这些官能团参与了与叶黄素的结合,形成了稳定的蛋白质-叶黄素复合物,这一结果与Xiang Huan等[17]对大豆蛋白-姜黄素复合物的研究结果类似。叶黄素的加入引起了红豆蛋白的酰胺II带从1 572 cm-1移至1 541 cm-1处,说明叶黄素引起了红豆蛋白二级结构的变化。Shen Fei等[18]研究卵清蛋白和茶多酚的相互作用发现,在pH 7.5的条件下加入茶多酚后卵清蛋白的酰胺I、II带发生蓝移。常用酰胺I带(1 700~1 600 cm-1)和酰胺II带(1 600~1 500 cm-1)的红外吸收光谱研究蛋白质的二级结构,酰胺I带的特征振动取决于C=O与N—H之间的氢键性质,酰胺II带主要是由C—N伸缩振动和N—H弯曲振动产生的[19]。与红豆蛋白相比,无论是否经过超声处理,红豆蛋白-叶黄素复合物的酰胺I带和酰胺II带的红外吸收强度都出现增加,这表明叶黄素分子中的氧原子、羟基与蛋白分子中C=O、C—N基团可能通过疏水作用力等结合[20],说明叶黄素使红豆蛋白二级结构有一定程度的改变。
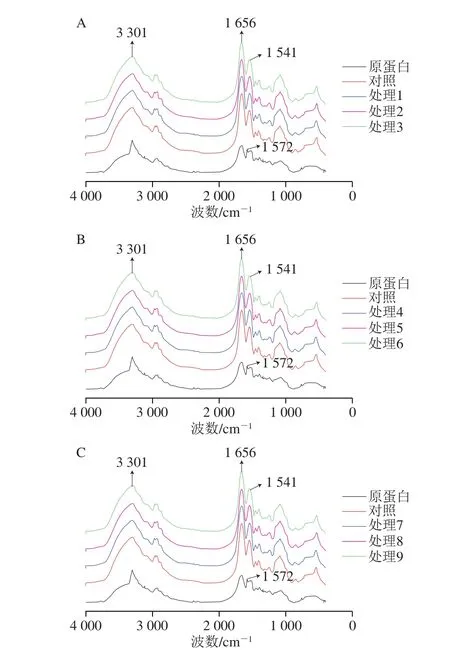
图3 红豆蛋白-叶黄素复合物的FTIR光谱Fig. 3 Fourier transform infrared spectra of red bean protein-lutein complexes
蛋白质二级结构的定量关系与其酰胺I带的光谱吸收密切相关,通过Peakfit 4.12软件拟合得到红豆蛋白-叶黄素复合物的二级结构含量,结果见表3。对照组与红豆蛋白相比,α-螺旋相对含量降低4.78%,β-折叠相对含量降低7.02%,无规卷曲相对含量增加17.93%,β-转角相对含量没有显著变化(P>0.05),这说明红豆蛋白与叶黄素结合后,蛋白质的二级结构变得无序,花青素与大豆分离蛋白的相互作用也是类似结果[4]。不同超声处理条件对红豆蛋白-叶黄素复合物的二级结构具有不同影响。在低功率和短时间(处理1)的超声处理下,与对照组相比,复合物的α-螺旋相对含量减少,无规卷曲相对含量增加,而β-折叠和β-转角相对含量均没有显著变化(P>0.05),这说明低功率和短时间的超声处理能够使复合物二级结构由α-螺旋转变为无规卷曲,这种转变在240 W超声处理10 min(处理5)时效果最明显。α-螺旋是通过肽链的内部氢键稳定,而β-折叠通过肽键之间的氢键而稳定,由于超声处理导致蛋白质分子结构展开,氢键被削弱,从而使蛋白质的结构变得无序和灵活[21],这也可能是超声能够促进红豆蛋白与叶黄素结合的原因,进而利于蛋白质功能性质的发挥[22]。然而,随着超声处理的不断进行,在高功率和长时间的超声处理下,复合物的α-螺旋和β-折叠相对含量降低,β-转角相对含量开始增加,而无规卷曲相对含量变化不显著(P>0.05),这说明高功率和长时间的超声处理可能不利于α-螺旋结构向无规卷曲结构转变,而是转变成另一种有序的β-转角结构。然而,Hu Hao等[7]在对大豆分离蛋白进行超声波处理时发现,高功率(400 W和600 W)、长时间(30 min)超声处理可以增加α-螺旋相对含量,减少β-转角和无规卷曲相对含量,与本实验结果矛盾,这可能是超声条件、溶剂环境、蛋白质类型等不同导致的。
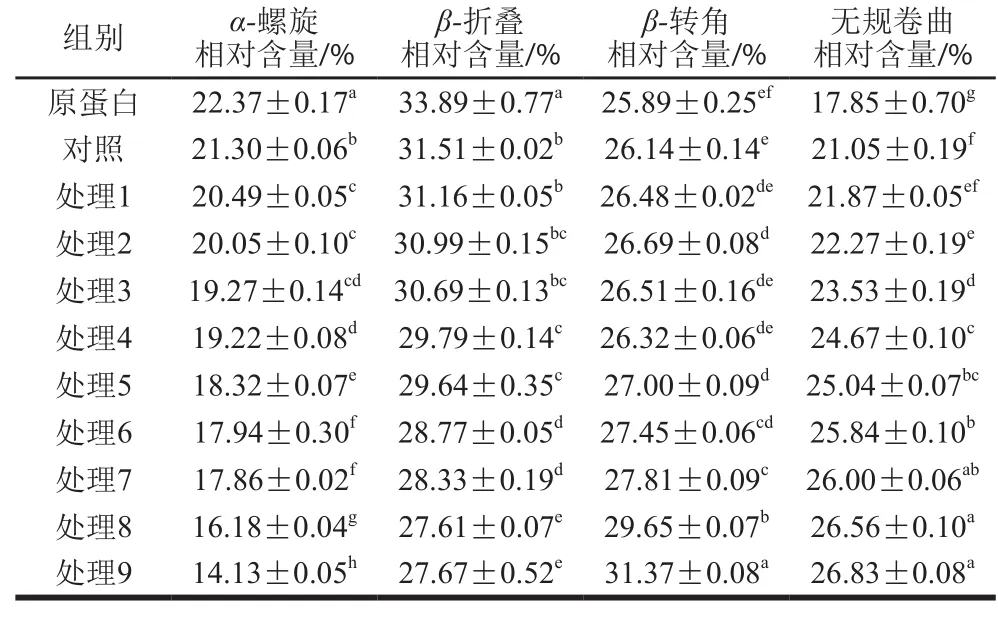
表3 红豆蛋白-叶黄素复合物的二级结构含量Table 3 Secondary structure contents of red bean protein-lutein complexes
2.4 不同超声处理下红豆蛋白-叶黄素复合物的表面疏水性

图4 红豆蛋白-叶黄素复合物的表面疏水性Fig. 4 Surface hydrophobicity of red bean protein-lutein complexes
蛋白质表面疏水性是表征与极性水环境接触的蛋白质表面疏水基团数目的指标,并且与其乳化性质密切相关。由图4可知,叶黄素与红豆蛋白的结合使蛋白质表面疏水性显著下降(P<0.05),这可能是由于叶黄素与蛋白质通过疏水键结合,这一现象与对姜黄素-大豆分离蛋白复合物的研究结果[5]一致。经超声处理后的复合物表面疏水性显著升高(P<0.05),且高于红豆蛋白,这表明超声处理对红豆蛋白表面疏水性的增加作用大于叶黄素对表面疏水性的降低作用。对β-伴大豆球蛋白[23]和黑豆蛋白[24]进行超声处理时,也观察到类似现象。随着超声功率增加和超声时间的延长,表面疏水性呈先升高后降低的趋势,在240 W超声处理10 min(处理5)时,复合物的表面疏水性达到最大。这表明适当的超声处理诱导蛋白质分子发生一定程度的解折叠,从而导致最初在分子内部的疏水基团和区域暴露于极性环境的数量增加;当超声处理过度时,蛋白颗粒之间通过静电等非共价作用发生聚集,导致部分疏水基团又被重新包埋。
2.5 不同超声处理下红豆蛋白-叶黄素复合物的巯基含量
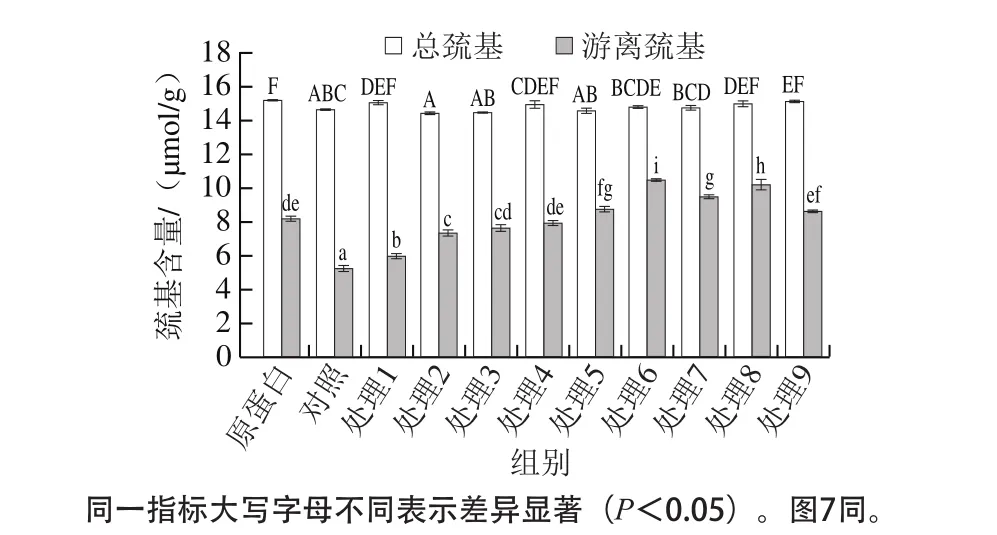
图5 红豆蛋白-叶黄素复合物的巯基含量Fig. 5 Sulfhydryl contents of red bean protein-lutein complexes
含有巯基的功能蛋白主要是通过巯基与二硫键的相互转化来实现其功能的。游离巯基对于维持蛋白质三级结构有重要作用,可参与次级键的形成,其含量能够反映蛋白质的变性程度,但是极容易被氧化成二硫键。由图5可知,叶黄素的结合使红豆蛋白游离巯基含量显著下降(P<0.05),这可能是由于蛋白质与叶黄素中羟基基团发生相互作用,导致巯基含量的下降,Sui Xiaonan等[4]在花青素-大豆蛋白复合物的研究中也观察到类似的现象。超声处理可使红豆蛋白-叶黄素复合物的游离巯基含量显著升高(P<0.05),这可能是由于超声处理改变了蛋白质的构象,破坏了蛋白质分子之间的一些二硫键,形成新的游离巯基[25]。与未经超声处理的复合物相比,在较短超声时间(5 min)处理时,复合物的游离巯基含量增加,且随超声功率增加而增加,但低于红豆蛋白的游离巯基含量。当超声条件达到240 W处理10 min(处理5)以后,复合物的游离巯基含量高于红豆蛋白,这表明适当的超声处理能够有效抑制叶黄素对红豆蛋白游离巯基的降低作用,甚至改善其游离巯基的暴露。然而,在较高超声功率(360 W)和较长超声时间(20 min)处理时,复合物的游离巯基含量相较于处理5、6、7、8组而言又有一定程度的降低,这可能是长时间高功率的处理使游离出来的巯基被氧化导致的[26]。对于总巯基含量,经不同超声处理后,其变化并没有明显的趋势,这一现象与Jambrak等[27]的研究结果一致。
2.6 不同超声处理下红豆蛋白-叶黄素复合物的溶解度
蛋白质与水之间的作用力主要是蛋白质中的肽键(偶极-偶极相互作用或氢键),或氨基酸的侧链(解离的、极性甚至非极性基团)同水分子之间发生了相互作用,蛋白质变性的程度也可以通过蛋白质溶解度评价。由图6可知,与叶黄素的结合能够显著提高红豆蛋白的溶解度(P<0.05),其原因可能归结于叶黄素与蛋白质之间的非共价作用使蛋白的表面疏水性下降(图4)。与对照组相比,所有经超声处理的红豆蛋白-叶黄素复合物的溶解度均显著增加(P<0.05)。从整体上看,随着超声时间延长及超声功率的增加,红豆蛋白的溶解度呈先增加后减小的趋势,当超声条件为240 W处理20 min(处理5)时,复合物的溶解度达到最大值(71.48%),这可能与复合物具有较高的结合率有关。这意味着适当的超声处理可进一步提高蛋白质-叶黄素复合物的溶解度。一方面,超声的空化作用能够破坏蛋白质内部的二硫键,使蛋白质分子展开,分子体积减小,与水的相互接触面积增大,从而导致溶解度的增加[7];另一方面,超声处理使蛋白质分子发生变性,强化了蛋白质与水的相互作用,因此复合物的溶解度有所提高。然而,过度超声处理会使将蛋白质分子聚集在一起的一些物理作用力遭到高强度超声的破坏,释放出不溶性蛋白质聚集体,导致溶解度降低[28]。
2.7 不同超声处理下红豆蛋白-叶黄素复合物的乳化性及乳化稳定性

图7 红豆蛋白-叶黄素复合物的乳化性及乳化稳定性Fig. 7 Emulsifying capacity and emulsion stability of red bean protein-lutein complexes
由图7可知,与未处理的红豆蛋白相比,红豆蛋白-叶黄素复合物的乳化性和乳化稳定性均有所增加,但是变化不显著(P>0.05)。蛋白质乳化作用与其溶解度和表面疏水性均有关,虽然与叶黄素的结合使红豆蛋白的溶解度增加,但会降低其表面疏水性,这可能是导致其乳化性没有显著变化的原因。与对照组相比,超声处理会显著提高复合物的乳化性和乳化稳定性(P<0.05)。随着超声功率的增加和超声时间的延长,乳化性先增加后减小。在较低功率(120 W)或较短时间(5 min)的超声处理下,复合物的乳化稳定性随超声处理时间延长或超声功率增加呈增加趋势;而在高功率(360 W)和长时间(20 min)的超声处理下,复合物的乳化稳定性与360 W、10 min和240 W、20 min处理组相比出现了显著降低(P<0.05)。当超声条件为240 W处理10 min(处理5)时,乳化性和乳化稳定性达到最大,这与此超声条件下复合物具有最高的溶解度和表面疏水性有关。适当的超声功率(240 W)和处理时间(10 min)能够使蛋白质空间结构分散,蛋白质发生适度变性,有效暴露出疏水基团,同时增强其溶解度,促进了蛋白质与叶黄素的相互作用,从而使乳化性和乳化稳定性提高[29]。此外,此超声条件下复合物的结构更加松散、热稳定性更低,二级结构更加无序和灵活,这也可能是导致乳化作用增强的原因。然而,高功率(360 W)和长时间(20 min)的超声处理会使蛋白质严重变性,产生较多的不溶性蛋白[30]。同时,过度超声处理使复合物中蛋白质分子重新聚集,使其结构更加紧密和有序,导致其乳化作用降低,与DSC和FTIR分析结果符合。研究证明不同超声处理对大豆蛋白在油-水界面的结构重排分散产生不同的影响,从而表现出不同的乳化性和乳化稳定性[27]。
2.8 起泡性及泡沫稳定性分析
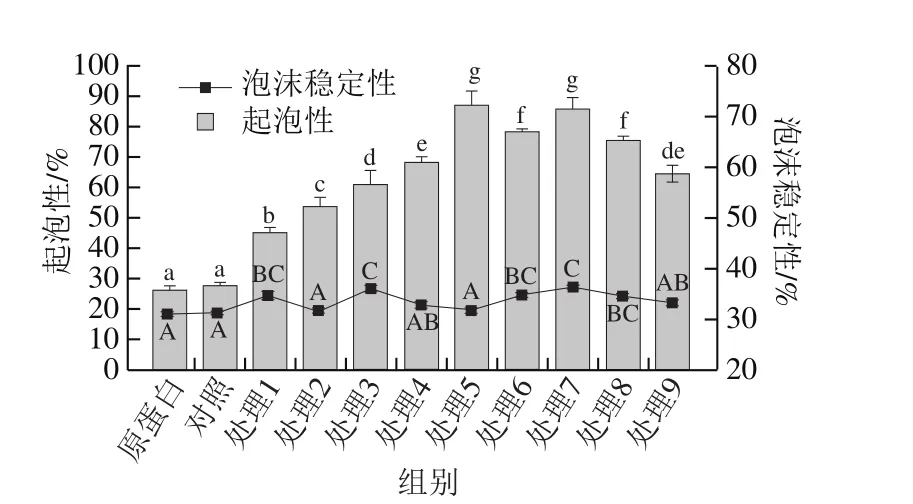
图8 红豆蛋白-叶黄素复合物的起泡性及泡沫稳定性Fig. 8 Foaming capacity and foam stability of red bean protein-lutein complexes
由图8可知,与未处理的红豆蛋白相比,与叶黄素的结合不会使蛋白质的起泡性发生显著变化(P>0.05)。然而,超声处理可以显著提高红豆蛋白-叶黄素复合物的起泡性。随超声时间延长或超声功率增加,在较低功率(120 W)或较短时间(5 min)的超声处理下复合物的起泡性呈增加趋势;而在较长时间(20 min)时,复合物的起泡性又显著降低(P<0.05),同时在功率240W、10 min处理下起泡性最大,这说明适当的超声处理能够有效改善复合物的起泡性。这可能是由于超声作用使蛋白质内部疏水基团暴露,在提高表面疏水性的同时降低了气-水界面的表面张力[31]。毕爽等[32]研究指出蛋白质经超声处理解聚成小分子亚基,增加了气-水界面的蛋白分子数目,导致起泡能力提高。而高功率和长时间的超声作用使复合物中蛋白质发生聚集,导致其起泡性的降低。此外,复合物起泡性的变化也可能与超声作用引起其结构改变有关,这在本实验热稳定性和二级结构的分析中可以得到证明。红豆蛋白与叶黄素形成复合物后泡沫稳定性没有显著变化(P>0.05),且超声处理也不会明显改善复合物的泡沫稳定性,这与大豆蛋白[13]和蛋清蛋白[25]经超声处理的研究结果一致。然而,Tan等[33]指出随着超声功率增加和超声时间的延长,乳清蛋白泡沫稳定性增加,产生这种差异的原因可能与蛋白质种类和浓度、分子结构、亲水/疏水能力以及超声处理条件等因素有关。
3 结 论
超声处理能够促进红豆蛋白与叶黄素的结合,在240 W超声处理10 min时,结合率达到最大(91.82%)。热特性分析表明红豆蛋白与叶黄素形成了复合物,复合物的形成使峰值温度(Tp)和热焓值(ΔH)降低,超声处理会使复合物的Tp和ΔH进一步下降,结构变得松散。适当的超声处理会使复合物二级结构中的α-螺旋转变为无规卷曲结构,无序化增加导致表面疏水性和游离巯基含量升高。功能性质分析表明与叶黄素的结合增加了红豆蛋白的溶解度,而复合物的乳化性和乳化稳定性以及起泡性和泡沫稳定性没有显著改变。超声处理进一步改善了复合物的功能性质,在240 W超声处理10 min时,复合物的溶解度、乳化性、乳化稳定性和起泡性达到最大。然而超声处理并未对复合物的泡沫稳定性产生明显影响。这些功能性质的改善可能与蛋白质结构变的松散和无序化程度增加有关。

