红曲霉产胞外多糖的条件优化及功效活性的初步检测
李月婵,张子祎,魏学源,常莉,杨薇
红曲霉产胞外多糖的条件优化及功效活性的初步检测
李月婵,张子祎,魏学源,常莉,杨薇通信作者
(天津农学院 基础科学学院,天津 300384)
对红曲霉液态发酵生产多糖的培养基组成及工艺条件进行了优化,同时对红曲霉液态发酵多糖的提取纯化及其抗氧化性、抑菌性进行了初步研究。在由40 mg/mL大米粉、10 mg/mL大豆粉、0.15 mg/mL KCl、0.15 mg/mL KH2PO4、0.15 mg/mL NaCl组成的培养基中液态发酵,通过单因素试验,得到优化后的发酵工艺条件为:发酵培养基保持初始pH值,温度为32 ℃,转速为180 r/min。在此条件下,红曲霉摇瓶液态发酵的多糖质量浓度达到142.3 mg/mL,是优化前的1.3倍左右。试验结果表明,红曲霉胞外多糖清除DPPH自由基能力较好,清除羟自由基的能力较弱;且红曲多糖对大肠杆菌和产气杆菌有一定的抑菌效果,但对枯草芽孢杆菌没有抑菌性。
红曲霉胞外多糖;条件优化;多糖的提取;抗氧化性;抑菌性
红曲霉是我国传统中药红曲的基原菌,是一种嗜酸的小型丝状腐生真菌[1],据《本草纲目》记载,红曲具有消食、化瘀等疗效,是“药食同源”的典型代表[2]。近年来,红曲霉的次级代谢产物逐渐成为研究焦点,其降压、降脂、抑菌和抗肿瘤的功效也逐步被开发利用。我国对红曲霉菌的研究大多集中在色素、胆固醇抑制剂及洛伐他汀等方面,但对红曲霉胞外多糖的生物活性及高产红曲多糖的发酵条件等方面研究较少[3-4]。因此,本研究以红曲霉作为生产菌株,以大米粉为培养基的主要基质进行液态发酵,将发酵液中胞外多糖的含量为指标,对发酵条件进行一系列优化,从而筛选出高产胞外多糖的发酵条件,基于上述条件液态发酵红曲霉后,对分离出的红曲多糖粗提物进行抗氧化性和抑菌能力的检测,以期为红曲霉胞外多糖的标准化生产提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1 菌种
红曲霉,由江南大学提供。
1.1.2 发酵原料
市售东北优质大米、大豆粉。
1.1.3 培养基
种子培养基:向250 mL三角瓶中加入100 mL麦芽汁制成麦芽汁液态培养基,115 ℃灭菌20 min,冷却至室温后加入1 mL孢子悬浮液(孢子浓度为2.25×106个/mL),并置于摇床中以32 ℃ 160 r/min的条件培养72 h,取出待接菌备用。
大米培养基:将新鲜大米粉碎成细粉后,按照表1配比加入250 mL三角瓶中,在121 ℃下灭菌30 min,冷却至室温后备用。
表1 大米培养基
组分添加量 大米粉/g4 大豆粉/g1 KCl/g0.015 KH2PO4/g0.015 NaCl/g0.015 蒸馏水/mL100
LB培养基:将琼脂、蛋白胨等原料,按照表2配比加入250 mL三角瓶中,调节pH至7.5,121 ℃灭菌20 min,冷却至室温后备用。
表2 LB培养基
组分添加量 琼脂/g2 蛋白胨/g1 酵母浸出汁/g0.5 NaCl/g1 蒸馏水/mL100
1.1.4 试剂
蛋白胨、酵母浸出液、琼脂粉、葡萄糖、苯酚、抗坏血酸(维生素C)、硫酸、氯化钠、二苯代苦味酰基自由基(DPPH•)、双氧水、磷酸二氢钾、硫酸亚铁、水杨酸、乳酸、异戊醇、氯仿、氯化钾、乙醇、甘露醇,以上试剂均为分析纯,由天津农学院生物化学实验室提供。
1.2 试验方法
1.2.1 培养条件的优化
试验证明,以4 g大米粉、1 g大豆粉、0.015 g KCl、0.015 g KH2PO4、0.015 g NaCl和100 mL蒸馏水配置的大米培养基为高产红曲霉胞外多糖的液态培养基,对红曲霉进行液态发酵120 h,发酵液中胞外多糖的平均质量浓度为112.3 mg/mL[5]。因此,在大米培养基的基础上,以1 mL接种量、32 ℃和160 r/min的初始条件,将红曲霉液态发酵120 h,用苯酚-硫酸法测定出发酵液中多糖的质量浓度作为筛选指标,进一步优化培养条件。
1.2.1.1 发酵液中多糖含量的检测
用天平称取一定量的葡萄糖放入容量瓶中定容,分别量取定容后的溶液1.0,2.0,3.0,4.0,5.0 mL至新的容量瓶中再次定容,记录各个葡萄糖稀释液质量浓度。各取2.0 mL定容后的稀释液,再取2 mL蒸馏水,分别标号为1~6,6为空白对照。将6份溶液分别加入5%苯酚1.0 mL,浓硫酸5.0 mL,摇匀后静置20 min,在490 nm波长下用紫外分光光度计测量其吸光度。以葡萄糖溶液的质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
取待测红曲霉发酵液15 mL,4 000 r/min离心20 min,取1 mL上清液定容至100 mL混匀制成稀释液。取1 mL稀释液于试管中,加入1 mL蒸馏水,采用苯酚-硫酸法测定发酵液490 nm下的吸光值,用标准曲线计算发酵液中的多糖含量。
1.2.1.2 发酵液pH的优化
在大米培养基的基础上进行液态发酵至48 h时暂停发酵,以乳酸来调节发酵液的pH分别为3.0、4.0和5.0,每个pH值各作3组平行试验,后继续发酵至120 h。检测不同pH值发酵液中红曲霉胞外多糖的质量浓度,取其平均值。
1.2.1.3 培养温度的优化
在大米培养基的基础上,设培养温度分别为24、28、32和36 ℃,每个温度作3组平行试验,在160 r/min下液态发酵120 h,测定发酵液中多糖的质量浓度,取其平均值。
1.2.1.4 摇床转速的优化
在大米培养基的基础上,将摇床转速分别设置为120、140、160和180 r/min,每个转速作3组平行试验,在最佳温度下液态发酵120 h,测定发酵液中多糖的质量浓度,取其平均值。
1.2.1.5 验证试验
以通过1.2.1.2~1.2.1.4试验筛选所得液态发酵条件,重复3次验证试验。
1.2.2 红曲霉胞外多糖的分离提取
将发酵液在4 000 r/min条件下离心10 min,取上清液,按1 mL/L的比例添加正丁醇,60 ℃下浓缩至原体积的1/5。在得到的浓缩液中加入4倍体积的95 %乙醇,静置并离心10 min,弃上清液得粗多糖沉淀,于60 ℃干燥箱中烘干直至恒重。用20倍体积的去离子水溶解该沉淀,以4 000 r/min离心10 min取上清液进行脱蛋白处理。待加入1/5体积的氯仿-异戊醇试剂后(氯仿∶异戊醇=24∶1),在通风、避光条件下搅拌30 min、静置30 min再取上清液,弃变性蛋白及有机溶剂。重复上述操作,直至有机溶剂与多糖溶液层之间无变性蛋白为止。冷冻干燥多糖溶液,即得红曲多糖粗提物。
1.2.3 红曲多糖的抗氧化性
1.2.3.1 红曲多糖清除DPPH自由基的能力
取红曲多糖粗提物,配制0.02、0.04、0.06、0.08、0.10 mg/mL的粗多糖溶液于试管中,每个质量浓度做3组平行。将1.0 mL多糖稀释液与1.0 mL DPPH以及4.0 mL蒸馏水加入同一试管中,摇匀,避光静置30 min,并在517 nm处测量其吸光值。以相同质量浓度的维生素C做阳性对照,按公式(1)计算其清除率[6-8]:
DPPH清除率=[1-(X-X0)]/0×100% (1)
其中,X:1.0 mL不同质量浓度的样品+1.0 mL DPPH+4.0 mL蒸馏水
0:1.0 mL DPPH+5.0 mL蒸馏水
X0:6.0 mL无水乙醇
1.2.3.2 红曲多糖清除羟自由基的能力
取红曲多糖粗提物,配制与上述相同质量浓度的粗多糖溶液于试管中,每个质量浓度作3组平行试验。将2.0 mL多糖稀释液与2 mL FeSO4、 2 mL水杨酸-乙醇溶液以及2 mL H2O2溶液于同一试管中,混合摇匀,37 ℃反应30 min,并在510 nm处测量其吸光值。以相同质量浓度的甘露醇做阳性对照,按公式(2)计算其清除率[9-12]:
OH清除率=[1-(X-X0)]/0×100% (2)
其中,0:2 mL蒸馏水+2 mL FeSO4+2 mL水杨酸-乙醇溶液+2 mL H2O2
X:2 mL不同质量浓度的样品+2 mL FeSO4+2 mL水杨酸-乙醇溶液+2 mL H2O2
X0:2 mL 不同质量浓度的样品+2 mL FeSO4+2 mL水杨酸-乙醇溶液+2 mL水
1.2.4 红曲多糖的抑菌性
制备双层平板,使后续所有的抑菌圈几乎都位于同一平面上,更易于观察[13]。首先将下层LB培养基融化,每皿约10 mL,倒平板,凝固后待用,再将上层LB培养基融化,待融化的上层培养基冷却至45~50 ℃时,将菌液倒入上层培养基中混匀,迅速倒平板,每皿约10 mL,冷却凝固[14-15]。用灭菌镊子夹住均匀浸泡多糖稀释液滤纸片,置于上层培养基上,每皿放3组平行试验,并用浸泡无菌水的滤纸片作空白对照。在37 ℃培养箱中培养3~5 d,观察滤纸片周围有无抑菌环出现。
2 结果与分析
2.1 发酵条件的优化
2.1.1 葡萄糖标准曲线
采用苯酚-硫酸法检测发酵液中红曲多糖的质量浓度需用到葡萄糖标准曲线,在490 nm下,以稀释液的吸光度对质量浓度进行线性回归,得到回归方程=9.818 2,且2>0.994 5,如图1所示。说明此标准曲线具有良好的线性关系,该测定方法具有可信度。

图1 葡萄糖标准曲线
2.1.2 发酵液pH优化
多糖的合成是在多种酶共同催化下完成的,pH值可影响酶的催化过程,改变体系酶的反应环境和营养物质的代谢流,从而对菌丝体生长和多糖积累产生较大影响。
由图2可知,pH值过低不利于多糖的积累。在保持自然pH值条件下,随着发酵的进行,培养基中红曲多糖产量最高,达到110.8 mg/mL。
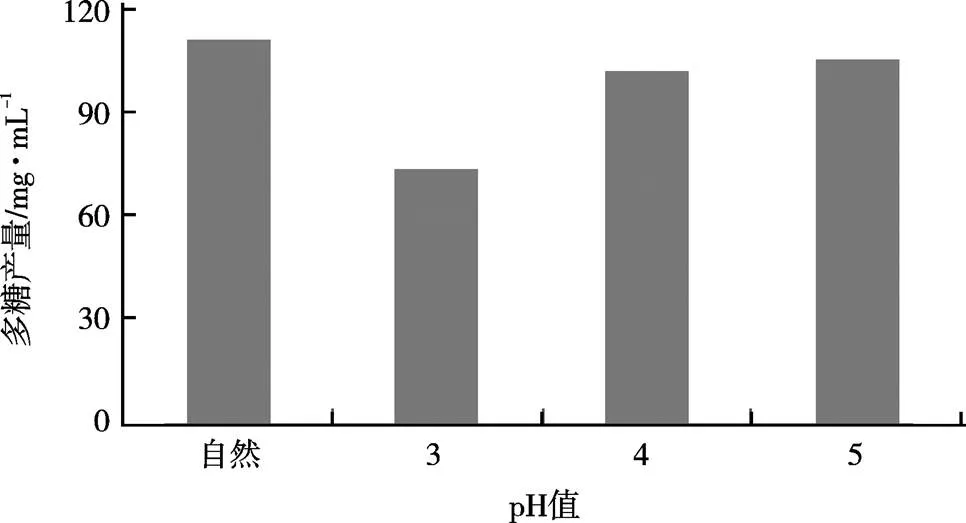
图2 pH值对多糖产量的影响
2.1.3 培养温度的优化
多糖的合成离不开多酶体系的共同催化,温度可影响酶的活性。温度过高,酶易变性失活,温度过低则酶活降低,直接影响营养物质的代谢流,从而对菌丝体的生长和多糖积累产生较大影响。由图3可知,在保持初始pH值条件下,随着发酵的进行,当温度为32 ℃时,红曲多糖产量最高,为112.1 mg/mL。
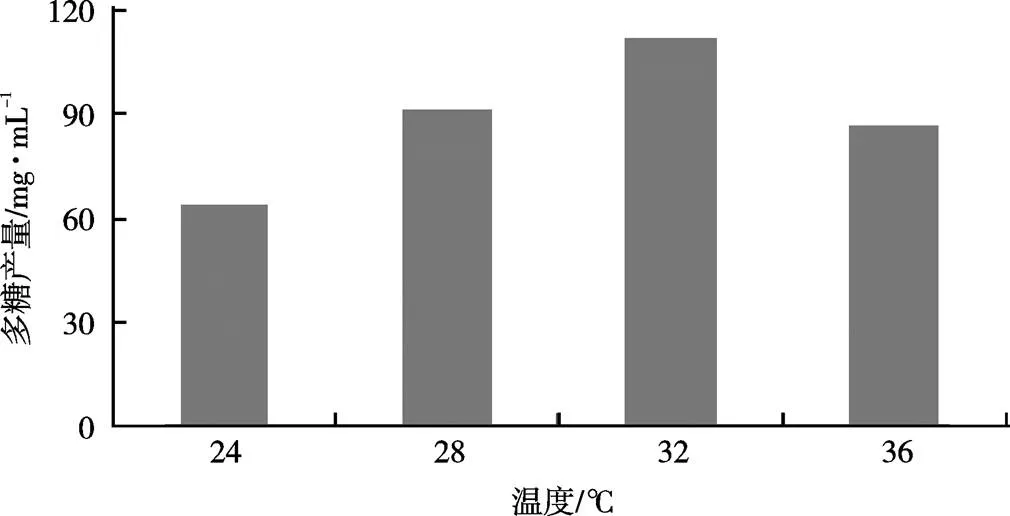
图3 温度对多糖产量的影响
2.1.4 摇床转速的优化
转速不仅影响红曲霉菌丝体生长与孢子生成,而且影响其次生代谢物的产量,通过最优转速提供的通气量能最大限度地满足红曲霉的生长需求。转速太低,培养液的溶氧率不能满足菌丝与孢子生长;转速太高,虽然培养液的通气得到改善,但过高的震荡速率会加快菌丝体的自溶,对菌丝产生一定的剪切作用,不利于胞外多糖的生成。此外,转速过高也会增加试验成本,不利于工业化生产。
在不同转速下液态发酵120 h,测定发酵液中多糖产量,结果如图4。由图4可知,随着发酵的进行,在一定范围内增加转速,可使红曲多糖的产量也相应提高,当转速为180 r/min时,多糖产量最高,为143.6 mg/mL。
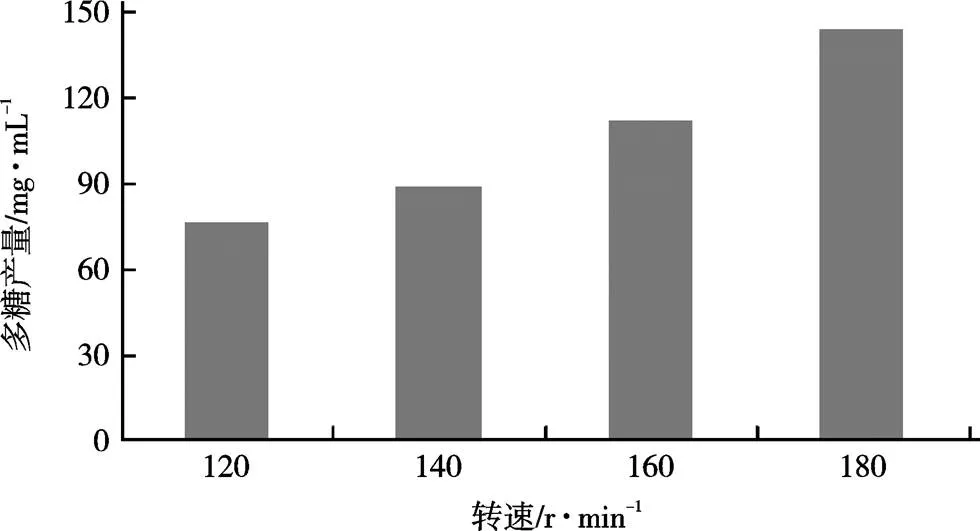
图4 转速对多糖产量的影响
2.1.5 验证试验
在大米培养基的基础上,同时保持发酵液自然pH、温度32 ℃和转速180 r/min的条件下,对红曲霉液态发酵120 h,测定发酵液中胞外多糖的质量浓度,并重复3次试验,试验结果如表3所示。
表3 验证试验结果
试验组多糖产量/mg·mL-1 1149.8 2137.2 3139.9 平均值142.3
通过3次验证试验可知,发酵条件优化后对红曲霉液态发酵120 h,发酵液中胞外多糖平均产量为142.3 mg/mL,是未优化前液态发酵多糖产量的1.3倍。因此,优化后的培养条件更利于发酵过程中胞外多糖的生成和积累,可用于后续试验。
2.2 红曲多糖的抗氧化性试验
2.2.1 清除DPPH自由基
在大米培养基以及优化条件下培养120 h,经分离得到红曲多糖的粗提物,用蒸馏水配制成不同质量浓度的多糖稀释液。由于紫外分光光度计较灵敏,若质量浓度过大导致吸光值过大,试验误差较大,因此,配制稀释液的质量浓度应不大于0.10 mg/mL,并以维生素C作对照进行抗氧化性试验,结果如图5。
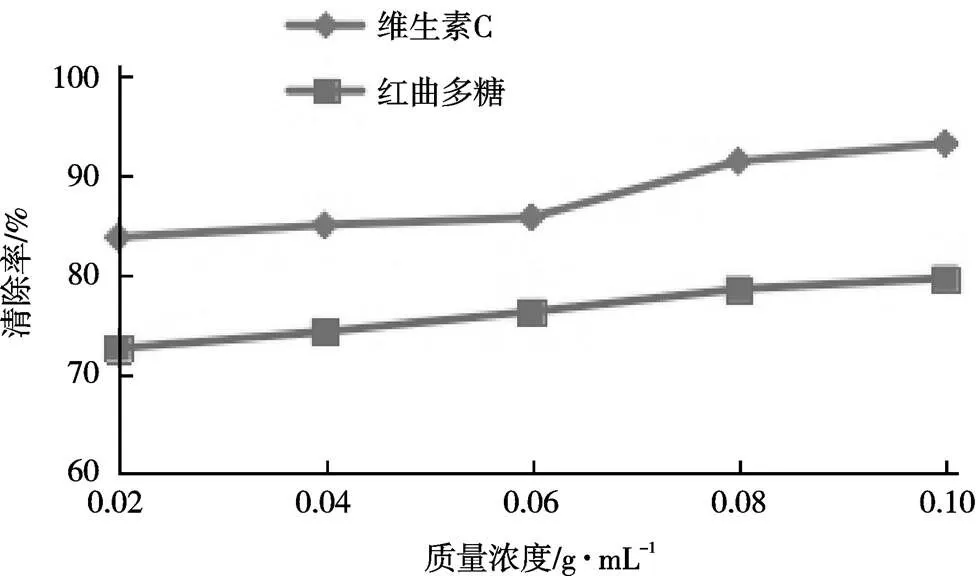
图5 红曲霉胞外多糖对DPPH自由基的清除率
由图5可见,红曲霉经液态发酵所产的胞外多糖对DPPH自由基具有较好的清除作用,但其清除率小于相同质量浓度的维生素C。在试验所取的质量浓度范围内,红曲多糖对DPPH自由基的清除能力随质量浓度的升高而增强,在质量浓度为0.10 mg/mL时达到最大值,清除率为79.5 %。
2.2.2 清除羟自由基
将分离得到的红曲多糖粗提物用蒸馏水配制成不同质量浓度的多糖稀释液,稀释液质量浓度不大于0.10 mg/mL,并与甘露醇作对照进行抗氧化性试验,结果如图6。

图6 红曲霉胞外多糖对羟自由基的清除率
由图6可知,红曲霉液态发酵产生的胞外多糖对羟自由基具有较好的清除作用,清除率高于相同质量浓度的甘露醇。在试验所取的质量浓度范围内,红曲多糖对羟自由基的清除能力随质量浓度的升高而增强,在质量浓度为0.10 mg/mL时清除率达到最大,为44.16 %。
2.3 红曲多糖的抑菌试验
将分离得到的红曲多糖粗提物,用蒸馏水稀释成一定质量浓度的多糖稀释液,与蒸馏水相对照进行抑菌试验。由图7~图9可见,大肠杆菌上层培养基的滤纸片周围存在抑菌圈,说明红曲霉胞外多糖对大肠杆菌有一定的抑制作用;枯草芽孢杆菌上层培养基的滤纸片周围没有明显抑菌圈,说明红曲多糖对枯草芽孢杆菌无抑制作用;产气杆菌上层培养基的滤纸片周围存在抑菌圈,说明红曲霉胞外多糖对产气杆菌有一定的抑制作用。

图7 红曲多糖对大肠杆菌的抑菌试验
注:每皿左上角为空白对照。下同

图8 红曲多糖对枯草芽孢杆菌的抑菌试验
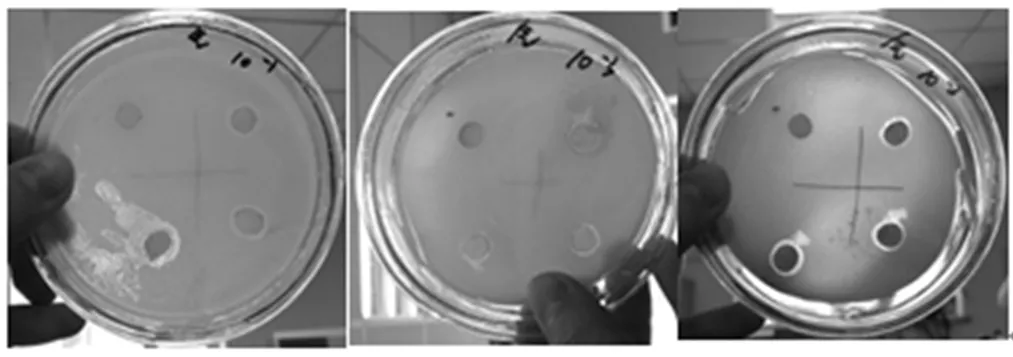
图9 红曲多糖对产气杆菌的抑菌试验
3 结论
在对红曲霉进行液态发酵产胞外多糖的初步研究中,确定以原始pH的发酵液、培养温度为32 ℃,转速为180 r/min作为发酵条件,比较适合红曲胞外多糖的代谢和积累。基于该条件下,对红曲霉液态发酵120 h,发酵液中胞外多糖的产量可达142.3 mg/mL,较未优化时多糖产量提高了约27 %,可见优化后的条件更有利于红曲霉胞外多糖的生成和积累。对上述发酵液中多糖进行分离提取,进行抗氧化性试验可知,红曲多糖对DPPH自由基和羟自由基均有清除能力,其中对羟自由基的清除能力更显著,表现出良好的抗氧化性,且红曲多糖能够抑制大肠杆菌和产气杆菌的生长,但对枯草芽孢杆菌的生长没有任何抑制 作用。
[1] 章克第. 红曲霉及红曲色素[J]. 中国调味品,1989(2):1-4.
[2]李时珍. 本草纲目[M]. 北京:人民卫生出版社,1975.
[3] 田军,李兆兰,沈晓云,等. 红曲多糖的化学结构分 析[J]. 南京中医药大学学报,1998,14(4):217-218.
[4] 巩健,樊庆鲁. 红曲菌主要代谢产物检测方法研究进 展[J]. 中国调味品,2017,42(3):166-171.
[5] 张子祎,李月婵,杨薇. 产胞外多糖红曲霉液态发酵培养基的筛选[J]. 天津农学院学报,2019,26(1):59-63.
[6] 熊双丽,卢飞,史敏娟,等. DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J]. 食品工业科技,2012,33(8):380-383.
[7] 路新彦,吴学谦,贺亮,等. DPPH检测碱提香菇菌丝体多糖的抗氧化性能研究[J]. 安徽农业科学,2010,38(18):9519-9520.
[8] 杨玲,汪河滨,罗峰,等. 甘草多糖清除自由基活性的研究[J]. 塔里木大学学报,2007,19(1):1-3.
[9] 桂琳,葛飞,黄寅. 比色法测定细脚拟青霉胞内甘露醇及羟自由基清除率[J]. 安徽农业科学,2009,37(19):8818-8819,8824.
[10] 许冰. 一株芽孢杆菌胞外多糖的抗氧化性研究[J]. 中国酿造,2010,221(8):75-76.
[11] 楚杰,王莹,郝永任,等. 绣球菌菌丝体多糖的抗氧化活性[J]. 食用菌学报,2017,24(4):50-54.
[12] Wang P,Chen D, Jiang D,et al. Alkali extraction and in vitroantioxidant activity ofmycelium polysaccharides[J].J Food Sci Technol,2014,51(7):1251-1259.
[13] Chen H,Chen Y,Yeh J,et al. Immune-stimulated antitumor effect of different molecular weight polysaccharides fromon human leukemic U937 cells[J]. CyTA-Journal of Food,2014,12(2):134-140.
[14] 杜连祥,路福平. 微生物学实验技术[M]. 北京:中国轻工业出版社,2011.
[15] 徐维昌,陈波,杨永春,等. 平板涂布法在酱油菌落总数检验中的应用研究[J]. 中国食品安全,2017,84(12):115.
Optimization of conditions for the production of exopolysaccharides byand preliminary detection of efficacy activity
LI Yue-chan, ZHANG Zi-yi, WEI Xue-yuan, CHANG Li, YANG WeiCorresponding Author
(College of Basic Sciences, Tianjin Agricultural University, Tianjin 300384, China)
In this paper, the medium composition and process conditions of polysaccharides produced by liquid fermentation ofwere optimized, and the extraction, purification, antioxidation and antibacterial activities of liquid fermentation polysaccharides fromwere studied. Under the liquid fermentation of a medium consisting of 40 mg/mL rice flour, 10 mg/mL soybean powder, 0.15 mg/mL KCl, 0.15 mg/mL KH2PO4, 0.15 mg/mL NaCl, optimized by single factor experiment,the fermentation process conditions are as follows: the fermentation medium maintains an initial pH value of 32℃and a rotational speed of 180 r/min. Under this condition, the mass concentration of polysaccharides in the liquid fermentation ofshake flask reached 142.3 mg/mL, which was about 1.3 times that before optimization. The preliminary detection of the antioxidant activity of the extractedpolysaccharides showed that theexopolysaccharide scavenged DPPH free radicals better, and the ability to scavenge hydroxyl radicals was weak. Moreover,polysaccharide had a certain antibacterial effect onand, but had no antibacterial activity against.
extracellular polysaccharide; condition optimization; polysaccharide extraction; antioxidant; bacteriostatic
1008-5394(2020)02-0079-05
10.19640/j.cnki.jtau.2020.02.017
Q93
A
2019-08-26
天津农学院大学生创新创业训练计划项目(201710061216)
李月婵(1997-),女,硕士在读,研究方向为发酵工程。E-mail:1390675929@qq.com。
杨薇(1981-),女,高级工程师,博士,研究方向为微生物与生物制药。E-mail:yangwei811127@126.com。
责任编辑:宗淑萍

