基于miR-146a调控NF-κB信号通路探讨芍药甘草汤治疗颈型颈椎病兔颈后肌炎症损伤的作用机制
陈进城 林 荣 张圆芳 董继泉 柳维林 江 征 陈少清 王芗斌 何 坚
1福建中医药大学附属康复医院,福建 福州350003;2福建省康复技术重点实验室,福建 福州 350003;3福建中医药大学康复医学院,福建 福州 350122;4湖州市南浔区人民医院,浙江 湖州313000* 通信作者:何坚,E-mail:591003659@qq.com
颈型颈椎病是颈椎病的早期分型,伴随着其他类型颈椎病的发展过程[1],颈部疼痛是其最常见的症状[2]。成年人口中患病率为48.5%,长期使用电脑工作者的患病率为 55%[3-4]。IL-1β、IL-6、TNF-α 等作为促炎细胞因子在颈椎退变发展过程中起重要作用,NF-κB(nuclear factor-κB)信号通路已被证明可以调节IL-1β、IL-6、TNF-α等促炎细胞因子和趋化因子的转录,从而导致和加速颈椎的退变[5-6]。miR-146a通过其重要的靶基因TRAF-6发挥抗炎功能,通过抑制靶基因TRAF-6的水平和减少TLR4下游NF-κB的表达从而减少炎症因子的水平[7]。芍药甘草汤出自《伤寒论》。现代研究证明其具有抗炎、解痉之功效,被广泛应用于临床各种疾病[8-9]。本课题组前期研究已证实芍药甘草汤对颈型颈椎病的疼痛和痉挛均具有显著的疗效[10]。为探究芍药甘草汤对颈型颈椎病炎症损伤的作用,本研究通过建立颈椎病兔模型,观察芍药甘草汤对兔颈后肌炎症损伤的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 动物
选取6月龄SPF级新西兰白兔(3.0~3.5 kg)38只,雌雄各半,由福建中医药大学实验动物中心代购,实验动物生产许可证号:SCXK(沪)2012-0011。
1.2 试剂及仪器
苏木素伊红染液(碧云天,美国);IL-1β、IL-6、TNF-α(ELISA)试剂盒(上海西唐生物);RT-qPCR试剂盒(艾德莱,北京);兔子固定装置(苏州苏杭科技器材有限公司);酶标仪(Tecan,瑞士);包埋机(Leica,德国);电子显微镜(Leica,德国);PCR 分析仪(Bio-Rad,美国);Anti-NFκB Antibody,p65 subunit,active subunit,clone 12H11(Merck Millipore,美国);Anti-MyD88 Antibody(aa263-273)(Isbio,美国)。
1.3 模型的建立与评估
1.3.1 兔颈型颈椎病模型的建立 参照张圆芳等[11]寒湿型兔颈型颈椎病模型进行造模。将兔子剃除颈部毛发后置于兔子固定装置中,将其颈部前屈45°固定,于颈后放上平整的冰袋,冰袋两端固定在装置上,每次5 h,每天1次,连续干预8周后将动物置于室温25~28℃中饲养,自由饮食、饮水。
1.3.2 兔颈型颈椎病模型的评估 造模后第2天,兔耳源静脉采血,观察兔血清中炎症因子IL-1β、IL-6、TNF-α的表达水平;观察兔颈肌的僵硬程度。
1.4 实验分组与给药
1.4.1 分组 将38只6月龄的新西兰白兔按照随机数字表法分为正常组6只和造模组32只,造模后剔除不合格的和造模中死亡的兔子,再随机分为模型组、高剂量组、中剂量组、低剂量组,每组6只。
1.4.2 给药 芍药甘草汤方由白芍12 g、炙甘草12 g组成;所用药材购自福建中医药大学承创堂河洛中医馆。按此量(24 g)为60 kg成人每日临床用药有效量计算,按人与兔体质量系数折算公式进行换算:
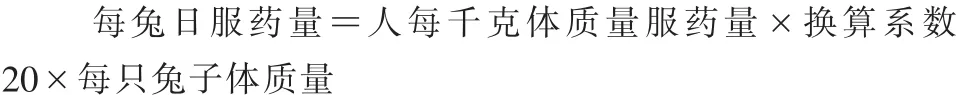
给兔子服用高、中、低剂量的芍药甘草汤分别是成人用药等效剂量的2、1、0.5倍,故根据公式算得高剂量组、中剂量组、低剂量组兔子每千克体质量用药量分别为16、8、4 g/kg。每周对兔子测量体质量1次,根据兔子的具体体质量和每兔日服药量公式计算出每只兔子每天所需药材量,进而计算出每组兔子的日需药材量。将药材用自动煎药机常规煎法,再用小火浓缩,每剂中药均浓缩煎至160 mL,每次80 mL,每日2次;正常组和模型组予以等量的生理盐水,连续给药4周。
1.5 取材及样本处理
1.5.1 血清标本的采集 分别于造模前1天上午、造模结束后第2天上午和芍药甘草汤干预结束后第2天上午,对5组兔子均进行耳缘静脉采血,并收集于标记好的采血管中,及时于4℃,转速3000 r/min,进行离心,离心30 min后吸取血清上清液,-80℃冰箱保存。
1.5.2 颈后肌组织标本的采集 采用空气栓塞法处死动物,后迅速取出颈后肌组织,一般取C3-6棘突旁约2 cm处的肌肉部分约1 cm3。将取下的组织分2个部分,一部分投入装有4%多聚甲醛的EP管中固定,用作HE染色;另一部分置于EP管中,封盖,-80℃冰箱保存,用作RT-qPCR检测。
1.6 ELISA法检测血清中炎症因子IL-1β、IL-6、TNF-α的表达水平
5组血清按ELISA的说明书进行操作;酶标仪吸收450 nm波长检测A值。各孔检测的A值减去空白组的A值为各孔实际A值,来反映血清中IL-1β、IL-6、TNF-α 的含量。
1.7 HE染色观察兔颈颈后肌组织形态的变化
将取下的颈后肌组织放入4%多聚甲醛中固定48 h,后放入10%EDTA脱钙,室温脱钙60 d。脱钙完成后,进行石蜡包埋,制作石蜡切片,切片厚度为5 μm,常规脱蜡后,苏木素染色5 min,自来水冲洗30 s,1%盐酸分色3 s后,再用自来水冲洗30 s,PBS返蓝30 min,再用苏木素复染1 s。对每张切片依次进行常规逆梯度酒精脱水,最后用中性树胶封片,常温晾干,显微镜下观察兔颈后肌组织形态的变化。
1.8 Western blot法检测兔颈后肌组织蛋白的表达
收集颈后肌组织,将其在液氮中迅速研磨成细致粉末,研磨后加入蛋白裂解液按1 mg∶3 μL进行裂解,每20 min震荡1次,2 h后取混合液至于1.5 mL离心管中4℃ 14 000 r/min离心 30 min,收集上清液,吸取上清液200 μL置于0.6 mL离心管中,加入50 μL蛋白上样缓冲液;在95℃下变性5 min,根据BCA蛋白定量结果上样,通过SDS-聚丙烯酰胺凝胶电泳凝胶分离并转移至PVDF膜,转膜后用高效封闭液室温封闭30 min。分别加入针对β-actin(1∶10 000)、NF-κB P65(1∶800)、MyD88(1∶1 500)的一抗4℃孵育过夜。TBST洗涤缓冲液洗3次,每次10 min,加入二抗,在室温下保持2 h,TBST洗涤缓冲液洗 3次,每次 10 min;使用 ImageQuant LAS 4000微型化学发光成像分析系统,并使用ImageJ软件分析条带密度,计算蛋白相对表达量。
1.9 RT-qPCR法检测兔颈后肌组织中miR-146a、TLR4及TRAF-6的mRNA表达
从-80℃冰箱中取出兔颈后肌标本组织,液氮研磨成细粉后,各取75 mg粉末于1.5 mL EP管中,加入 1 mL Lysis/Binding buffer、200 μL 氯仿、无水乙醇等混匀搅拌,将混合液每次以700 μL加入至一个吸附柱RA中,多次离心后,取出吸附柱RA,提取总RNA。总RNA经处理后,根据逆转录试剂盒说明书将纯化的RNA逆转录成cDNA,以cDNA为模板进行qPCR扩增。最后在荧光定量仪器中根据荧光定量试剂盒进行操作,设置的反应条件为:95℃30 s,95 ℃ 10 s,60 ℃ 34 s。
1.10 统计学方法
采用SPSS 20.0软件进行统计处理。计量资料服从正态分布均采用(±s)表示,选用单因素方差分析检验组间差异的显著性。P<0.05为差异有统计学意义。
2 结 果
2.1 模型评估
在整个造模操作过程中,兔颈后肌肉组织慢慢从柔软变得痉挛、僵硬;造模结束后,兔颈后肌肉组织出现更明显的条索状肌痉挛症状,证明本次兔颈型颈椎病模型的成功建立。
造模结束后,除正常组在造模前后没有明显变化外,其他5组动物的相应血清炎症因子表达水平均比造模前显著升高,且造模4组与正常组相比,差异均有统计学意义(P<0.01),而造模4组之间比较差异均无统计学意义(P>0.05),这也证明了本次兔颈型颈椎病模型的成功建立。见表1。
表1 干预前(造模后)5组血清炎症因子IL-1β、IL-6、TNF-α 表达水平比较(±s)Table 1 Comparison of expression levels of serum inflammatory factors IL-1β,IL-6 and TNF-α in five groups before intervention (after modeling) (±s)pg/mL

表1 干预前(造模后)5组血清炎症因子IL-1β、IL-6、TNF-α 表达水平比较(±s)Table 1 Comparison of expression levels of serum inflammatory factors IL-1β,IL-6 and TNF-α in five groups before intervention (after modeling) (±s)pg/mL
注:与正常组比较,1) P<0.01。Note:Compared with the normal group,1)P<0.01.
组别正常组模型组低剂量组中剂量组高剂量组n 6 6 6 6 6 I L-1 β 3.8 4±0.1 0 1 3.4 6±0.1 8 1)1 3.6 7±0.2 3 1)1 3.7 7±0.2 0 1)1 3.6 0±0.2 1 1)I L-6 2.6 9±0.1 3 9.0 2±0.1 4 1)8.8 8±0.1 7 1)8.8 0±0.2 7 1)8.8 3±0.2 5 1)T N F-α 4.5 5±0.0 8 9.4 1±0.4 0 1)9.3 4±0.3 4 1)9.3 0±0.3 9 1)9.3 6±0.3 1 1)
2.2 ELISA法检测5组血清中炎症因子IL-1β、IL-6、TNF-α 的水平
见表2。
表2 干预后5组血清炎症因子IL-1β、IL-6、TNF-α表达水平比较(±s)Table 2 Comparison of serum inflammatory factors IL-1β,IL-6 and TNF-α expression in five groups after intervention (±s)pg/mL

表2 干预后5组血清炎症因子IL-1β、IL-6、TNF-α表达水平比较(±s)Table 2 Comparison of serum inflammatory factors IL-1β,IL-6 and TNF-α expression in five groups after intervention (±s)pg/mL
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.01;与低剂量组比较,3) P<0.01;与中剂量组比较,4) P<0.01。Note:Compared with the normal group,1)P<0.01;Compared with the model group,2)P<0.01;Compared with the low dose group,3)P<0.01;Compared with the middle dose group,4)P<0.01.
组别正常组模型组低剂量组中剂量组高剂量组n 6 6 6 6 6 I L-1 β 3.8 4±0.0 9 1 4.7 5±0.5 9 1)1 1.3 8±0.4 5 2)7.2 1±0.4 5 2)3)4.8 4±0.3 8 2)3)4)I L-6 2.6 9±0.1 3 9.2 7±0.3 0 1)6.6 0±0.3 3 2)5.3 7±0.2 9 2)3)3.3 0±0.2 6 2)3)4)T N F-α 4.5 5±0.0 8 9.6 9±0.2 3 1)8.1 7±0.3 1 2)6.5 9±0.3 0 2)3)5.2 2±0.1 6 2)3)4)
2.3 HE染色观察5组颈后肌形态的变化
正常组肌细胞核椭圆形,颈肌纤维排列有序;模型组肌细胞变形,肌纤维断裂,断裂处出现大量炎症细胞;低剂量组细胞核数量较模型组增多;中剂量组细胞核增加更明显,肌纤维断裂减少;高剂量组细胞核较多,炎症细胞比中剂量组的更少。见图1。

图1 5组颈后肌形态变化(×400)Figure 1 Morphological changes of the posterior cervical muscle in five groups (×400)
2.4 Western blot法检测兔颈后肌组织蛋白的表达
见表3和图2。
表3 干预后 5组颈后肌组织中 MyD88、NF-κB P65 蛋白表达(±s)Table 3 Protein expression of MyD88 and NF-κB P65 in posterior cervical muscles in five groups after intervention (±s)

表3 干预后 5组颈后肌组织中 MyD88、NF-κB P65 蛋白表达(±s)Table 3 Protein expression of MyD88 and NF-κB P65 in posterior cervical muscles in five groups after intervention (±s)
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.01。Note:Compared with the normal group,1)P<0.01;Compared with the model group,2)P<0.05;Compared with the low dose group,3)P<0.05;Compared with the middle dose group,4)P<0.01.
N F-κ B P 6 5 0.6 3±0.0 4 2.8 4±0.2 1 1)2.0 3±0.0 1 2)1.3 6±0.2 0 2)3)0.6 4±0.0 5 2)3)4)组别正常组模型组低剂量组中剂量组高剂量组n 6 6 6 6 6 M y D 8 8 0.3 5±0.0 6 3.2 5±0.3 3 1)2.4 0±0.3 0 2)1.4 4±0.1 1 2)3)0.3 8±0.0 6 2)3)4)
2.5 RT-qPCR法检测兔颈后肌中miR-146a、TLR4及TRAF-6的mRNA表达
见表4。
3 讨 论
颈型颈椎病属于颈椎病的早期分型,主要有酸胀、疼痛等不适,少数可伴有上肢的感觉异常[12-13]。研究发现,当颈前屈时,颈椎所承受的压力增大,容易使其损伤、退变[14]。 本研究参照张圆芳等[11]的方法建立兔颈型颈椎病模型,操作简便,成功率高,与临床实际基本相符。研究发现长期低头姿势能够引起兔颈椎炎症损伤的产生,而炎症反应是引起颈椎退变的重要原因之一[15]。IL-1β被认为是最重要的细胞因子,具有强烈的促炎活性,通过刺激产生多种促炎症介质,如细胞因子、趋化因子和基质金属蛋白酶[16-17]。此外,IL-1β 通过诱导细胞衰老凋亡促进氧化应激并加速细胞外基质的降解,从而加速颈椎退变[18]。TNF-α的水平与颈椎病患者的颈椎疼痛密切相关,TNF-α通过增加神经生长因子和血管内皮生长因子的产生,促进神经血管的生长,它还促进基质降解和增强物质p,这表明TNF-α可能与神经痛苦反应或促进结构中断相关[19]。KISHIMOTO等[20]提出,IL-6是一种参与细胞增殖和分化、维持免疫稳态、巨噬细胞功能等关键功能的多功能细胞因子。经证实,IL-6作为促炎细胞因子,可导致继发性损伤[21-22]。本研究对血清样本进行了评估,发现与模型组相比,芍药甘草汤干预组中血清炎症因子比模型组明显降低,这说明芍药甘草汤能明显降低兔血清中炎症因子的表达,从而抑制炎症反应。
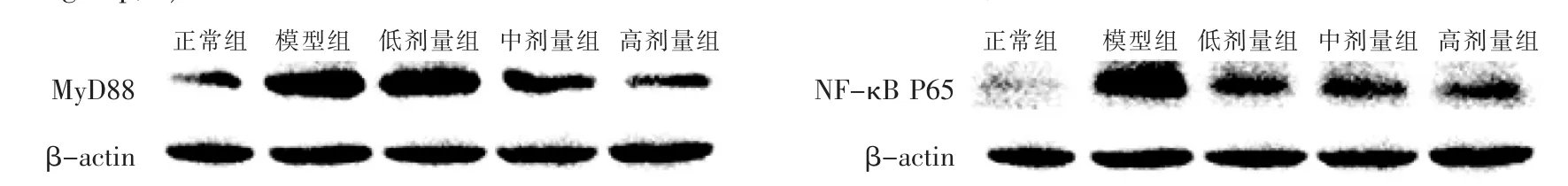
图2 干预后5组颈后肌组织中MyD88、NF-κB P65蛋白表达Figure 2 Protein expression of MyD88 and NF-κB P65 in posterior cervical muscles in five groups after intervention
NF-κB存在于不同类型的细胞中,是一个重要的转录调节因子,影响着细胞的生长、分化、凋亡等[23]。病毒、细菌、促炎性细胞因子等都会刺激NF-κB信号通路,引起NF-κB信号通路的激活,进而导致一系列相关疾病的发生。NF-κB信号通路对调控颈椎退变中的炎症反应起到重要作用,在退变的颈后肌组织中,NF-κB信号通路被高表达的IL-6、IL-1β、TNF-α所调控,引起颈后肌细胞凋亡、蛋白聚糖降解,加剧了颈后肌的退行性病变[24],当抑制NF-κB活性后,能有效降低炎症因子IL-6、IL-1β和TNF-α 的表达水平[25]。
表4 干预后5组颈后肌组织中miR-146a、TLR4、TRAF-6表达(±s)Table 4 Expression of miR-146a,TLR4 and TRAF-6 in posterior cervical muscle after intervention (±s)

表4 干预后5组颈后肌组织中miR-146a、TLR4、TRAF-6表达(±s)Table 4 Expression of miR-146a,TLR4 and TRAF-6 in posterior cervical muscle after intervention (±s)
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.01。Note:Compared with the normal group,1)P<0.01;Compared with the model group,2)P<0.05;Compared with the low dose group,3)P<0.05;Compared with the middle dose group,4)P<0.01.
T R A F-6 0.9 9±0.0 3 2 5.1 6±0.9 2 1)1 1.9 2±0.3 3 2)5.1 8±0.3 3 2)3)2.6 5±0.2 0 2)3)4)组别正常组模型组低剂量组中剂量组高剂量组n 6 6 6 6 6 m i R-1 4 6 a 1.0 0±0.0 3 0.0 4±0.0 1 1)0.2 0±0.0 2 2)0.4 7±0.0 2 2)3)0.9 9±0.0 5 2)3)4)T L R 4 1.0 0±0.0 7 1 4.3 0±0.5 0 1)9.2 1±0.3 5 2)5.8 3±0.2 8 2)3)2.0 8±0.2 6 2)3)4)
miRNA是一类小的非编码RNA分子,可以作为许多途径和生物过程(包括炎症反应)的调节剂发挥关键作用。miR-146a作为协调免疫和炎症信号传导的最重要的miRNA之一,通常通过其公认的靶基因IL-1受体相关激酶1(IRAK1)和肿瘤坏死因子(TNF)受体相关因子 6(TRAF6)发挥作用[7,26-27],活化的IRAK1和TRAF6可引起NF-κB核位移,促进炎症介质的释放。研究发现,上调miR-146a细胞后可负性调节炎症介质的释放[7]。TLR4是一种膜结合蛋白,激活的TLR4可募集下游细胞内MyD88和TRIF蛋白,MyD88通过miR-146a的靶基因形成MyD88-IRAKs-TRAF-6复合体参加信号传导,最终促进下游NF-κB通路的激活,释放炎症因子[28]。本实验RT-qPCR法检测显示,干预后,高、中、低剂量组miR-146a的表达均升高,TLR4、TRAF-6的表达均降低,说明芍药甘草汤可以提高兔颈后肌中miR-146a的表达,降低 TLR4和TRAF-6的表达,且高剂量效果最佳。
4 结 论
芍药甘草汤减轻兔颈后肌的炎症损伤,其作用机制可能是兔颈后肌组织中miR-146a通过抑制其重要的靶基因TRAF-6的水平减少TLR4下游NF-κB信号通路释放IL-1β、IL-6、TNF-α等炎症因子。

