澳大利亚药品安全治理研究及对我国的启示
陈佳妮 陈永法


中圖分类号 R951 文献标志码 A 文章编号 1001-0408(2020)05-0549-05
DOI 10.6039/j.issn.1001-0408.2020.05.09
摘 要 目的:为改进我国药品安全治理相关支撑体系提供借鉴。方法:通过分析澳大利亚药品安全治理的主要方式、特点及成效,初步提出建设我国药品安全治理制度的建议。结果与结论:澳大利亚主要通过联邦和州/领地政府进行分工合作、与不同相关主体分别开展政策磋商、基于产业发展水平引导产业主体自律、支持行业参与药品广告监管等方式开展药品安全治理;澳大利亚药品安全治理具有搭建信息共享平台而增加政府工作透明度、开展针对性教育提高参与主体治理能力等特点;取得了药品召回事件发生状况显著改善、利益相关者对药品监管部门沟通活动的满意度大幅提升等成效。相较之下,我国相关主体参与药品安全治理的意识和能力尚不强,保障这些主体参与的制度也尚未健全。建议通过更加注重上下级政府部门之间的沟通互动、对非政府主体负责人开展针对性宣教或培训、落实非政府主体的政策磋商权利以及基于行业主体的自我管理能力引导其自律等方面,初步构建我国的药品安全治理体系,提高治理效率。
关键词 澳大利亚;药品安全;治理体系;启示
Research on Drug Safety Governance in Australia and Its Enlightenment to China
CHEN Jiani,CHEN Yongfa(School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT OBJECTIVE: To provide reference for improving the supporting system of drug safety governance in China. METHODS: Through analyzing the main ways, characteristics and effectiveness of drug safety governance in Australia, the suggestions for building drug safety governance system in China were put forward initially. RESULTS & CONCLUSIONS: The methods of Australias drug safety governance are to conduct division of labor between the federal and state/territory governments, conduct policy consultations with different related entities separately, guide industry self-discipline based on industrial development level, and support industry to participate in drug advertising supervision. Australias drug safety governance has the characteristics of large information sharing channels, increasing the transparency of government work, carrying out targeted education and enhancing the governance capacity of participants etc. It has achieved significant improvement in the occurrence of drug recall events, and significant increase in the satisfaction of stakeholders in the communication activities of drug regulatory authorities. In contrast, the participation consciousness and ability of relevant entities in China are still not strong, and the system to ensure the participation of these entities is not yet sound. It is recommended that China should pay more attention to the communication between the upper and lower levels of governments, conduct targeted education or training for principals of non-government entities, implement the policy consultation rights of non-government entities, as well as guide self-discipline based on self-management ability of industry entities so as to initially establish drug safety governance system in China, and enhance the governance efficiency.
KEYWORDS Australia; Drug safety; Governance system; Enlightenment
药品安全是建设健康中国、增进人民福祉的重要内容。随着科学技术的发展,面对兼具复杂性与长期性的药品安全问题,摒弃传统政府监管,建立现代化社会治理模式已成为各国提高药品安全公共事务管理绩效的理想选择[1]。我国近年来也未能避免“长春长生公司问题疫苗案”“黑龙江特大生产销售假药案”等牵动公众神经的药品安全事件的发生[2-3],一再提示仅靠政府监管已难以承担沉重的执法负荷,加快形成药品安全治理格局迫在眉睫。在此背景下,作为对中共中央政治局第二十三次集体学习内容的贯彻落实,2017年《“十三五”国家药品安全规划》提出:“坚持最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,加快建成药品安全现代化治理体系”[4]。我国政府正通过“监管科学行动计划”加强药品安全监管工作[5],但由于治理理念在药品安全领域的提出时间尚短,治理体系建设相关的支撑制度的构建及实践仍待探索。
作为药品安全保障水平较高的国家之一,澳大利亚自20世纪80年代以来就已将多元主体合作方法作为药品安全管理的重要内容,21世纪初在“开放性政府”战略指导下又建立健全了保障多元主体参与的配套制度,这不仅极大丰富了治理方式,还大幅提升了治理成效[6]。因此,剖析澳大利亚药品安全治理的成功经验,或可为我国相应治理体系的建设提供有益参考。
1 澳大利亚药品安全治理的主要方式
据1990年联合国全球治理委员会(Commission on Global Governance)对“治理”的定义:“治理是或公或私的个人和机构管理共同事务的诸多方式的总和,使相互冲突或不尽相同的多元利益得以调和并采取联合行动的持续过程”[7]。当前在政府主导下,非政府主体有序地参与到了澳大利亚的药品安全治理中。
1.1 联邦和州/领地政府进行分工合作,保障监管效率
为保障药品安全监管效率,澳大利亚联邦集中行使药品安全监管权力,地方负责当地流通和使用环节的药品监管[6]。澳大利亚联邦卫生部的治疗用品管理局(Therapeutic Goods Administration,TGA),作为专门机构负责药品供应、进出口、制造和广告监管。同时,为提高各地药品监管标准的一致性,联邦和地方共同出台了《药品和毒药统一调度安排》(Uniform Scheduling of Medicines and Poisons),明确了药品和毒药的分类及监控水平(包括标签、包装和供应点等),并要求地方另外立法以在当地强制执行[8]。具体而言,联邦、州领地政府通过共同提名政府外部专家以组建化学品调度咨询委员会(Advisory Committee on Medicines Scheduling)、药品调度咨询委员会(Advisory Committee on Chemicals Scheduling),并由上述委员会负责对调度安排提出调整建议,再由联邦卫生部部长作出最终调整决定。对于上述调度安排在州地的执行,州地不设置TGA的派出机构,而是通过自主安排政府机构执行。
1.2 与不同主体分别开展政策磋商,提升决策科学性
为提升澳大利亚药品安全监管决策的科学性和民主性,TGA设有一系列由不同非政府主体组成的机构,分别就各类政策事宜开展磋商。就卫生专业人员而言,TGA设有一系列法定的外部委员会为有关新药申请的证据评估提供独立的专业意见[9],详见表1。依据1991年《治疗用品法规》(Therapeutic Goods Regulations),法定外部委员会的大多成员由卫生部长任命,且必须具有相关临床、科学领域或消费者健康问题的专业知识。就行业和消费者而言,可通过TGA磋商委员会(TGA Consultative Committee)及消费者健康论坛(Consumers Health Forum),就广泛的政策、资源分配和计划绩效问题与政府进行磋商[10]。TGA磋商委员会成员包括医药企业以及行业协会、卫生专业人员和消费者团体,负责为相对权威的行业或非行业机构提供磋商论坛;而消费者健康论坛成员则为州地健康消费者组织或致力于特定健康目标的组织,作为代表澳大利亚医疗保健消费者利益的国家最高权威机构参与卫生体系的议程制定。
1.3 基于产业发展水平引导产业主体自律,提高治理成效
为保证药品安全治理成效,澳大利亚依据产业发展水平对药品行业相应采取单纯监管或辅以鼓励自律手段。二战后澳大利亚国内药品产业规模小,难以保障药品供应且产品质量差,因而药品由原先的州领地监管转变为联邦集中监管,严格管控药品的安全、有效及质量[6]。其后药品产业在高监管要求下建设水平大幅提升,同时包括药品行业协会在内的非政府组织在政策支持下也得到极大发展,20世纪初非政府组织创造的经济价值至少达到430亿美元[11]。为引导产业主体发挥治理作用,澳大利亚为其提供充分自律空间。一方面处方药广告(面向卫生专业人士)基本交由行业管理,行业组织通过制定行为准则约束组织成员行为。例如行业协会澳洲医药(Medicine Australia)制定了《行为准则》(Code of Conduct),详细规定了处方药广告标准及管理安排等,并设有准则委员会负责广告监控。另一方面鼓励企业建设合规体系以进行自我管理。TGA根据分类依据判断企业合规风险水平[12],包括合规意愿及合规体系有效性,而后采取相应工具处理其违规行为,详见表2。TGA倾向于仅提供教育和指导,而若企业合规意愿不足或违规后果影响消费者使用,则将升级监管行动。
表2 TGA基于风险的合规管理方法
1.4 支持行业参与药品广告监管,减轻政府监管负担
为减轻政府监管负担并发挥行业治理能力,澳大利亚治疗用品的部分广告支持行业组织参与监管。根据1989年《治疗用品法》(Therapeutic Goods Act)以及2018年《治療用品广告法则》(Therapeutic Goods Advertising Code),非政府组织和卫生部共同负责对“特定媒体”(包括主流印刷媒体、广播媒体、电影和有关商品展示)上的公众药品广告进行播放或公布前的审批[13]。具体而言,补充医疗保健行业协会(Complementary Healthcare Council)、澳大利亚消费者保健产品专家协会(Consumer Healthcare Products Australia)分别负责审批补充药品部分(除广播媒体以外),以及补充药品的广播媒体部分及非处方药部分。申请者需分别将申请及相关文件和费用提交至相应的协会,后者将授予审批合格的广告以批准文号,而申请者若对审批结果有异议可将有关材料提交至卫生部。卫生部将进行实质性内部审查并对审批结果作出是否更改的决定,而申请者若仍不满意则可进一步交由行政上诉法庭处理。
2 澳大利亚药品安全治理的特点
2.1 搭建信息共享渠道,增强政府工作透明度
为实现药品监管部门与其他利益相关主体的信息共享,TGA通过多种途径提升日常工作信息的公开范围和幅度。一方面TGA定期在官网发布新闻更新、推文和公告[14-15]。例如TGA法定咨询委员会的信息在TGA官网委员会专栏公开,包括成员任职情况及责任义务等;政策磋商反馈及企业合规情况均通过《监管机构绩效框架:自我评估报告》每年在绩效报告专栏跟进。另一方面为进一步提高各主体获取信息的便捷性,TGA推出了面向各群体的应用程序[16]。例如MedSearchTM应用程序,可供普通社区和卫生专业人士轻松访问ARTG条目;为帮助中小企业更好了解和应对治疗用品监管环境,2017年6月TGA启动SME Assist服务,针对中小企业和研发团队开发的新药和设备,提供基于网络的支持性材料及培训研讨会。
2.2 开展针对性教育,培育参与主体治理能力
为提升各主体对澳大利亚药品安全监管的认识,提升其参与药品安全治理的能力,TGA针对不同的药品安全治理行动、不同主体分别制定了相适应的教育材料[17]。例如,为提高各主体对TGA“基于风险的监管框架”的认识,TGA在网站上将该框架以清晰、易懂和易于获取的格式公开提供[16],并针对行业、消费者、卫生专业人士分别出版教育材料,如《TGA商业服务行业用户指南》的教学视频、《干细胞的治疗和调节作用——消费者的简易指南》文件或针对卫生专业人士的《“更新的药品成分名称”情况说明》文件等。又如,为告知相关主体2018-2020年治疗用品广告管理的改革详情,TGA为广告商推出了2018年《治疗用品广告法则》的网络研讨会等,而为消费者推出了“广告中心功能的用户体验测试”程序、有关“举报误导性或非法广告”的视频等[18]。
3 澳大利亚药品安全治理的成效
3.1 药品召回事件发生状况显著改善
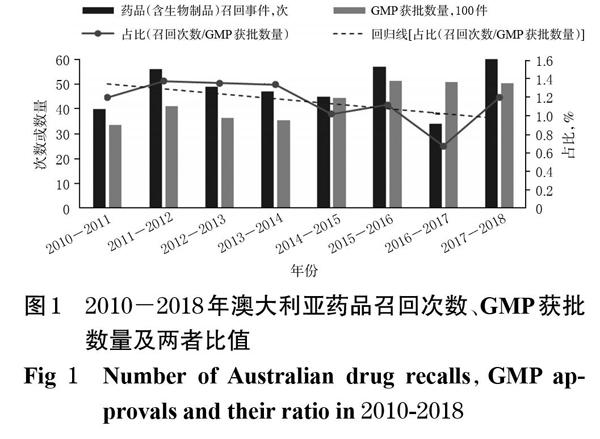
药品召回可将问题产品及时撤市,保障患者的用药安全。自2000年以来,尽管药品召回事件发生次数呈上升趋势,但在药品供应量日益增长的背景下,药品召回事件发生占比呈显著降低趋势,详见图1。在澳大利亚,所供应的所有药品(除非获得豁免)均需获《药品生产质量管理规范》(Good Manufacturing Practice,GMP)认证,因此国家所认可的GMP数量可侧面反映出澳大利亚药品供应规模。从2010年至2017年,GMP证书的颁发数量增幅达近50%,而药品召回事件发生次数占比在2016-2017年达到近十年最低水平。可见,澳大利亚药品安全治理举措能够在满足公众对药品可及性需求的同时,保障所供应药品的高安全水平。
3.2 利益相关者对药品监管部门沟通活动的参与数量及满意度大幅提升
药品安全利益相关者间的有效沟通可促进相互理解,并提升主体间的合作意愿和水平。TGA通过举办磋商、信息会议及展览等多样化形式的沟通活动,极大提升了利益相关主体对政府活动的参与度以及满意度,详见图2。据《TGA利益相关者调查报告》[19]显示,较之2016年,2018年受访对象(包括卫生专业、政府、药企人士及公众等)人均参与TGA活动的数量从1.4个增至2.1个,并且对活动总体满意度达78.9%,涨幅达6.1%。其中,对各项活动安排的满意度情况也得到显著改善。例如之前每年均获得最低满意度的磋商活动,在2018年其总体满意度达69%,增长了9.4%,且磋商流程的跟进情况、磋商程序等具体项目的得分也均得到改善或提高。
4 澳大利亚药品安全治理经验对我国的启示
4.1 更加注重上下级政府之间的沟通互动,保障政府监管成效
2019年修订通过的《中华人民共和国药品管理法》,很大程度回应了各界对药品安全监管的诉求,也进一步完善了我国药品安全政策法规体系。上述法律的后续落实还需要政府上下级之间的持续协调配合,但总体上我国在政策法规落实过程中的工作还可进一步改进[20]。各级地方政府作为我国药品安全政策法规的执行者,不仅需要严格执行国家层面以及上级政府的政策法规,面对复杂多变的药品安全问题,也需要基于与上级的沟通,根据实际情况不断创新监管方式,以保障立法与执法之间的有效衔接[21]。为此,应当建立保障上下级药品安全信息沟通的常态化机制。地方政府应向上级主管部门定期汇报当地监管情况,及时报告突发状况,而在充分掌握下级情况的基础上,上级主管部门则可对地方进行精准化指导,并且针对重点、难点或共性事项,还可召集所有地方政府進行共同磋商,从而提升政府整体的监管绩效。
4.2 对非政府主体开展针对性宣教/培训,提升其参与意识及能力
随着我国经济体系与社会结构的不断变革完善,公私部门间的界限逐渐模糊,非政府主体参与公共事务管理的意愿与能力得到一定提升,如北京市“西城大妈”等民间自发组织并参与管理的社会组织相继出现并发展壮大[22]。尽管如此,总体上非政府主体参与药品安全治理的意愿与能力还有较大的提升空间,行业协会行政化色彩浓重、自我规范机制匮乏及公众参与执法的积极性不高等问题在我国仍然突出[23-24]。为此,对于行业协会,应加快厘清与行政机关在机构、职能及资产财务等方面的界限,充分保障其行动自主性。而对于公众、行业协会等广泛的非政府主体,均可通过制定个性化教育材料、开拓线上线下双重渠道,以及配合新政策法规的出台及时提供相应的指导文件或应用程序等,全面、及时地培育相关主体参与药品安全治理的意愿与能力。
4.3 落实非政府主体的政策磋商权利,保障药品决策的科学性
对于非政府主体参与政策磋商,《中华人民共和国立法法》中有原则性规定,并且通过立法草案的意见征求文件、听证会以及座谈会等形式将其付诸实践。然而从实施效果而言,决策仍缺乏透明性、民主性。政府的意见征询较之内容常更重于程序,缺乏采纳结果的反馈及说明[24],而非政府主体常局限于熟知自身情况,缺乏对立法全局信息及专业知识的把握,难以有效提出其制度诉求[25]。为发挥非政府主体对决策的实质影响,一方面应基于上述法律进一步出台细化规定,明确非政府主体参与政策磋商的主体资质情况、政策范围以及具体程序等,并可根据主体类别分别设置与其诉求相适应的参与范畴;另一方面可在相关立法全过程中,通过官方网站、新闻媒体等对立法的中长期规划、参与主体和流程,以及拟立法草案和依据等进行酌情公开或互动交流,确保非政府主体知情或参与决策,发挥监督作用,从而保障药品决策的科学性。
4.4 基于行業主体的自我管理能力引导其自律,提高治理效率
随着2015年《行业协会商与行政机关脱钩总体方案》、2016年《关于改革社会组织管理制度促进社会组织健康有序发展》等支持行业协会作为独立于政府、企业的第三部门而大力发展的政策相继出台,我国行业协会逐步获得了一定自主性,并通过“政府购买服务”等方式逐步参与到治理中[23]。然而行业协会的集中度及权威性缺乏、内部治理结构建设不完善、社会认知度及公信力不足等诸多问题尚未得到解决[26];同时,尽管上述政策已从税收、人才支持等方面提出指导,但相关衔接制度还未构建。为此,应加快衔接制度建设,对具备一定资质(如规模及治理结构较完善)的行业协会,引导其建立自律机制;同时建立配套监督机制,确保行业协会服务质量。此外,对于医药企业,基于行业协会对其规范作用的发挥,政府通过考察企业合规历史等因素,对表现良好者可相应降低监管力度,从而充分发挥行业自律作用,减轻政府负担,提高治理效率。
参考文献
[ 1 ] 杨炳霖.从“政府监管”到“监管治理”[J].中国政法大学学报,2018,64(2):90-104、207-208.
[ 2 ] 中国法院网.内蒙古警方破获一起特大生产、销售假药案[EB/OL].(2018-07-23)[2019-11-09].https://www.chinacourt.org/article/detail/2018/07/id/3401138.shtml.
[ 3 ] 罗壹天.论我国疫苗生产管理体制问题:以长春长生公司疫苗事故为案例[J].现代商业,2018(35):132-133.
[ 4 ] 国务院.国务院关于印发“十三五”国家食品安全规划和“十三五”国家药品安全规划的通知[EB/OL].(2017-02- 21)[2019-11-09].http://www.gov.cn/zhengce/content/2017-02/21/content_5169755.htm.
[ 5 ] 国家药品监督管理局.国家药监局启动中国药品监管科学行动计划[EB/OL].(2019-05-02)[2019-11-11].http://www.gov.cn/xinwen/2019-05/02/content_5388253.htm.
[ 6 ] JOHN M. A history of therapeutic goods regulation in Australia[EB/OL].(2007-09-30)[2019-11-09].https://www.tga.gov.au/sites/default/files/history-tg-regulation.pdf.
[ 7 ] Commission on Global Governance. Our global neighborhood[EB/OL].(1995-12-12)[2019-11-27].http://www.gdrc.org/u-gov/global-neighbourhood/chap1.htm.
[ 8 ] Therapeutic Goods Administration. Scheduling basics[EB/OL].(2019-09-14)[2019-11-09].https://www.tga.gov.au/scheduling-basics.
[ 9 ] Therapeutic Goods Administration. TGA statutory advisory committees[EB/OL].(2019-08-28)[2019-11-27].https://www.tga.gov.au/tga-statutory-advisory-committees.
[10] Strategic Consulting Services Pty,Ltd. Review of the therapeutic goods administrations consultative arrangements[EB/OL].(2004-06-30)[2019-11-09].https://www.tga.gov.au/sites/default/files/review-tga-consultative-arrangements-0407.pdf.
[11] PHILLIPS R,GOODWIN S. Third sector social policy research in Australia:new actors,new politics[J]. Voluntas:International Journal of Voluntary & Nonprofit Organizations,2014,25(3):565-584.
[12] Therapeutic Goods Administration. Regulatory compliance framework[EB/OL].(2019-08-09)[2019-11-09].https://www.tga.gov.au/regulatory-compliance-framework.
[13] Therapeutic Goods Administration. Australian regulatory guidelines for advertising therapeutic goods (ARGATG)[EB/OL].(2018-11-08)[2019-11-09].https://www.tga.gov.au/book-page/pre-approvals-advertising#specified.
[14] Therapeutic Goods Administration. About TGA[EB/OL].(2019-11-11)[2019-11-27].https://www.tga.gov.au/about-tga.
[15] Therapeutic Goods Administration. News room[EB/OL].(2018-11-11)[2019-11-27].https://www.tga.gov.au/news- room.
[16] Therapeutic Goods Administration. Regulator performan- ce framework:self-assessment report[EB/OL].(2018- 04-26)[2019-11-09].https://www.tga.gov.au/regulator- performance-framework-self-assessment-report-july-2016- june-2017.
[17] Therapeutic Goods Administration. TGA external communication and education framework[EB/OL].(2012-12- 21)[2019-11-09].https://www.tga.gov.au/publication/tga- external-communication-and-education-framework.
[18] Therapeutic Goods Administration. Advertising hub[EB/OL].(2019-11-11)[2019-11-27].https://www.tga.gov.au/advertising-hub.
[19] Therapeutic Goods Administration. TGA stakeholder surveys[EB/OL].(2018-12-20)[2019-11-27].https://www.tga.gov.au/publication/tga-stakeholder-surveys.
[20] 常征.央地互動的立法试验:基于湖南重大行政决策程序法治化的分析[J].中共天津市委党校学报,2018(2):50-55.
[21] 吴祖妮.乡镇食品药品安全监管问题与对策研究[D].重庆:西南政法大学,2015.
[22] 陈广晶.食药安全志愿者又添新成员,“西城大妈”助力食药监管效果显著[J].首都食品与医药,2017(13):13.
[23] 傅昌波,简燕平.行业协会商会与行政脱钩改革的难点与对策[J].行政管理改革,2016(10):36-40.
[24] 陈永法,覃红艺.我国公众参与食品和药品安全治理的不足及对策[J].中国药房,2016,27(16):2164-2167.
[25] 张欣.互联网时代的媒体信息和立法决策:以《校车安全管理条例》为例[J].北方法学,2016,10(5):94-106.
[26] 吴镝,吴波.关于完善医药行业协会促进医药行业发展的研究[J].中国卫生产业,2015(6):81-82.
(收稿日期:2019-09-25 修回日期:2019-12-02)
(编辑:刘明伟)

