AMPK介导线粒体融合与裂变在抑制P2X7受体抗神经元缺氧/复氧损伤中的作用
王雪如,门运政,胡 淼,洪玉洁,刘心怡,董淑英
缺血性脑卒中是一种严重影响人类健康的疾病,目前主要的治疗措施是及时恢复血液再灌注,而恢复血液再灌注的过程中会出现缺血/再灌注(ischemia/reperfusion,I/R)损伤[1-2]这一病理生理改变。近年来,针对脑I/R损伤的病理生理机制及如何减轻这一损伤的研究成为热点。线粒体是为细胞提供能量的细胞器,在生理状态下线粒体处于融合与裂变的动态平衡之中,但当发生I/R损伤时线粒体趋向于裂变增多[3],因此抑制线粒体裂变或促进线粒体融合可能是减轻I/R损伤的措施之一。
AMP-activated protein kinase(AMPK)是一种能量传感器,它在细胞能量代谢调节中起着至关重要的作用[4]。研究[5]表明AMPK在调节线粒体的形态和功能中发挥重要的作用。P2X7受体是一种嘌呤受体,文献[6-7]报道抑制P2X7受体可以减轻大鼠脑I/R损伤,但具体的作用机制仍需要进一步探讨。研究[8]表明,在酒精性肝病中,阻断P2X7受体能增强AMPK活性。然而抑制P2X7受体产生的抗脑I/R损伤作用是否与AMPK调控线粒的融合与裂变有关,仍需要进一步研究。亮蓝G(Bright Blue G,BBG)是P2X7受体的选择性抑制剂,可通过抑制PX27受体减轻脑I/R损伤。神经元是对缺氧最为敏感的神经细胞,因此本实验采用神经元缺氧/复氧(hypoxia/reoxygenation,H/R)损伤模型模拟在体的小鼠脑I/R损伤,探讨AMPK对线粒体的融合与裂变的调控在抑制P2X7受体抗脑H/R损伤中的作用。
1 材料与方法
1.1 动物与试剂 怀孕18~21 d的孕鼠;Bright Blue G(BBG:P2X7受体抑制剂)、Dorsorphin(AMPK抑制剂)、45%葡萄糖、多聚赖氨酸均购于Sigma公司;神经元培养液、B27、pen-strep、左旋谷氨酰胺、DMEM/F12培养粉、无糖DMEM培养粉均购于Gibco公司;胎牛血清购于四季青公司;p-AMPK单克隆抗体、p-Drp1单克隆抗体、Mfn2单克隆抗体均购于CST公司;GAPDH单克隆抗体购于Proteintech公司;山羊抗小鼠IgG二抗、山羊抗兔IgG二抗均购于biosharp公司。
1.2 神经元细胞原代培养 处死孕鼠取出胎鼠,在无菌环境下断头取脑,剪碎。加入0.125%胰酶消化10 min,每隔5 min震荡一次。消化完成后加入等量含10%胎牛血清的DMEM/F12培养液终止消化,在1 500 r/min的条件下离心5 min,弃去上清液后加入适量培养液再次离心。离心完成后加入适量含10%胎牛血清的DMEM/F12培养液吹打均匀,静置收集细胞,所有操作都在冰上进行。将收集到的细胞调整好密度种于孔板之中,于37 ℃、5%CO2、95%O2培养箱内培养9~12 d后进相关实验。
1.3 分组、给药及H/R损伤模型制备 神经元细胞随机分为正常对照(Control)组、H/R组、H/R+BBG组、H/R+BBG+Dorsomorphin组。BBG于缺氧时加入,终浓度为50 nmol/L[6];Dorsomorphin于复氧时加入,终浓度为10 μmol/L[9]。神经元细胞培养9~12 d后弃去正常的神经元培养液,更换为无糖无血清的DMEM/F12培养液,置于37 ℃、1%O2、5%CO2、94%N2培养箱内培养2 h。2 h后将DMEM/F12培养液更换为正常的神经元培养液,置于37 ℃、5%CO2、95%O2培养箱内复氧24 h。除Control组不做处理外,剩余组别均进行H/R操作以及不同的给药处理。模型制备完成后再进行后续的实验操作。
1.4 细胞存活率检测 采用Calcein-AM/PI双染法检测细胞存活率。神经元细胞复氧24 h后,用PBS清洗3次,每次5 min。避光加入配制好的Calcein-AM/PI染液,于37 ℃、5%CO2、95%O2培养箱内孵育15 min。孵育完成后用PBS清洗3次,每次5 min。之后在荧光显微镜下观察强弱荧光变化。红色荧光代表死细胞,绿色荧光代表活细胞。
1.5 线粒体形态检测 采用Mito TrackerTMGreen FM试剂盒检测线粒体形态。神经元细胞复氧24 h后,用PBS清洗3次,每次5 min。加入Mito TrackerTMGreen FM染液,于37 ℃、5% CO2、95% O2培养箱内孵育45 min。孵育完成后用PBS清洗,之后在共聚焦显微镜下观察线粒体的形态变化。
1.6 活性氧(ROS)检测 采用ROS试剂盒检测ROS的含量。神经元细胞复氧24 h后,用PBS清洗3次,每次5 min。避光加入配制好的ROS染液,于37 ℃、5% CO2、95% O2培养箱内孵育30 min。孵育完成后用PBS清洗3次,每次5 min。之后在荧光显微镜下观察荧光强弱变化。为绿色荧光,荧光强度越强代表ROS含量越高。
1.7 Western blotting检测 p-AMPK、p-Drp1、Mfn2蛋白的表达细胞复氧24 h后,用PBS清洗3次,每次5 min。加入0.25%的胰酶消化细胞,收集至离心管中,于2 500 r/min条件下离心10 min。离心完成后弃去上清液,加入适量裂解液于冰上裂解30 min。之后在4 ℃离心机中以12 000 r/min的条件离心30 min。收集上清液,一部分用于测定蛋白浓度,一部分用于蛋白定量。按照蛋白分子量的大小配制不同浓度的SDS-聚丙烯酰胺凝胶,电泳分离蛋白质。电泳后将蛋白转至硝酸纤维膜上,将膜用TPBS (0.05%Tween-TBS) 配制的5%脱脂牛奶室温封闭2 h后,分别孵育p-AMPK、p-Drp1、Mfn2等一抗,于4 ℃冰箱中孵育过夜。一抗孵育完成后用TPBS将膜清洗3次,每次5 min,再与过氧化物标记的二抗孵育2 h后,将膜用TPBS清洗3次,每次5 min。加入ECL显色液,在凝胶成像系统中曝光显影,采集蛋白条带。最后用Image J软件对所得蛋白条带进行灰度值分析。
1.8 统计学方法 采用方差分析及q检验。
2 结果
2.1 抑制P2X7受体对H/R损伤神经元细胞死亡率的影响 采用Calcein-AM/PI双染法检测细胞死亡率,红色代表死细胞、绿色代表活细胞,结果见图1。与Control组相比,H/R组细胞死亡率明显增加(P<0.01);但在使用BBG抑制P2X7受体之后,细胞死亡率则明显降低(P<0.01);而与H/R+BBG组相比,在抑制P2X7受体的基础上进一步使用Dorsomorphin抑制AMPK后,H/R损伤神经元细胞的死亡率又明显增加(P<0.01)(见表1)。
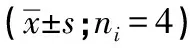

分组死亡率/%FPMS组内Control组 6.82±1.27 H/RH/R+BBG组 49.35±3.27∗∗ 27.5±2.11∗∗##260.30<0.014.929 H/R+BBG+Dorsomorphin组 36.65±1.72∗∗##△△
q检验:与Control组比较**P<0.01;与H/R组比较##P<0.01;与H/R+BBG组比较△△P<0.01
2.2 抑制P2X7受体对线粒体融合与裂变的影响 采用Mito TrackerTMGreen FM试剂盒检测线粒体形态,结果见图2。与Control组相比,H/R组细胞线粒体的长度变短;但在使用BBG抑制P2X7受体之后,H/R损伤神经元细胞线粒体的长度增加;然而与H/R+BBG组相比,在抑制P2X7受体的基础上进一步使用Dorsomorphin抑制AMPK后,H/R损伤神经元细胞线粒体的长度又变短。
2.3 抑制P2X7受体对H/R损伤神经元细胞ROS产生的影响 线粒体是ROS产生的场所,线粒体裂变增多则ROS含量增加。采用ROS试剂盒检测ROS的含量,荧光强度越强,代表ROS含量越高,结果见图3。与Control组相比,H/R组ROS含量明显增加;但在使用BBG抑制P2X7受体之后,ROS含量则明显降低;然而与H/R+BBG组相比,在抑制P2X7受体的基础上进一步使用Dorsomorphin抑制AMPK后神经元细胞的ROS含量又明显增加。
2.4 抑制P2X7受体对H/R损伤神经元细胞中p-AMPK表达的影响 采用Western blotting法检测p-AMPK的表达,结果见图4。与Control组相比,H/R组神经元细胞p-AMPK的表达明显降低(P<0.01);但在使用BBG抑制P2X7受体之后,H/R损伤神经元细胞p-AMPK的表达则显著增加(P<0.01);然而与H/R+BBG组相比,在抑制P2X7受体的基础上进一步使用Dorsomorphin抑制AMPK后H/R损伤神经元细胞p-AMPK的表达又明显降低(P<0.01)(见表2)。
2.5 抑制P2X7受体对H/R损伤神经元细胞中Mfn2与p-Drp1表达的影响 采用Western blotting法检测Mfn2、p-Drp1的表达,结果见图5。与Control组相比,H/R组神经元细胞Mfn2的表达明显降低(P<0.01),而p-Drp1的表达则显著增加(P<0.01);但在使用BBG抑制P2X7受体之后,H/R损伤神经元细胞Mfn2的表达明显增加(P<0.01),而p-Drp1的表达则显著减少(P<0.01);然而与H/R+BBG组相比,在抑制P2X7受体的基础上进一步使用Dorsomorphin抑制AMPK后,H/R损伤神经元细胞Mfn2的表达又明显降低(P<0.01),而p-Drp1的表达则显著增加(P<0.01)(见表3~4)。
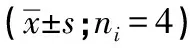
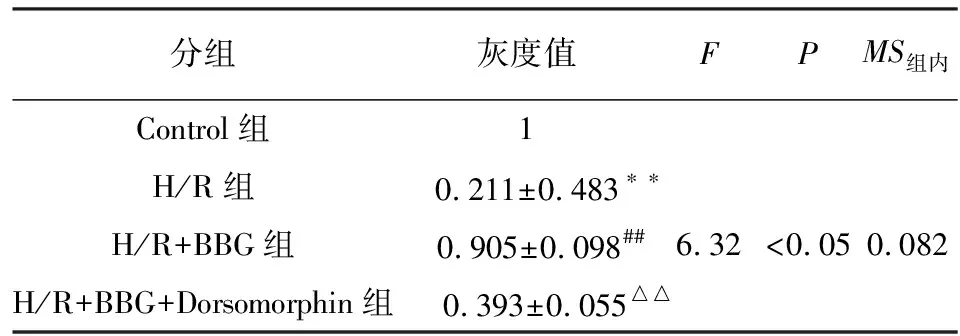
分组灰度值FPMS组内Control组1H/R组 0.211±0.483∗∗H/R+BBG组 0.905±0.098##6.32<0.050.082H/R+BBG+Dorsomorphin组 0.393±0.055△△
q检验:与Control组比较**P<0.01;与H/R组比较##P<0.01;与H/R+BBG组比较△△P<0.01
3 讨论
P2X7受体是P2X家族中的一种ATP门控离子通道,在神经胶质细胞和神经元中广泛表达[10-11]。研究[12]表明,P2X7受体在损伤后被迅速激活并传递活跃的神经递质、促炎性趋化分子和细胞因子至靶器官和细胞,最终导致后续的生物反应。抑制P2X7受体可以减轻脑I/R损伤,在本实验中,抑制P2X7受体后H/R损伤神经元细胞的死亡率降低也证实了这一点,但具体的作用机制仍需进一步研究。
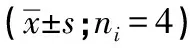
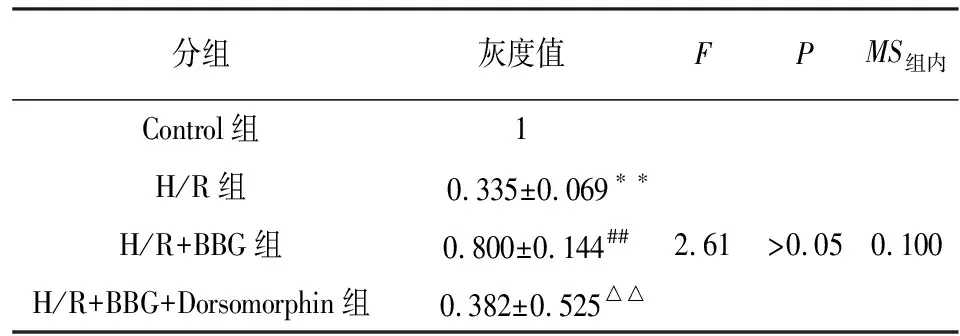
分组灰度值FPMS组内Control组1H/R组 0.335±0.069∗∗H/R+BBG组 0.800±0.144##2.61>0.050.100H/R+BBG+Dorsomorphin组 0.382±0.525△△
q检验:与Control组比较**P<0.01;与H/R组比较##P<0.01;与H/R+BBG组比较△△P<0.01
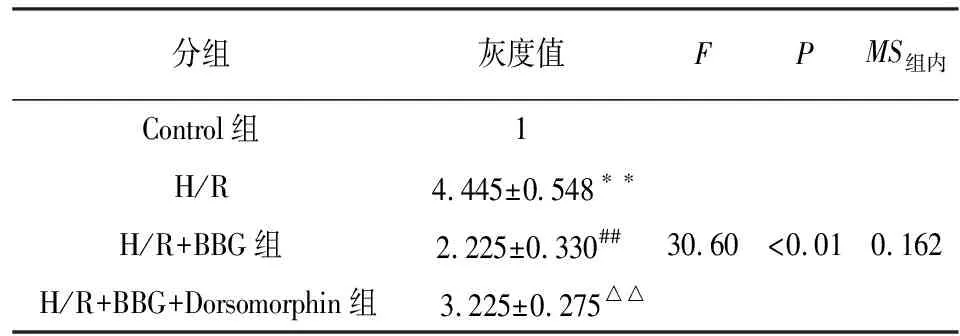
分组灰度值FPMS组内Control组1H/R 4.445±0.548∗∗H/R+BBG组2.225±0.330##30.60<0.010.162H/R+BBG+Dorsomorphin组 3.225±0.275△△
q检验:与Control组比较**P<0.01;与H/R组比较##P<0.01;与H/R+BBG组比较△△P<0.01
线粒体是为细胞生存提供能量的动态细胞器,在正常状态下不断地经历融合与裂变两个相反的过程,但当发生I/R损伤时,其动态平衡遭到破坏并趋向于裂变,而线粒体的动态平衡又是决定线粒体功能的重要因素,因此维持线粒体的动态平衡是治疗I/R损伤的一种措施[13]。线粒体是ROS产生的场所,当发生I/R损伤时线粒体裂变增多,ROS的产生增加,而ROS可以改变线粒体膜电位,线粒体膜电位降低会损害线粒体能量代谢,并通过诱导促凋亡因子从线粒体漏入细胞质而进一步促进线粒体凋亡激活,从而进一步加重损伤[14-15]。在本实验中发现,抑制P2X7受体后H/R损伤神经元细胞中线粒体的裂变明显减少,Mfn2的表达显著增加而p-Drp1的表达则显著降低,同时ROS的含量也明显减少,这些结果表明抑制P2X7受体可能通过减少线粒体裂变、促进线粒体融合、减少ROS的产生来减轻神经元H/R损伤。
AMPK是细胞能量平衡的主传感器,是细胞碳水化合物和脂肪代谢、ATP保存和合成的基础调控因子[16]。近年来的研究[17-18]表明,激活AMPK信号通路可以通过抑制细胞凋亡和氧化应激来减轻神经元H/R损伤和脑I/R损伤,但其作用是否与激活AMPK有关尚鲜有文献报道。本实验发现,抑制P2X7受体后神经元细胞中p-AMPK的表达明显增加,同时H/R损伤神经元细胞的死亡率降低,但在抑制P2X7受体的基础上进一步抑制AMPK后,神经元细胞中p-AMPK的表达明显减少,H/R损伤神经元细胞的死亡率也显著增加。这些结果说明,抑制P2X7受体可通过增加p-AMPK的表达来减轻神经元H/R损伤。
本实验结果表明抑制P2X7受体可以通过减少线粒体的裂变、促进融合来减轻小鼠脑I/R损伤,但是抑制P2X7受体如何调节线粒体的融合与裂变尚不清楚。大量研究[15,19-20]表明AMPK与线粒体的动力学和功能密切相关,因此本课题探讨在神经元H/R损伤中AMPK与线粒体的融合与裂变的关系。结果表明,抑制P2X7受体后,p-AMPK的表达显著增加,H/R损伤神经元细胞中线粒体裂变减少而融合增多。同时,H/R损伤神经元细胞中Mfn2的表达显著增加而p-Drp1的表达则显著降低。但在抑制P2X7受体的基础上进一步抑制AMPK后,神经元细胞中线粒体裂变增多而融合减少,且H/R损伤神经元细胞中Mfn2的表达显著降低而p-Drp1的表达则显著增加。这些结果表明抑制P2X7受体可以通过调节AMPK减少线粒体裂变,促进线粒体融合从而减轻神经元细胞H/R损伤。
综上所述,本研究通过对抑制P2X7受体减轻神经元H/R损伤的机制进行探究发现,抑制P2X7受体可能通过调节AMPK抑制线粒体的裂变、促进线粒体的融合,从而发挥抗神经元H/R损伤的作用。

