基于SERS技术快速检测水溶液、 尿液和血清中咪达唑仑的研究
韩斯琴高娃, 张 晨, 陈薪璇, 张艳华, 哈斯乌力吉*
1. 哈尔滨工业大学可调谐(气体)激光技术国家级重点实验室, 黑龙江 哈尔滨 150080 2. 内蒙古民族大学附属医院口腔科, 内蒙古 通辽 028007 3. 哈尔滨医科大学附属第二医院妇产科, 黑龙江 哈尔滨 150086
引 言
药品滥用, 又被称为“吸毒”, 是指非医疗目的连续大量使用具有使人产生依赖性的药物。 当前毒品被国际禁毒组织分为两大类, 即精神药品和麻醉药品。 麻醉药品和精神药品的非法滥用已经成为社会的一大危害, 严重危害了人们的生理和心理健康, 并且会诱发各种犯罪, 严重影响人们的生活秩序, 破坏社会风气。
经常听到的毒品名称有海洛因、 甲基苯丙胺(俗称“冰毒”)等, 但是对其他新型毒品可能还比较陌生, 如硝甲西泮、 艾司唑仑、 咪达唑仑、 麻古等。 二类精神药品咪达唑仑(药品名为力月西)的毒品案件屡有发生, 与海洛因的折算率为1 g咪达唑仑相当于0.000 1 g海洛因。 咪达唑仑可产生抗焦虑、 镇静、 催眠、 抗惊厥及肌肉松弛的作用, 但也会使人产生谵妄、 幻觉等不良反应。 在巨大的商业利润驱动下, 这种化合物被一些不法分子秘密的合成及非法交易。 目前对咪达唑仑的检测方法主要有液相色谱法和气相色谱法[1-2]等。 虽然这些方法都能检测药物滥用及过量问题, 但是上述方法一般需要较繁琐的样品处理步骤和较长的检测时间, 并且需要大型的仪器设备, 因此研究一种现场、 快速、 低成本的检测方法具有十分重要的现实意义。
虽然常规拉曼光谱技术的信号较弱, 但是随着纳米技术的发展, 以金或银等贵金属纳米颗粒作为基底的表面增强拉曼光谱(SERS)技术克服了传统拉曼光谱信号弱的缺陷, 被广泛应用于食品药品安全检测及医学诊断领域[3-5]。 到目前为止, 虽然用其他方法检测过咪达唑仑, 但是无人用SERS技术检测过咪达唑仑, 本文基于SERS技术检测了水溶液、 尿液和血清中的咪达唑仑, 为现场快速检测打下了良好的基础。
1 实验部分
1.1 试剂与仪器
硝酸银(AgNO3, 国药集团化学试剂有限公司), 柠檬酸三钠(C6H5NaO7·H20, 国药集团化学试剂有限公司), 咪达唑仑注射液(C18H13ClFN3, 2 mL/10 mg/支, 江苏恩华药业股份有限公司), 人工尿液(创峰自动化科技有限公司)。 扫描电子显微镜(SU8010, 日本日立公司), 便携式拉曼光谱仪(BES415-785H, 必达泰克光电科技公司)。
1.2 银溶胶和样品的制备
银溶胶是SERS检测中最常使用的活性增强基底, 经典银溶胶的制备方法最早是1982年, 由Lee和Meisel等提出[6]。 该方法使用柠檬酸钠作为还原剂对硝酸银进行还原, 得到的银溶胶。 首先在250 mL水中加入45 mg硝酸银并加热至沸腾, 然后加入5 mL质量分数为1%的柠檬酸钠溶液。 全程充分搅拌, 维持沸腾状态1 h。 当溶液变为棕绿色时, 停止加热, 自然冷却至室温, 并且避光储存于4 ℃环境下, 备用。
咪达唑仑水溶液样品的制备: 用去离子水稀释咪达唑仑注射液注射液, 分别配置40, 20, 10, 8和6 μg·mL-1梯度质量浓度的咪达唑仑水溶液。
咪达唑仑尿液样品的制备: 按照文献[7]的方法, 将咪达唑仑注射液滴入人工尿液中, 配置浓度分别为125, 100, 80, 60, 40和20 μg·mL-1梯度质量浓度的尿液样品。 取80 μL该样品添加到1.5 mL的EP管中, 加入同体积浓度为1%的氢氧化钠(NaOH)水溶液以调节pH 11; 然后加入氯化钠(NaCl)固体, 使溶液充分饱和; 最后加入80 μL乙酸乙酯萃取, 静置一分钟取上层清液进行检测。
咪达唑仑血清样品的制备: 使用前将储存在-20 ℃的大鼠血清置于4 ℃冰箱解冻, 然后在室温下使之全溶。 按文献[8-10]的方法, 将血清样品用去离子水稀释至10%, 然后加入咪达唑仑标准液, 配置浓度为125, 100, 60, 40, 20和10 μg·mL-1的咪达唑仑溶液作为待测样品。
2 结果与讨论
2.1 银溶胶的表征
使用扫描电子显微镜(SEM), 对银溶胶的形态进行了表征, 如图1(a)所示。 银溶胶颗粒大小均匀, 形貌近似球形, 直径约为50 nm。 利用紫外-可见分光光度计对银溶胶的吸收特性进行了表征, 如图1(b)所示。 银溶胶的最大紫外吸收峰位于409 nm处, 且两侧对称, 半峰宽较窄, 说明银溶胶颗粒尺寸分布均匀, 具有良好的单分散性[11]。
2.2 咪达唑仑拉曼特征峰的归属
首先使用Gaussian view软件对咪达唑仑的分子结构进行优化[14], 如图2(a)所示。 然后通过Gaussian 09软件计算了咪达唑仑的拉曼特征峰, 使用混合密度泛函B3LYP, 基组为6-31G(d, p), 矫正因子为0.963。 获得的理论特征峰与实验特征峰, 如图2(b)所示。 咪达唑仑的理论与实验特征峰基本一致, 但是理论与实验之间有微小的偏移, 这是因为外部条件不同导致的。 实验特征峰主要分布在689, 735, 827, 1 045和1 167 cm-1等处, 表1列出了特征峰的振动模式。
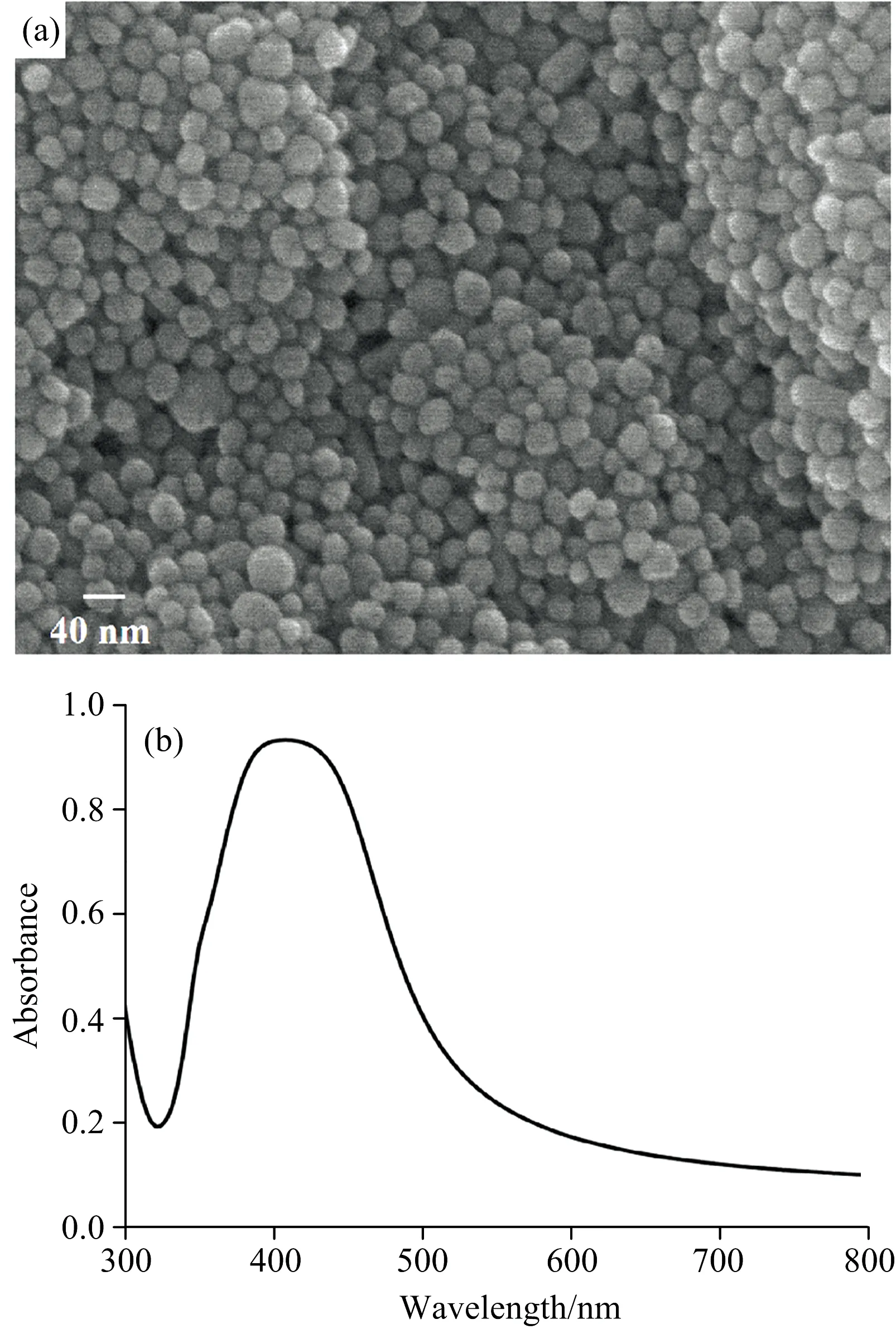
图1 (a)银溶胶的SEM图, (b)银溶胶的紫外可见光吸收光谱图

图2 (a)优化后的空间分子结构示意图, (b)咪达唑仑的理论光谱和SERS光谱
Fig.2 (a) Optimized spatial molecular structure of Midazolam, (b) Theoretical and SERS spectra of Midazolam
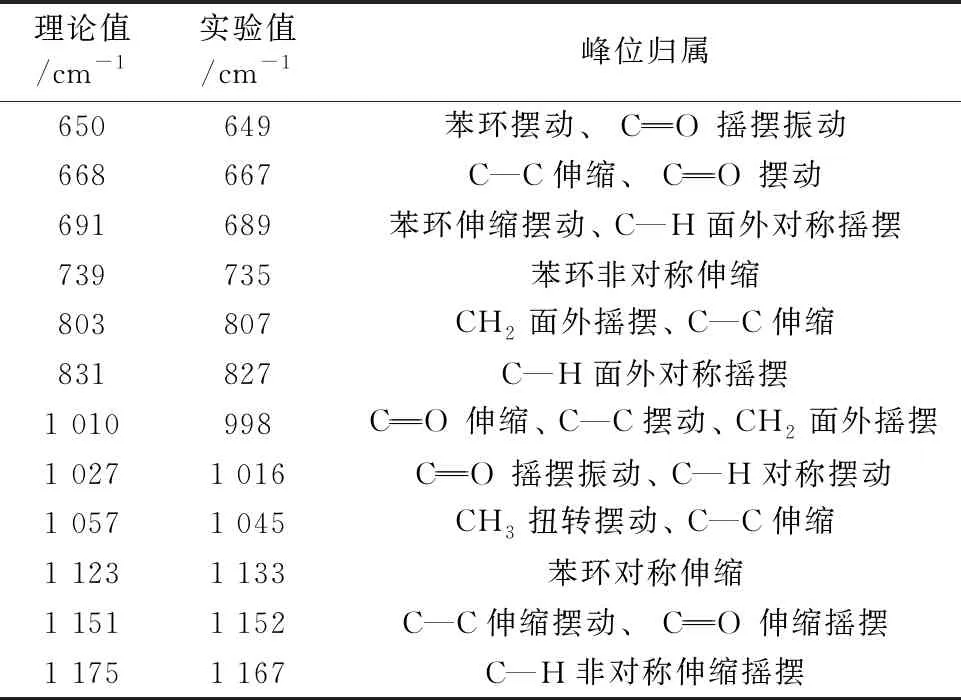
表1 咪达唑仑理论和实验振动频率
2.3 促凝剂的选取
在使用化学还原法合成银溶胶的过程中, 柠檬酸钠作为一种还原剂起到了至关重要的作用。 但是研究表明包裹在银纳米颗粒表面的柠檬酸根会阻止待测物对银纳米颗粒的吸附, 降低检测信号, 因此需要添加适量的无机盐来打破溶胶体系的电势平衡从而使溶胶颗粒聚集[13]。 为了研究不同种类促凝剂对咪达唑仑SERS增强效果的影响, 实验中选取硫酸钠(Na2SO4)、 硫酸镁(MgSO4)、 氯化钠(NaCl)、 碘化钾(KI)水溶液作为促凝剂, 进行了对比性的实验研究。 结果表明, 在相同浓度下, MgSO4水溶液的增强效率最高, 因此本实验中选取MgSO4水溶液作为促凝剂, 样品、 银溶胶和促凝剂的体积混合比均为5∶5∶1。
2.4 咪达唑仑水溶液的SERS检测
梯度浓度咪达唑仑水溶液的SERS光谱, 如图3(a)所示, 用空白水作为对照。 当浓度低至6 μg·mL-1时, 仍然观察到689 cm-1处的拉曼特征峰, 且满足检测下限大于等于3倍信噪比的要求, 因此对水溶液中咪达唑仑的检测限可以达到6 μg·mL-1。 通过对数据进行线性拟合, 得到曲线方程y=188.18x-743.05, 相关系数r=0.972, 如图3(b)所示。
为了验证该方法的可靠性, 配制了浓度分别为30, 15和7.5 μg·mL-1的咪达唑仑水溶液加标样品, 测定了咪达唑仑水溶液的浓度, 并以已知加标浓度的比值计算出了回收率及其相对标准偏差(RSD), 如表2所示。 从表2可知, 该方法的回收率在98.2%~107.2%之间, RSD在2.08%~3.25%之间。

图3 (a)梯度浓度咪达唑仑水溶液的SERS光谱, (b)特征峰强度随咪达唑仑水溶液浓度的变化曲线
Fig.3 (a) SERS spectra of Midazolam in aqueous solution with different concentration, (b) the relationship between the Raman signal intensity and Midazolam concentration in aqueous solution

表2 咪达唑仑水溶液的回收率及其相对标准偏差
2.5 尿液中咪达唑仑的检测
梯度浓度咪达唑仑尿液的SERS光谱, 如图4(a)所示, 用空白尿液作为对照。 当浓度低至20 μg·mL-1时, 仍然观察到689 cm-1处的拉曼特征峰, 且满足检测下限大于等于3倍信噪比的要求, 因此检测限可以达到20 μg·mL-1。 通过对数据进行线性拟合, 得到线性方程y=59.78x-640.71, 相关系数r=0.958, 如图4(b)所示。
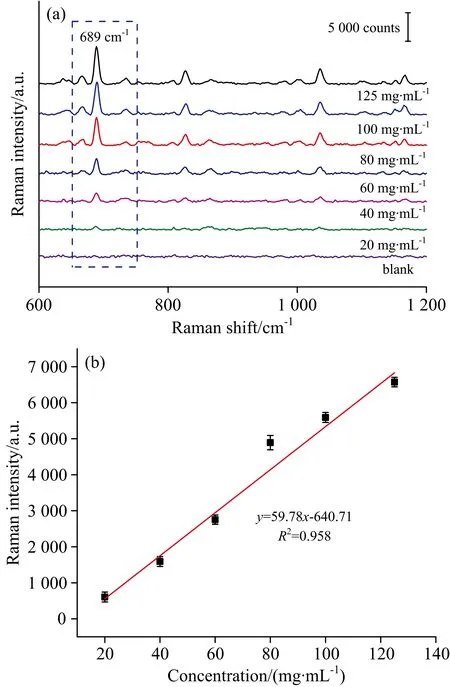
图4 (a)梯度浓度咪达唑仑尿液的SERS光谱, (b)特征峰强度随咪达唑仑尿液浓度的变化曲线
Fig.4 (a) SERS spectra of Midazolam in urine with different concentration, (b) the relationship between the Raman signal intensity and Midazolam concentration in urine
为了验证该方法的可靠性, 配制了浓度分别为120, 70和30 μg·mL-1的咪达唑仑尿液加标样品, 测定了咪达唑仑尿液的浓度, 并与已知加标浓度的比值计算出了回收率及其RSD, 如表3所列。 该方法的回收率在96.9%~107.9%之间, RSD在4.45%~5.75%之间。
2.6 血清中咪达唑仑的检测
梯度浓度咪达唑仑血清的SERS光谱, 如图5(a)所示, 用空白血清作为对照。 空白血清在689 cm-1附近也有个微小的拉曼峰, 为了排除血清对特征峰的干扰, 选取了827 cm-1处的特征峰进行了血清中咪达唑仑的检测。 当浓度低至20 μg·mL-1时, 仍然观察到827 cm-1处的拉曼特征峰, 且满足检测下限大于等于3倍信噪比的要求, 因此检测限可以达到20 μg·mL-1。 通过对数据进行线性拟合, 得到曲线方程y=30.81x+176.66, 相关系数r=0.963, 如图5(b)所示。
为了验证该方法的可靠性, 配制了浓度分别为125, 60和20 μg·mL-1咪达唑仑在血清中加标样品, 测定了咪达唑仑血清的浓度, 并与已知加标浓度的比值计算出了回收率及其RSD, 如表4所列。 该方法的回收率在94.2%~105.7%之间, RSD在3.60%~4.41%之间。
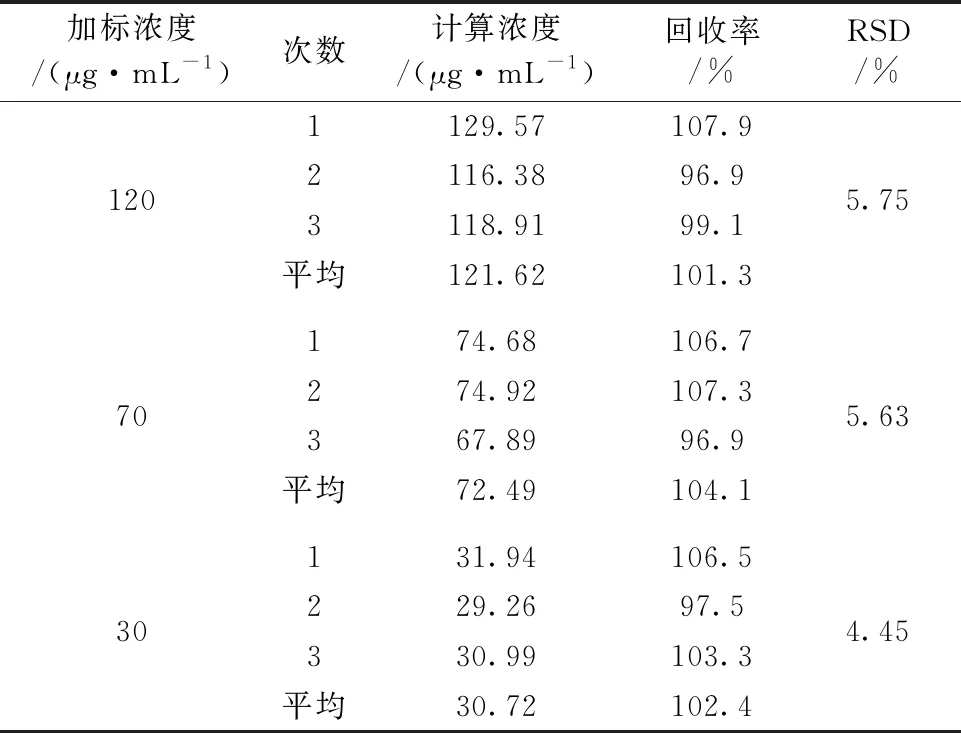
表3 咪达唑仑尿液样品的回收率及其相对标准偏差

图5 (a)梯度浓度咪达唑仑血清的SERS光谱, (b)特征峰强度随咪达唑仑血清浓度的变化曲线
Fig.5 (a) SERS spectra of Midazolam in serum with different concentration, (b) the relationship between the Raman signal intensity and Midazolam concentration in serum
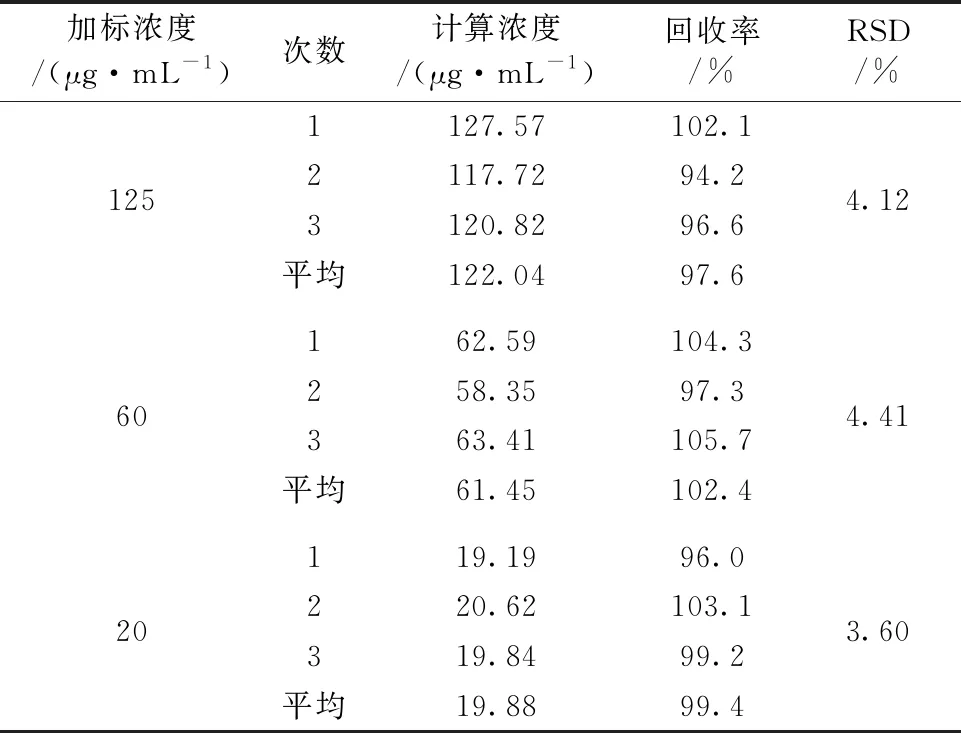
表4 咪达唑仑血清样品的回收率及其相对标准偏差
3 结 论
研究利用SERS技术快速检测咪达唑仑。 首先从理论和实验两个方面对咪达唑仑的拉曼特征峰进行了归属。 然后以银溶胶作为活性基底, MgSO4水溶液作为促凝剂, 分别选取689和827 cm-1处的拉曼峰作为特征峰, 对水溶液、 尿液和血清中的咪达唑仑进行了SERS检测。 获得了检测限、 拉曼特征峰强度随浓度的变化曲线方程及相关系数、 回收率及其相对标准误差。 该方法具有快速、 准确、 无损、 操作简便等优点, 为水溶液、 尿液和血清中咪达唑仑的现场快速检测奠定了良好的基础。

