S100钙结合蛋白A8在人慢性牙周炎牙龈组织巨噬细胞中表达的研究
刘利思,杨 婷,叶展鸿,孙 澎,王 刚,黄世光
S100钙结合蛋白A8(S100 calcium binding protein A8, S100A8)是S100蛋白家族的重要成员之一,主要由两个不同螺旋-环-螺旋(helix-loop-helix)配基手型(EF-hand,EF手型)组成的低分子量(10.8 ku)钙结合蛋白。S100A8通过对中性粒细胞的趋化作用、激活炎性细胞和炎性因子的产生、介导细胞内炎症信号转导等途径在炎症的发生、发展中发挥调节作用[1]。S100A8蛋白可特异性地表达于内皮细胞、表皮细胞及髓系细胞,因此又称为髓细胞相关蛋白-8(myeloid-related protein-8,MRP-8),其功能取决于机体在特定炎症环境中分泌的介质及参与其识别的受体等[2]。S100A8在通常情况下可通过钙离子依赖性方式与S100A9形成S100A8/S100A9异源性二聚体发挥其生物功能[3]。研究表明,在生理情况下S100A8/S100A9无炎症活性,但在脂多糖(lipopolysaccharide,LPS)等炎性因子的刺激下能诱导其炎症活性[4]。虽然异源性二聚体形式是钙卫蛋白最常见存在的形式,但其单体S100A8或S100A9也可独立存在并各自发挥其生物学功能[3]。在慢性牙周炎的发展过程中,细菌及其相应的代谢产物能够刺激巨噬细胞(macrophages, mø)活化,导致活化的mø分泌大量的促炎因子,在宿主免疫反应中发挥重要作用[4]。CD68是分布于细胞表面的分子量为110 ku的跨膜糖蛋白,在单核细胞表面较少,但向巨噬细胞转化后表达CD68,因此CD68是最常用于标记巨噬细胞的表面标记物[5-6]。以往研究主要聚集于钙卫蛋白二聚体的作用,而关于钙卫蛋白单体的研究报道较少。我们通过免疫荧光双染色(double immunofluorescence,DIF),观察每组不同炎症程度慢性牙周炎牙龈组织标本中CD68-S100A8双阳性细胞的表达情况,探讨CD68-S100A8双阳性细胞在慢性牙周炎中的作用。
1 资料与方法
1.1 一般资料
1.1.1 病例选择 2018年7月—2018年12月在中山市人民医院牙周科和口腔颌面外科门诊部就诊的自愿接受本研究的60例受试者,年龄16~65岁,其中男26例,平均年龄(29.00±14.57)岁;女34例,平均年龄(33.00±13.02)岁,患有糖尿病及其他系统性疾病者需排除。临床牙周炎患者选择的标准依据1999年美国牙周病学会公布的牙周病新分类指南[7]。实验符合人体试验委员会制定的伦理学标准并获得批准,所有受试者均签署知情同意书。
1.1.2 分组及取材 ①正常对照组20例(16~45岁):牙龈指数(gingival index,GI)=0,探诊深度(probing depth,PD)≤3 mm, X线片显示无牙槽骨吸收(图1A);②轻度牙周炎组20例(24~60岁):取自因需要接受临床牙冠延长术者,GI=1,PD≤4 mm,临床附着丧失(clinical attachment loss, CAL)为1~2 mm,X线片显示牙槽骨吸收≤根长1/3(图1B);③重度牙周炎组20例(31~65岁):取自无法保留或预后差的需拔牙的重度牙周炎患者,GI=3,PD>6 mm,CAL≥5 mm,X线片显示牙槽骨吸收>根长1/2,甚至达到根长的2/3,牙齿松动Ⅲ度(图1C)。各组间受试者年龄、性别无统计学差异。
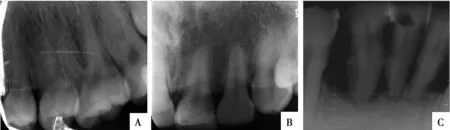
A:正常对照组;B:轻度牙周炎组;C:重度牙周炎组
图1 各组X线影像
Fig.1 X-ray images of each group
1.2 实验方法
1.2.1 组织标本的预备与处理 牙龈组织标本于4%多聚甲醛溶液中固定时间48 h以上,随后脱水、石蜡包埋,制成5 μm厚颊舌向牙龈组织连续切片用于后续染色。
1.2.2 苏木精-伊红染色法(hematoxylin-eosin staining,HE) 在光学显微镜下对牙龈组织进行观察。由2名病理医师进行盲法观察,参照Huang等[8]的炎症程度评分标准对牙龈组织的炎症细胞浸润情况进行评分,取平均值。0分:无炎症细胞浸润;1分:轻度,牙龈组织中局部见炎症细胞呈小灶状浸润;2分:中度,牙龈组织中见灶状及片状浸润的炎症细胞;3分:重度,牙龈组织中可见弥漫性浸润的炎症细胞。
1.2.3 S100A8-CD68双阳性细胞免疫荧光双染色 Ⅰ抗:CD68抗体(Abcam),稀释浓度为1∶100;S100A8抗体(北京博奥森),稀释浓度1∶200;Ⅱ抗:山羊抗小鼠鼠IgG(H+L)Alex Flour®555和山羊抗兔IgG(H+L) Alex Flour®488(cell signaling technology),稀释浓度1∶200。组织切片经脱蜡、复水,在修复盒经微波炉加热修复抗原;遮光条件下牛血清白蛋白(BSA)孵育、Ⅰ抗孵育、Ⅱ抗孵育行荧光染色,封片并立即在荧光显微镜下观察拍照。红色荧光为CD68阳性表达,绿色荧光为S100A8阳性表达,其定位于细胞质或细胞膜,同一视野mø与S100A8重叠后为橘黄色荧光,蓝色荧光信号表达为DAPI染出细胞核。染色切片置于荧光显微镜下,400倍下随机选取5个视野拍照,采用ImagePro Plus 6.0图像处理软件(美国Mdia Cybernetics)计算阳性细胞数。
1.3 统计学方法
计量数据用均数±标准差的形式表示,采用Spss 25.0软件进行统计分析处理。采用Kruskal-Wallis检验对各组牙龈组织炎症程度评分进行比较;采用完全随机设计单因素方差分析(one-way ANOVA)对3组标本的CD68-S100A8双阳性细胞数进行组间比较。设α=0.05为检验水准。
2 结 果
2.1 组织学观察结果
正常对照组结缔组织中罕见有炎症细胞浸润(图2A);轻度牙周炎组可见少量炎性细胞呈散在分布(图2B);重度牙周炎组见上皮钉突增生,固有层中炎症细胞大量聚集(图2C)。慢性牙周炎组的炎症程度评分显著高于正常对照组(P<0.05)(图3)。
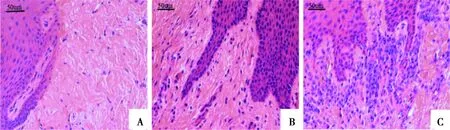
A:正常对照组;B:轻度牙周炎组;C:重度牙周炎组
图2 各组牙龈组织的组织学观察(HE染色 ×400)
Fig.2 Representative photomicrographs of human gingival tissues (HE staining ×400)
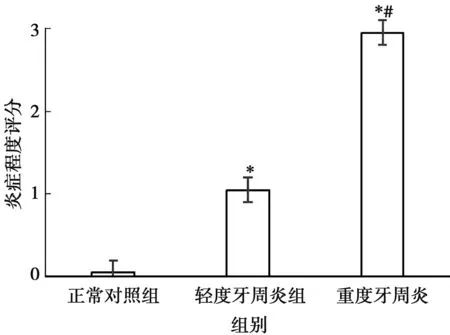
*:与正常对照组比较,P<0.05;#:与轻度牙周炎组比较,P<0.05
图3 各组牙龈组织炎症程度评分比较
Fig.3 Comparison of inflammatory scores of gingival tissues in each group
2.2 CD68和S100A8免疫荧光双染色结果
mø为CD68+,在3组标本中均可被检出,各组牙龈组织CD68-S100A8双阳性细胞免疫荧光双染色结果见图4。红色荧光信号表达是CD68(图4A、E、I),绿色荧光信号表达是S100A8(图4B、F、J),橘黄色荧光表达是在同一视野下红色荧光与绿色荧光重叠(图4D、H、L),细胞核显示为蓝色荧光(图4C、G、K)。正常对照组:CD68-S100A8双阳性mø在牙龈组织中少量散在分布(图4A、B、C、D);轻度牙周炎组:CD68-S100A8双阳性mø数量在牙龈组织中明显增加(图4E、F、G、H);重度牙周炎组:CD68-S100A8双阳性mø在牙龈组织中可见大量聚集(图4I、J、K、L);各组牙龈组织标本阴性对照未见荧光表达。
各组牙龈组织中,CD68-S100A8双阳性mø密度(个/mm2)见图5。3组标本阳性细胞数差异有统计学意义(F=57.074,P<0.05);牙周炎组中CD68-S100A8双阳性mø数量与正常对照组相比较明显上升(P<0.05);其中,重度牙周炎组CD68-S100A8双阳性mø数量显著多于轻度牙周炎组(P<0.05)。
3 讨 论
慢性牙周炎是牙周致病菌引起的感染性疾病。在牙周炎的进展中,牙周致病菌可直接损伤牙周组织,也可通过免疫炎症反应造成组织的损害。炎症过程中产生的细胞因子和酶类如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、基质金属蛋白酶(matrixmetalloproteinases,MMPs)等可造成牙槽骨的吸收和有机基质的降解[9]。研究发现在人慢性牙周炎牙龈组织中,有大量中性粒细胞、淋巴细胞及mø等炎症细胞浸润[10]。mø是一种具有吞噬杀伤功能的固有免疫细胞,也是存在于慢性牙周炎患者牙周组织中重要的炎症细胞之一[11]。牙周组织中的mø来源于血液中的单核细胞,作为炎症细胞在维持抗炎和促炎的免疫平衡中发挥重要作用,吞噬作用是防止细菌侵入牙周组织的一道防线,在防御的同时吞噬

A~D:正常对照组;E~H:轻度牙周炎组;I~L:重度牙周炎组。A、E、I为CD68+阳性染色;B、F、J为S100A8阳性染色;C、G、K为DAPI染色;D、H、L为CD68-S100A8双阳性mø荧光染色
图4 各组牙龈组织中CD68-S100A8双阳性mø观察(DIF染色 ×400)
Fig.4 Representative photomicrographs of CD68-S100A8 double positive mø in human gingival tissues (DIF staining ×400)
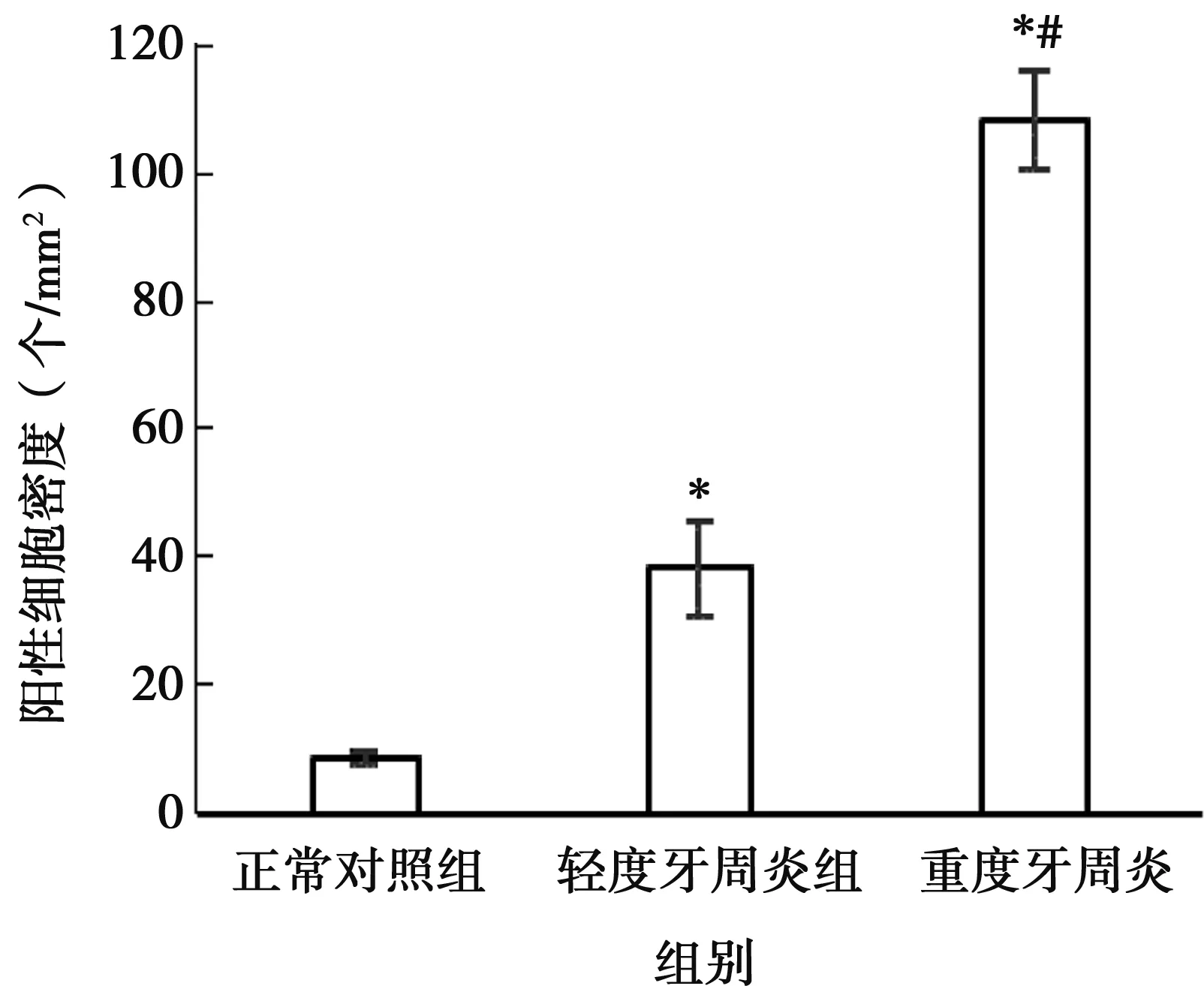
*:与正常对照组比较,P<0.05;#:与轻度牙周炎组比较,P<0.05
图5 各组牙龈组织标本中双阳性细胞密度的比较
Fig.5 Comparison of double positive cell density in gingival tissue of each group
细胞过度的免疫反应可能会破坏牙周组织导致附着丧失和牙槽骨吸收[12]。mø可由于组织内环境的改变和炎症因子的诱导产生不同类型的mø,根据表型和功能特征主要分为两种:经典活化的mø (classically activated macrophage,caMphi)即M1型和替代性活化的mø(alternative activated macrophages,aaMphi)即M2型[13]。研究发现在慢性牙周炎进程中,浸润在牙周组织中的mø主要为M1型,同时也观察到少量M2型,并可释放少量抗炎因子如白细胞介素-10(interleukin-10,IL-10),但其表达水平显著低于促炎因子,故M1型mø可能在牙周炎的发生发展中起主要作用[14]。CD68是单核细胞谱系、循环巨噬细胞和组织巨噬细胞中高度特异性表达的一种蛋白质,可作为巨噬细胞的标志。在炎症环境中炎性因子的驱化作用下,外周血中单核细胞迁移到感染组织分化为巨噬细胞参与炎症反应,导致局部CD68+水平升高[5-6]。实验以CD68+作为mø的标记,通过DIF发现CD68+的表达水平与牙周炎症程度正相关,提示巨噬细胞参与牙周炎症,其表达水平很大程度决定牙槽骨破坏的水平,结果与Radvar等[15]一致。
在炎症环境中,特定的上皮细胞、活化的中性粒细胞及mø可释放钙卫蛋白,钙卫蛋白被认为是炎症性疾病的标志物[16]。研究发现与牙周健康者比较,慢性牙周炎患者的唾液、牙龈组织、龈沟液及血清中钙卫蛋白(S100A8/S100A9)的表达增高,且单体S100A8和S100A9在牙周炎进展中发挥不同的生物学功能[17-18]。S100A8在调控炎症发展过程中具有抗炎和促炎双重调节作用,且被发现与侵袭性牙周炎个体易感性有关[19]。郑云飞等[20]通过细胞迁移侵袭实验技术及划痕法对牙周膜细胞迁移活性进行检测发现,在牙周炎活动期高浓度的S100A8可以抑制牙周膜细胞增殖并诱导其凋亡,从而参与组织破坏;在疾病后期或者经过牙周治疗后,较低浓度的S100A8却可以促进牙周膜细胞迁移,参与组织修复。在特定条件下如组织发生严重炎症时,释放到胞外的S100A8能刺激炎症细胞释放炎症因子如TNF-α、白细胞介素-6(interleukin-6,IL-6)、前列腺素E2(prostaglandin E2,PGE2)等,直接参与炎症疾病的过程并阻碍组织的恢复,加重炎症程度,同时又可通过活化Toll样受体4(Toll-like receptors, TLR4)以激活møFcγRI和FcγRIV受体的表达[21]。TLR4是在Toll样受体家族里最早被发现的成员之一,主要识别革兰阴性菌细胞壁的脂多糖结构,因此在以革兰阴性厌氧菌如牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)为主要致病菌的慢性牙周炎中发挥重要作用[22]。研究发现,在人牙龈成纤维细胞中TLR4可能是钙卫蛋白的主要靶受体,钙卫蛋白介导的TLR4信号在转录因子核因子κB (nuclear factor kappa-B,NF-κB)的激活中发挥重要作用[23]。查何[24]研究发现LPS和S100A8单独或共同刺激mø后TLR4受体的表达水平较对照组升高,其中LPS和S100A8共同刺激效果最明显,同时S100A8通过激活TLR4/ NF-κB信号通路,可促进mø分泌炎性因子IL-1β及TNF-α从而造成组织损伤。然而,Thorey等[25]研究发现,S100A8能通过清除氧化物,防止过度氧化对机体造成损伤以促进伤口愈合,发挥抗炎作用。Naruishi等[26]研究发现与S100A8相比,S100A9和钙卫蛋白二聚体可显著增加牙龈成纤维细胞中IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)和TNF-α的产生并参与牙周炎的炎症反应,提示S100A8的促炎作用可能相对较弱。但另有研究发现,在局部炎症部位,聚集的高浓度S100A8可导致组织修复延迟,表明S100A8可能产生促炎作用参与组织破坏,同时发现S100A9促炎作用并不明显[27]。本实验结果显示,慢性牙周炎牙龈组织中CD68-S100A8双阳性mø密度显著高于正常组,活化或被招募的mø迁移到炎症部位分泌S100A8,导致炎症局部S100A8水平升高,提示mø(CD68+)参与S100A8的激活及释放可直接造成牙周组织破坏并阻碍组织修复,从而促进牙周炎症进展。迄今为止,S100A8在慢性牙周炎具体的作用机制不详,仍有待进一步的研究。
本实验采用DIF,观察人不同炎症程度慢性牙周炎牙龈组织中S100A8在mø的表达情况,结果显示S100A8和mø在同一细胞共定位,进一步证实S100A8和mø关系密切。本研究发现,人慢性牙周炎牙龈组织的mø表达S100A8,重度牙周炎患者的牙龈组织中的 møS100A8的表达显著高于轻度牙周炎组,提示CD68-S100A8双阳性mø可能参与慢性牙周炎的免疫调节过程。我们的结果提示控制人慢性牙周炎组织中S100A8的合成或者调节mø的功能也许可成为阻止慢性牙周炎发展的一个新的途径。

