不同浓度血管内皮细胞生长因子对人牙周膜干细胞内皮向分化的影响
石 笑,赵寅华,赵 萤,程百祥,陈永进,张 旻
2004年Seo等[1]利用克隆筛选和免疫磁珠分离的方法分离获得了牙周膜干细胞(periodontal ligament stem cells, PDLSCs),并证实其具有高度自我更新能力和多向分化潜能,能够分化为牙周膜组织中具有特定功能的细胞群,包括成骨细胞、成纤维细胞和成牙骨质细胞,继而形成骨、成牙骨质及牙周膜纤维结构[1-6]。
对于牙齿撕脱性损伤来说,如何促进延迟再植脱位牙获得理想的牙周膜性愈合,一直以来都是该领域的研究热点与难点。本课题组在前期研究中发现,补充外源性PDLSCs能明显提高脱位再植牙牙周膜性愈合位点的数量,提示自体干细胞的移植可能会成为延迟再植脱位牙牙周损伤修复的新方向[7]。同时,我们还发现,经BrdU标记的外源性PDLSCs明显参与了新生牙周膜组织中毛细血管管壁的形成,且干细胞植入组中毛细血管的数量多于对照组[7]。上述现象进一步提示我们,PDLSCs的内皮向分化及血管的形成可能是其促进撕脱性损伤患牙牙周愈合的关键因素。
然而,为了得到PDLSCs内皮向分化诱导液的理想配比,给后续基于其内皮分化的一系列研究奠定基础,本研究拟采用含有不同浓度血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)的内皮向分化诱导液对人PDLSCs的分化效果进行对比研究,以期筛选出适宜的诱导液和诱导时间,为PDLSCs应用于牙周组织修复和再生提供实验依据和理论基础。
1 材料与方法
1.1 主要材料与仪器
1.1.1 主要材料 α-MEM(HyClone公司,美国),2.5 g/L胰酶(HyClone公司,美国),Ⅰ型胶原酶(Sigma公司,美国),胎牛血清(杭州四季青公司),青霉素 100 U/mL(Sigma,美国),链霉素 100 U/mL(Sigma,美国),MatrigelTM基质胶(BD,美国),血管内皮细胞生长因子(VEGF165,Cyagen,美国),碱性成纤维细胞生长因子(bFGF,Cyagen,美国),胰岛素样生长因子(IGF-1,Cyagen,美国),小鼠抗人血管性血友病因子(von Willebrand Factor, vWF)抗体(Abcam,美国),兔抗人血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor-2, VEGFR-2)抗体(Abcam,美国),兔抗人促血管生成素2(Angiopoietin 2, Ang2)抗体(Abcam,美国),兔抗人血管内皮生长因子A(VEGFA)抗体(Abcam,美国),兔抗人IGF-1抗体(Abcam,美国),cy3羊抗鼠IgG(Abcam,美国),Alexa Fluor 488羊抗兔IgG(Abcam,美国)。
1.1.2 主要仪器 离心机(Kubota2100,日本),超净工作台(YJ-87,苏州净化设备厂),二氧化碳恒温培养箱(ThermoForma,美国),倒置相差显微镜(Olympus,日本),照相系统(Canon 600D,日本),细胞超声破碎仪(Sun-ShineBio,中国),Bio-Rad垂直电泳系统(Bio-Rad公司,美国),激光共聚焦扫描显微镜(Olympus,日本)。
1.2 方法
1.2.1 PDLSCs的分离培养 选取完整拔除的健康成年人(20~30岁,性别不限)阻生智齿,立即置于4 ℃预冷的含双抗(100 U/mL青霉素;100 U/mL链霉素)无菌PBS缓冲液中,转移至实验室超净工作台内。采用细滴管吸取无菌PBS缓冲液反复冲洗牙根表面,去除牙面污物及牙根表面多余血液。采用11#无菌刀片,轻轻刮除根中1/3区域牙周膜组织,将组织块切割成大小约 1 mm3的组织块,连同PBS一起转移至离心管内,以800 r/min的速度离心5 min,弃上清;加入2 mL Ⅰ型胶原酶,置于37 ℃培养箱内消化15 min;加入2~3 mL 含10% 胎牛血清(FBS)的α-MEM培养液终止消化反应,以800 r/min的速度再次离心5 min,弃上清;加入2~3滴培养液,重悬组织块后,将其平铺于培养瓶,加入20 mL 15% FBS的α-MEM培养液,于37 ℃、5% CO2培养箱中培养,每3 d换液1次。待细胞从组织块边缘爬出并生长汇合达90%时,采用免疫磁珠法分选牙周膜干细胞,并用含15% FBS的α-MEM培养液培养,2 d换液1次,细胞生长至80%左右时按1∶2传代培养。
1.2.2 PDLSCs内皮向分化诱导 取生长状态良好的P3 PDLSCs,经2.5 g/L胰酶消化,以1×105个/孔的密度接种于6孔板,共接种12个6孔板。依照培养液的不同,将上述细胞分为4组,对照组(含10%FBS的α-MEM)、低浓度组(10 ng/mL VEGF + 10 ng/mL bFGF + 2 ng/mL IGF-1)、中浓度组(20 ng/mL VEGF + 10 ng/mL bFGF + 2 ng/mL IGF-1)及高浓度组(50 ng/mL VEGF + 10 ng/mL bFGF + 2 ng/mL IGF-1),每组3个6孔板。将细胞置于37 ℃、5%CO2孵箱中培养,每3 d换液1次,诱导7、14 和21 d后分别进行检测。
1.2.3 内皮向分化诱导的PDLSCs细胞形态学观察 取出诱导14 d的对照组、低浓度组、中浓度组、高浓度组细胞,在倒置相差显微镜下进行细胞形态观察,并在不同倍率下拍照记录。
1.2.4 内皮向分化诱导的PDLSCs基质胶管腔形成实验 MatrigelTM胶4 ℃过夜冻融,低温条件下将其置于预冷的24孔板内,每孔200 μL。将24孔板转移至培养箱中孵育30 min,待胶体凝固。分别消化诱导7、14及21 d的各组细胞,调整细胞密度至2×105个/mL,将细胞悬液以每孔200 μL的量加入MatrigelTM基质胶内,37 ℃、5%CO2孵箱中培养。13 h后采用倒置显微镜观察细胞管腔形成情况,每孔均选择3个高倍视野进行拍照。采用 Image J分析软件测量血管样结构的管腔数及总管腔长度。
1.2.5 内皮向分化诱导的PDLSCs免疫荧光染色 分别取诱导7 d 的4组细胞,调整细胞密度至2×104个/mL,分vWF和VEGFR-2两组接种于共聚焦小皿中,4%多聚甲醛固定10 min,PBS洗3遍,每次5 min;在vWF组中加入200 μL 1% Triton X-100孵育10 min,PBS洗3遍,每次5 min;1%的BSA封闭液室温封闭1 h后,弃BSA封闭液,PBS洗3遍,每次5 min;分别加小鼠抗人vWF一抗和兔抗人VEGFR-2一抗,放入湿盒中封闭3 h后,PBS洗3遍,每次5 min;分别加入cy3羊抗鼠IgG二抗和Alexa Fluor 488羊抗兔IgG二抗,避光封闭1 h后,PBS洗3遍,每次5 min;DAPI染核封片后,于激光共聚焦扫描显微镜下观察。诱导14 d和21 d后的细胞也采用同样方法进行免疫荧光染色。
1.2.6 内皮向分化诱导的PDLSCs Western blotting检测 使用细胞裂解液裂解诱导7 d 的4组细胞,提取其总蛋白,在10% SDS-PAGE胶中电泳,将蛋白转膜至PVDF膜上,5%脱脂奶粉封闭2 h后,分别加入VEGFR-2(1∶800)、Ang2(1∶5 000)、VEGFA(1∶3 000)、IGF-1(1∶3 000)、vimentin(1∶500)、GAPDH(1∶7 000)一抗,4 ℃过夜保存,第2天取出膜,PBST漂洗3遍,每次 5 min,分别加入羊抗鼠IgG和羊抗兔IgG二抗反应,室温摇动孵育2 h,PBST漂洗,化学发光法(ECL)显影,暗室曝光。
1.3 统计学方法
2 结 果
2.1 PDLSCs形态学观察
人牙周膜组织块培养2~5 d后,可见形态呈长梭形的细胞自组织块爬出,并快速增殖;培养10~12 d后,组织块周围可见大量细胞呈放射状生长(图1A)。采用免疫磁珠法分离培养,可以获得呈克隆化生长的牙周膜干细胞(图1B),细胞呈长梭形单核细胞,胞体丰满,胞质均匀,核为卵圆形,大多聚集在胞质中心,胞质形成的突起向外呈放射状,似成纤维样细胞(图1C)。
2.2 诱导后细胞形态观察
加入不同浓度诱导液后,细胞形态逐渐发生变化,对照组细胞呈长梭形或多角形(图2A);低浓度VEGF组细胞变圆润,呈短梭形,少量细胞呈扁圆形或圆形(图2B);中浓度VEGF组细胞大部分呈扁圆形或圆形,少量细胞呈短梭形(图2C);高浓度VEGF组细胞基本呈扁圆形或圆形,呈铺路石样排列(图2D)。

图1 牙周膜干细胞分离培养(倒置相差显微镜,A、B: ×100,C: ×1 000)Fig.1 Isolation and culture of periodontal ligament stem cells (inverted phase contrast microscope,A,B: ×100,C: ×1 000)

A:对照组;B:低浓度组;C:中浓度组;D:高浓度组
图2 不同浓度内皮向分化诱导液作用后牙周膜干细胞形态学改变(倒置相差显微镜 ×100)
Fig.2 The morphological changes of periodontal ligament stem cells by induced fluid of endothelial differentiation of different concentrations (inverted phase contrast microscope ×100)
2.3 诱导后PDLSCs成血管能力检测
诱导后的PDLSCs经Matrigel胶体外三维立体培养13 h后,倒置显微镜下观察可见:未经诱导的对照组PDLSCs均不能形成完整的管腔样结构,细胞均呈散在分布;而经内皮向分化诱导的各组PDLSCs均可伸出突起并互相连接,形成类似血管的管腔样结构,其中,以高浓度VEGF组形成的管腔样结构最为典型,且诱导14 d及21 d组明显优于诱导7 d组(图3A)。对典型视野下的图片采用ImageJ软件进行分析,PDLSCs在Matrigel胶内形成的管腔数目以及管腔长度均明显增加(P<0.05)(图3B)。
2.4 诱导后对PDLSCs vWF和VEGFR-2表达的影响
免疫荧光染色结果显示,诱导7 d组中的诱导组细胞与未诱导的对照组细胞相比,诱导组细胞中内皮细胞标记物vWF和VEGFR-2的表达无显著增强(图4A),诱导14 d和21 d组中的诱导组细胞较对照组细胞有显著增强,且随着诱导液浓度升高,强度逐渐递增(图4B、C),因此可以得出,高浓度诱导液表达效果最好,且诱导14 d和21 d的效果较明显(P<0.01)(图4D)。
A:诱导后牙周膜干细胞;B:诱导后管腔数和总管腔长度分析;*:vs.对照组(7 d)P<0.05;#:vs.高浓度组P<0.05
图3 不同浓度内皮向分化诱导液作用后牙周膜干细胞体外成血管能力
Fig.3 The ability of periodontal ligament stem cells to form blood vesselsinvitroby induced fluid of endothelial differentiation of different concentrations
2.5 诱导后对PDLSCs内皮细胞相关蛋白表达的影响
在免疫印迹试验中,7 d 组中Ang2、VEGFR-2、VEGFA、IGF-1的诱导组都有所上调,vimentin逐渐下降(P<0.05)(图5A);14 d组中,VEGFR-2的诱导组都有明显上调,Ang2和IGF-1的高浓度组有所上调,VEGFA无明显上调,vimentin都有所下调(P<0.05)(图5B);21 d组中,Ang2、VEGFR-2、VEGFA、IGF-1的诱导组都有所上调,vimentin的诱导组都有所下调,且VEGFR-2和Ang2的高浓度组上调效果和vimentin的高浓度组下调效果较明显(P<0.05)(图5C)。
3 讨 论
良好的血供是任何组织修复和再生的关键,同样,牙周膜血管微循环的建立与运行与牙周组织功能状态密切相关[8-10]。对于牙周组织中所有微血管完全断裂的脱位牙来说,牙周微循环的重建对牙周膜的愈合尤为重要,而诱导PDLSCs向内皮细胞分化并外源性移植可能正是促进牙周膜血运重建而成为促脱位再植牙达到牙周膜性愈合的关键因素之一。
在血管发生过程中,最根本最重要的是血管内皮细胞的存在,而外源性植入干细胞的血管内皮向分化则是血管发生的一个重要步骤。有研究发现,VEGF是间充质干细胞或造血干细胞向血管内皮细胞分化的重要条件[11-12],而VEGFR-2是内皮细胞生长的早期表面受体,主要出现在内皮细胞诱导转化的早期[13-15],这也是内皮向分化诱导的条件培养基中添加VEGF和bFGF的根本原因。研究发现,VEGF能特异性促内皮细胞迁移、增殖及形成管腔样结构[16], 而 bFGF对VEGF具有非特异性促增殖作用,与VEGF产生协同效应,能够促进骨髓间充质干细胞分化为内皮细胞和形成小管样结构,对体外诱导骨髓间充质干细胞或胚胎干细胞分化为内皮细胞具有重要的作用[17]。干细胞分化为内皮细胞后,VEGF又可以诱导内皮细胞发生血管新生,而这一过程是由 RhoA/ROCK信号通路参与介导的[18-19],VEGF能迅速诱导内皮细胞中RhoA激活,RhoA从胞质转位到细胞膜上,紧随RhoA激活之后,VEGFR-2的酪氨酸残基磷酸化,血管新生增强[18,20]。

A:诱导后7 d;B:诱导后14 d;C:诱导后21 d;D:VEGFR-2和vWF的光密度值;*:vs. 对照组(7 d)P<0.01
图4 不同浓度内皮向分化诱导液作用后牙周膜干细胞免疫荧光染色
Fig.4 Immunofluorescence of periodontal ligament stem cells by induced fluid of endothelial differentiation of different concentrations
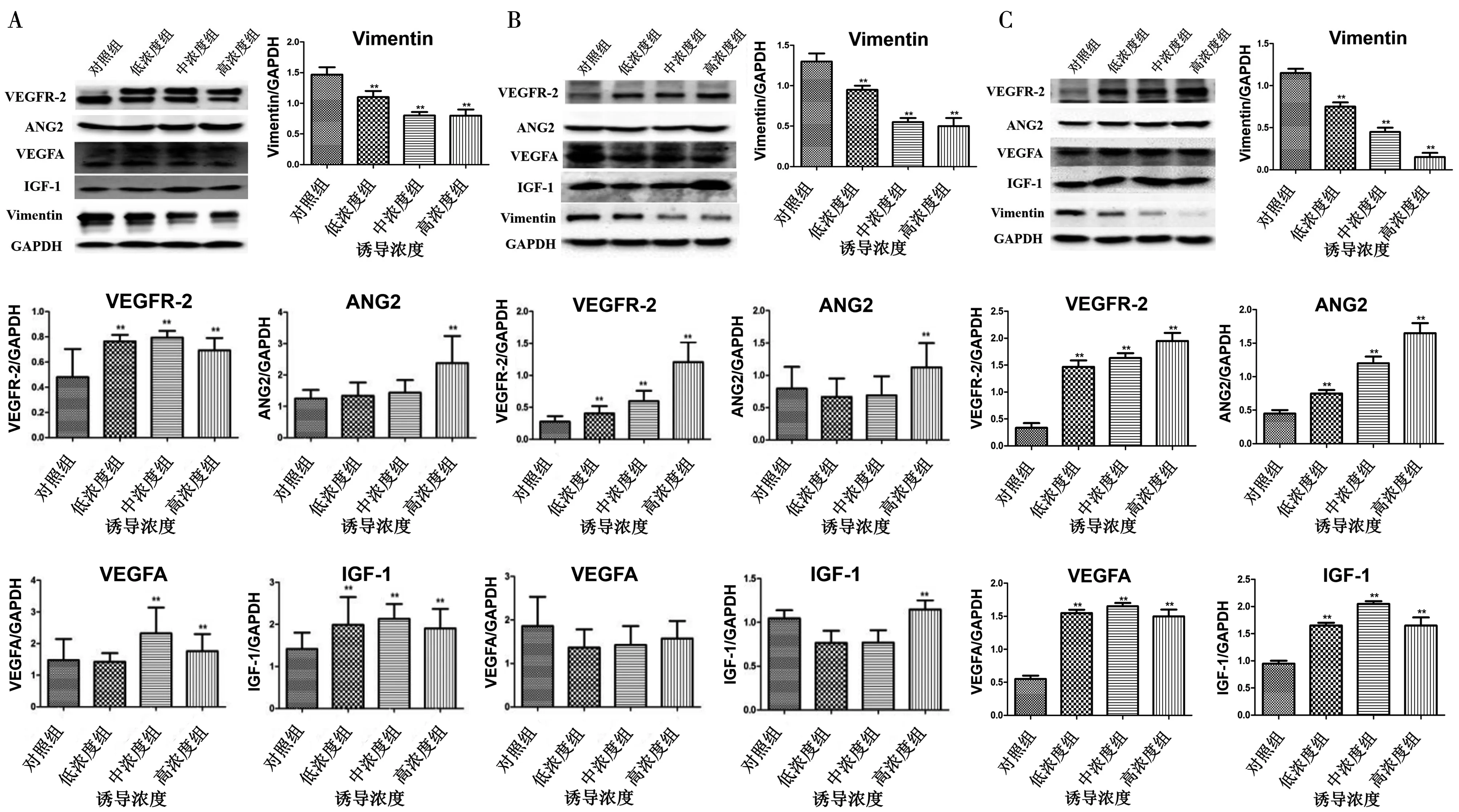
A:诱导后7 d;B:诱导后14 d;C:诱导后21 d;**:vs. 对照组P<0.05
图5 不同浓度内皮向分化诱导液作用后牙周膜干细胞蛋白表达
Fig.5 Protein expression of periodontal ligament stem cells by induced fluid of endothelial differentiation of different concentrations
因此,在本研究中,我们通过从离体牙中获得牙周膜组织,并培养得到牙周膜细胞,进一步分选获得牙周膜干细胞培养传代到第3代,用3种含不同浓度VEGF的内皮向分化诱导液对PDLSCs进行诱导,通过7、14、21 d的诱导后,分别对其进行细胞形态学、体外成血管能力、免疫荧光染色和Western blotting的检测,进而观察不同浓度VEGF对人牙周膜干细胞向内皮细胞诱导分化的影响。
实验结果显示,从细胞形态学上观察,可以看到在不同浓度诱导液的诱导下,牙周膜干细胞不同程度地向内皮向分化,且高浓度诱导液的诱导效果相对较好;通过对诱导的牙周膜干细胞进行血管形成实验,发现诱导组与未诱导组都有成血管效果,而高浓度组的效果最为显著,并且诱导14和21 d的效果较好;诱导细胞进行免疫荧光染色,7 d组内皮细胞相关蛋白VEGFR-2和vWF没有明显变化,14 d组和21 d组都有所上调,高浓度组的表达效果最好;在免疫印迹实验中,Ang2、VEGFR-2、VEGFA、IGF-1 的诱导组都有所上调,vimentin的诱导组都有所下降,且高浓度组效果较显著。根据上述结果,我们可以得出结论:高浓度组:50 ng/mL VEGF、10 ng/mL bFGF和2 ng/mL IGF-1的诱导液诱导效果明显,且14和21 d的诱导效果较好,为通过牙周膜干细胞向内皮细胞分化在延迟脱位再植牙牙周微循环重建中的应用提供了理论依据。然而,牙周微循环重建是多因素影响的复杂生物过程,牙周膜干细胞向内皮细胞诱导分化后移植入体内并对牙周膜愈合的作用如何还有待进一步的研究。

