百合分子生物学研究进展
方洁 潘俊杰 程科军 吕群丹
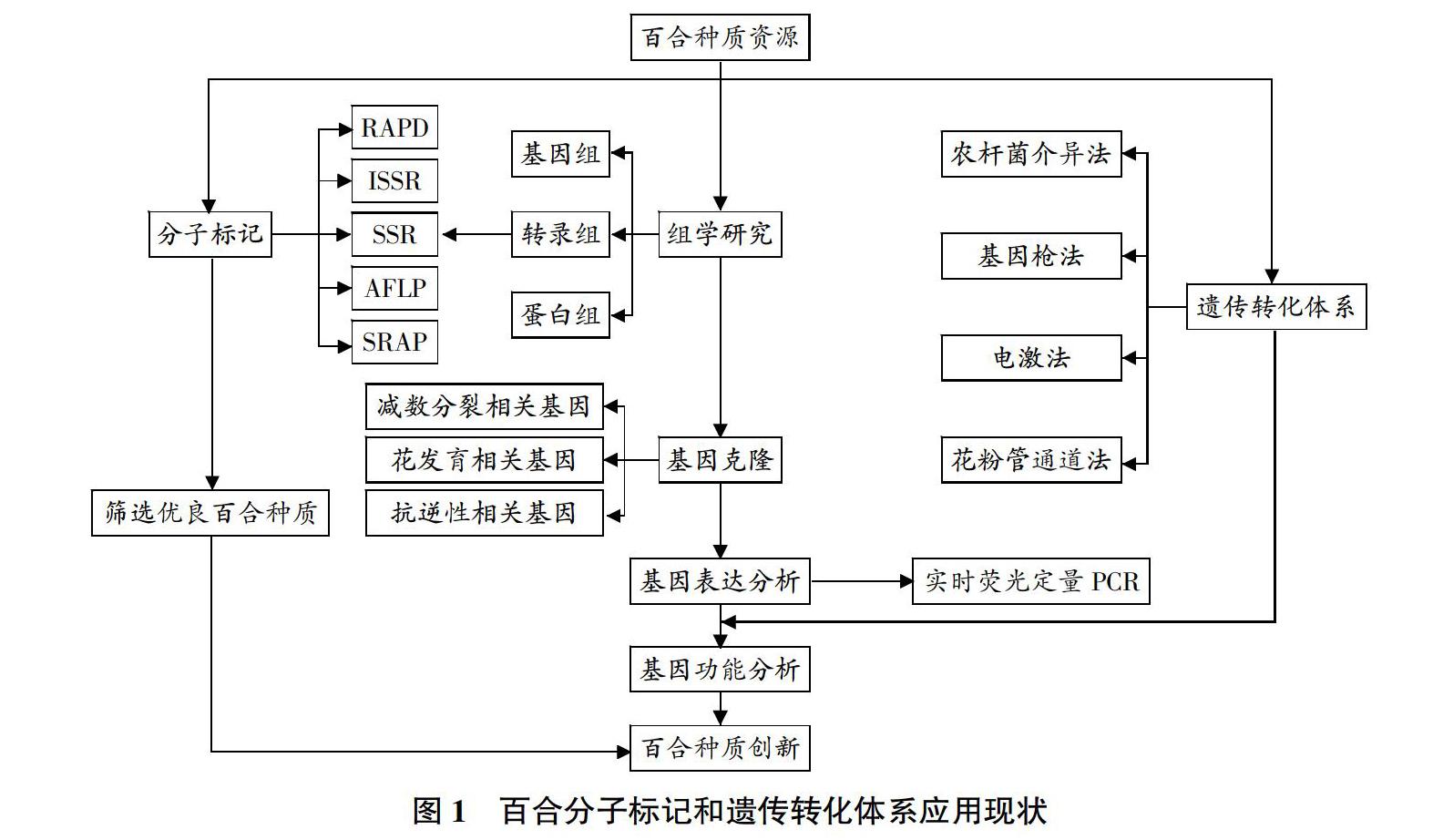

摘要 综述了百合分子生物学的研究进展,主要包括4个方面,即百合基因组学、转录组学和蛋白组学的研究;百合遗传多样性分析和5种分子标记(RAPD、ISSR、SSR、AFLP、SRAP)的开发和利用;百合遗传转化体系的构建,包括农杆菌介导法、基因枪法、电激法和花粉管介导法;百合减数分裂基因、花发育基因及抗逆性相关基因的克隆和表达分析。最后指出了当前研究存在的问题,并展望了进一步研究的方向。
关键词 百合;分子标记;遗传转化;基因克隆
中图分类号 S644.1 文献标识码 A
文章编号 1007-5739(2020)12-0069-05 開放科学(资源服务)标识码(OSID)
A Review on Molecular Biology of Lily
FANG Jie PAN Jun-jie CHENG Ke-jun LV Qun-dan *
(Lishui Institute of Agriculture and Forestry Sciences, Lishui Zhejiang 323000)
Abstract This paper reviewed the following four aspects in lily molecular biology: research progresses of lily genomics, transcriptomics and proteomics; the development and utilization of five types of molecular markers including RAPD, ISSR, SSR, AFLP and SRAP in lily genetic diversity analysis; construction of lily transformation system including Agrobacterium mediated method, gene gun bombardment method, electroporation method and pollen tube pathway method; cloning and expression analysis of genes related to meiosis, flower development and stress resistance. Finally, the current research defects and prospects of lily molecular biology were summarized.
Key words lily; molecular marker; genetic transfomation; gene cloning
百合属(Lilium)植物属于百合科(Liliaeeae)多年生球根植物,集药用、食用及观赏于一体,具有极大的商业价值。我国是世界百合起源的中心,资源最为丰富,早在1 400多年前就有人工栽培的记载[1]。2015年版《中国药典》中收载的百合为卷丹(Lilium lancifolium Thunb.)、百合(Lilium brownii F.E.Brown var. viridulum Baker)及细叶百合(Lilium pumilum DC.)的干燥肉质鳞叶,具有养阴润肺、清心安神的功效[2],是常用的中药处方配伍药材。近年来,越来越多的学者从分子生物学层面上研究百合的生长发育和遗传进化,以期为百合种质改良和高效栽培提供技术支持。基于此,本文对百合分子生物学的研究进展进行了总结,分析了当前存在的问题及今后的研究方向,为百合分子育种和优质新品种的获得奠定了基础。
1 百合遗传物质解析
1.1 基因组学研究
百合的全基因组数据十分庞大(1C=36 Gb)[3],约为水稻的80倍[4],其重复序列较多,给测序及后续的组装工作带来了极大的难度,至今仍无法实现全基因组测序。
百合的叶绿体基因组大小通常处于120~170 kb之间,相对较为容易。先前已对青岛百合[5]、垂花百合[6]、东北百合[7]和麝香百合[8]等的完整叶绿体基因组进行测序。随后Kim等[9]对条叶百合、卷丹和朝鲜百合等的叶绿体基因组进行全测序,利用这4个新的叶绿体基因组与之前的已知序列进行比较,详细描述了叶绿体基因组的特征,并鉴定出13个功能领域中的112个基因。
毕彧[10]对10个百合属的物种进行了完整叶绿体基因组测序,鉴定了113个不同的基因。联合搜索到的6个百合属叶绿体基因组,分析结构特征,发现所有的基因排序顺序一致,未发生基因重新排列现象;并且具有丰富的AT含量。利用生物信息学技术,鉴定出1 043个SSR位点及ycf1b、ycf1a、trn S-trn G、trn E-trn T-psb D等10个高变区域,可用于百合属叶绿体基因组分子标记的开发。
1.2 转录组学研究
针对于不同的研究目的,目前已有不少关于百合属转录组学的报道。作为深入开发百合SSR标记的重要方法和分析百合属植物进化历程的重要工具,最初是Shahin等[3]开展了百合属及郁金香属的转录组学研究,发现113个共有的SNP及292个EST-SSRs。随后研究者通过岷江百合转录组测序来开发EST-SSR标记,鉴定出1 716个SSR位点,并对其中的494个位点进行了验证[11]。Du等[12]通过对百合索尔邦6个组织进行转录组测序,挖掘出1 853个SSRs,并在32个百合基因型中进一步鉴定57个EST-SSR,其中有30个为功能已知基因。Biswas等[13]也同样利用转录组的SSR信息来开发分子标记。
除了分子标记挖掘,转录组学主要还应用于花粉管发育[14]、花色形成[15]、鳞茎发生[16]和打破休眠[17]等方面。为了研究百合花色形成分子调控机制,Yang等[16]对百合Sorbonne进行了转录组研究,揭示了156个编码类黄酮生物合成途径关键酶的基因,并发现百合Sorbonne花的颜色形成主要受黄酮类生物合成途径的控制[15]。利用组织学和转录组技术研究卷丹鳞茎的形成过程,发现卷丹的鳞茎从叶柄基部正面的腋下分生组织处启动,淀粉的合成和积累可能会促进卷丹鳞茎的形成,生长素可能促进鳞茎的生成并进一步抑制其形成,细胞分裂素的高合成和低降解率可能会导致上部叶腋的形成。Huang等[17]研究了亚洲百合‘Ting ghost春化过程中的差异基因,利用qRT-PCR初步验证了6个与春化过程相关的基因表达量,并进一步验证了VRN1和VRN2这2个控制春化的基因。
1.3 蛋白组学研究
百合蛋白组学的研究报道相对较少。张 洁等[18]利用蛋白质双向电泳技术分析百合小鳞茎抽薹前后的蛋白组表达差异,得到差异表达蛋白点21个。经研究发现,在百合抽薹过程中,主要是参与能量代谢、分子伴侣及胁迫诱导蛋白质的表达量受到调控,主要为抽薹过程准备能量,重新合成储能物质,并应对低温春化的生理反应。张艺萍等[19]以百合抗病和感病无性系为试验材料,开展了百合抗尖孢镰刀菌枯萎病的蛋白组学研究,鉴定得到25个差异蛋白质点,其中10个为未知功能的蛋白,其余15个可分为防御反应、光合作用、糖类及能量代谢相关蛋白和热激蛋白4类。
2 百合分子标记和遗传多样性分析
分子标记是研究DNA分子由于缺失、插入、易位、倒位或由于存在长短与排列不一的重复序列等机制而产生多态性的技术。与传统的形态标记相比,分子标记具有信息量大、不易受外界环境影响、重复性好等优点,应用于遗传多样性分析、资源评价、遗传图谱构建及种间亲缘关系等方面[20]。目前,已在百合中应用的分子标记技术主要有随机扩增多态性DNA(RAPD)、简单重复序列区间(ISSR)、扩增片段长度多态性(AFLP)、简单重复序列(SSR)、相关序列扩增多态性(SRAP)等技术(表1)。
最早是Lee等[21]利用RAPD技术对韩国的百合进行了分组。随后Yamagishi等[22]和Persson等[23]采用RAPD标记分析了百合属植物的种和种间杂种及欧洲百合种群间遗传变异及群体间亲缘关系。对青岛百合复合种群中6个局部种群的遗传多样性开展了RAPD分析后,发现其多样性指标与样地的基本情况具有较强的相关性[24]。同时,研究发现RAPD也可用来区分百合栽培品种和野生种[25]。
在百合遗传多样性研究中运用较多的另一种分子标记为ISSR。Guo等[26]通过ISSR分子标记和形态学特征分析,发现青岛百合具有较高的遺传多样性,其形态学特征和遗传参数之间也存在较高的相关性。研究人员通过表型性状、花粉形态和ISSR分子标记技术共同分析遗传多样性和百合种间的亲缘关系,发现野生百合的遗传多样性高于栽培种[27]。肖 伟等[28]利用ISSR分子标记技术,对7个百合杂种系96个品种之间的遗传多样性和亲缘关系进行了研究,最终将这7个百合杂种系分为两大类。
其他的百合分子标记(AFLP、SSR和SRAP)报道较少。最初,Heusden等[29]运用AFLP建立了亚洲百合的连锁图,同时结合了BSA方法对百合抗Fusarium及抗TBV的基因进行了QTLs定位。柯贤锋等[30]和雷家军等[31]分别建立并优化了野百合和卷丹百合的AFLP反应体系,有利于开展遗传多样性的研究。相对而言,百合SSR标记的开发较晚。杨素丽等[32]基于EST信息建立了百合SSR标记。徐雷锋等[33]利用20对SSR引物检测到69个SSR等位位点和170个带型,平均每对引物扩增3.45个等位位点、8.50个带型。目前,利用SRAP分子标记仅对百合部分种及品种进行鉴定和遗传多样性研究[34]。
在遗传多样性研究中,也有涉及2种分子标记技术的研究。Yamagishi等[35]通过对亚洲百合进行RAPD和ISSR分析,多次试验后均获得相同的指纹图谱,表明这2种分析方法都具有较高的稳定性。Arzate-Fern等[36]利用ISSR和cpDNA RFLP标记对日本境内的濒危植物L. maculatum Thunb. var.bukosanense的2个群体进行了遗传距离的计算,结果显示这2个群体遗传距离接近。迄今为止,大量的分子标记应用于百合的遗传多样性研究中,但其分子标记的高效利用受到了百合未知基因组的制约。
3 百合遗传转化体系构建
百合遗传转化体系的构建目前采用的方法主要有农杆菌介导法、基因枪法、电激法和花粉管通道法。农杆菌介导法是指将目的基因插入经改造的T-DNA区,通过农杆菌侵染植物伤口,从而实现外源基因向植物细胞的转移与整合。由于单子叶植物不是农杆菌的天然寄主,限制了农杆菌介导法在百合属植物上的应用。最初是Cohen等[37]将根癌农杆菌与鳞块切段共培养后,在愈伤组织中检测到外源基因的表达。Langeveld等[38]在1995年通过将百合“Harmony”试管苗茎尖和农杆菌的共培养首次证明单子叶百合属也可以成为农杆菌的寄主。直到2003年Mercuri等[39]首次利用根癌农杆菌LBA4404将Rol基因转至长花百合愈伤组织,成功培育出转基因百合,转化率约为0.5%。田菲菲等[40]将农杆菌介导的ACO-RNAi载体转化至百合的胚性愈伤,通过优化超声波等转化条件,瞬时表达率和稳定表达率最高可达到88.90%和27.33%。虽然可以利用农杆菌介导法进行转化,但遗传转化效率低,制约了百合转基因育种的发展。
基因枪法是指利用高压将带有目的基因的微小金粒或钨粒高速射入受体细胞,使目的基因进入细胞并整合到染色体组。Nishihara等[41]利用基因枪法将GUS基因导入百合花粉,并通过组织化学染色法检测到GUS的瞬时表达。Van der Leedge-Plegt等[42]用基因枪法将NTPⅡ基因导入百合花粉,授粉杂交后得到3株阳性植株,PCR检测显示外源基因已整合到百合植物中。Irifune等[43]也用该方法将编码PAT的基因导入百合鳞茎分化出的愈伤组织,并获得具有除草剂抗性的转基因再生植株。师守国等[44]以兰州百合鳞片为受体,转入DHAR基因的转化率可达到1.5%。
电激法是指利用高压电脉冲作用,在原生质体膜上穿孔从而促进外源DNA进入的转导方法。Miyoshi等[45]利用电激法将GUS基因导入百合的原生质体,得到瞬时表达。Wu等[46]将GUS和GFP基因直接导入百合,并在鳞片组织中发现瞬时表达。由于百合原生质体的再生体系不完善,鲜有这方面的文献报道。
花粉管通道法是利用花粉作为外源DNA的媒介,直接通过授粉受精获得转基因种子。杜捷[47]利用花粉管通道法将其他百合品种的总DNA转至兰州百合中,发现滴加的DNA溶液中性,浓度为50 μg/mL时结实率较高。李 双等[48]选择常规授粉后0 h涂抹携带外源基因的菌液,获得种子后检测发现外源基因成功整合到百合基因组中。
4 百合功能基因的克隆和机理研究
目前,克隆基因的方法主要分为2类,对新基因的克隆常用插入片段标签法和图位克隆法;对已知基因的克隆通常采用同源基因克隆法和筛选文库法。百合上克隆的基因一般利用同源基因克隆法或筛选文库法获得,主要包括减数分裂、花发育和抗逆性相关基因。
4.1 百合减数分裂相关基因
减数分裂是真核生物有性生殖过程中的关键环节,不仅可保证生物种染色体数稳定,也可使物种适应不同环境变化时不断进化。由于麝香百合雄性配子体(小孢子细胞和花粉粒)亲缘性强,花药内孢子细胞间同步发育,几十年来一直被用来研究减数分裂[49]。最早是Kobayashi等[50]从麝香百合中分离出18个与减数分裂相关的cDNA片段。这些片段被命名为LIM基因,其中LIM15基因与已知基因RecA、RAD57和DMC1/ISC2相似,其产物与百合减数分裂的染色体联会和重组有关[51-52]。
2003年,Morohashi等[53]发现,麝香百合的LISCL基因主要在减数分裂前期的花药中表达,且与减数分裂相关基因的启动子活性密切相关。同年,Morita等[54]在研究转基因水稻的转座子标记系统时,利用百合减数分裂基因的启动子LIM10和LIM18指导GUS基因在花药和体细胞内表达。Mu等[55]构建了百合花粉母细胞发育不同阶段的花药EST文库,发现文库中的LimHSP16.45可能作为分子伴侣保护花粉母细胞和绒毡层细胞在减数分裂前期免受极端温度的影响。
4.2 百合花发育相关基因
4.2.1 百合花型相关基因。Tzeng等[56]以麝香百合为材料,通过同源基因克隆法得到百合的LMADS1基因。百合的LMADS1基因与拟南芥的AP3类基因高度同源,但表达模式不完全相同,同时酵母双杂试验和转基因拟南芥的表型表明了LMADS1-MADS能与拟南芥的PI蛋白互作形成异源二聚体,使其不能有效调节下游基因,推测LMADS1可能代表B功能基因的一种祖先形式,保留了在百合花瓣和雄蕊发育中形成同源二聚体的能力。而LMADS1的C端区域对B功能蛋白同源二聚体的形成起着重要的作用[57]。随后,TZeng等[58-59]以相同的方法在麝香百合中克隆得到LMADS2、LMADS3和LMADS4基因。LMADS2基因主要在胚珠表达,在柱头中有微弱表达。转基因拟南芥表现出提早开花,不确定性减少花序,通过诱导萼片同源转化为心皮状结构,可观察到柱头乳突和胚珠。此外,第二轮花瓣转化为雄蕊状结构。可见,LMADS2是百合的D功能基因。LMAD3和LMAD4是百合的2个SEP基因,推测为E基因,在花分生组织、花芽生长各个阶段、花器官中都有表达,其中LMADS4基因还在花序组织和叶片中表达。
Benedito等[60]通过筛选麝香百合发育中花芽的cDNA文库,得到LLAG1基因,该基因与单子叶植物的AG基因高度同源,仅在雄蕊和心皮中表达,构成ABC模型的C结构域。吴小萍等[61]克隆得到LLGLO1基因,通过RT-PCR检测,该基因在百合花器官、心皮和茎中均有表达,且随着心皮的发育成熟,其表達强度逐渐增加。该基因在百合第一轮花器官中的表达量变化支持了van Tunen对ABC模型的修正[62]。隋娟娟等[63]利用RACE法从重瓣百合中克隆得到LiSEP3基因,发现该基因属于E类基因,主要在花中表达,在最内侧的花瓣中表达量最高,与双子叶植物花中SEP3基因的表达模式不同。
4.2.2 百合花色相关基因。花青苷是植物种主要的花色素,查尔酮合成酶(chalcone synthase,CHS)是花青苷合成途径的限速酶,目前关于百合查尔酮合成酶基因的研究报道较多。Nakatsuka等[64]从亚洲百合中克隆了3个CHS基因和1个DFR基因,在花青苷着色的部位有表达,表明这几个基因都参与了花青苷的生成。杨 丽等[65]从东方百合中分离到1个查尔酮合成酶基因,命名为Ychs-1。化占勇[66]为了研究百合查尔酮合成酶基因(LCHS2)对花色的调控影响,利用RNA干扰技术转化矮牵牛,发现转基因植株中出现了镶嵌型、马赛克型和中间型这3种花色类别,并且花青苷的含量也降低了。
Yamagishi等[67]从亚洲百合上分离到2个与花青苷合成相关的基因——LhMYB6和LhMYB12,研究发现,这2个基因可与LhbHLH2蛋白相互作用,通过共同表达来激活花青苷合成基因的转录。通过在百合鳞茎上过表达也表明LhMYB6和LhMYB12基因正调控花青苷的生物合成,并决定了花青苷在器官和组织中的特异性积累。
[9] KIM J H,LEE S I,KIM B R,et al.Chloroplast genomes of Lilium lancifolium,L. amabile,L. callosum,and L. philadelphicum:molecular characterization and their use in phylogenetic analysis in the genus Lilium and other allied genera in the order Liliales[J].PloS one,2017,12(10):e0186788.
[10] 畢彧.百合属的比较叶绿体基因组学研究[D].长春:吉林农业大学,2017.
[11] YUAN Suxia,GE Liang,LIU Chun,et al.The development of EST-SSR markers in Lilium regale and their cross-amplification in related species[J].Euphytica,2013,189(3):393-419.
[12] DU F,WU Y,ZHANG L,et al.De Novo assembled transcriptome analysis and SSR marker development of a mixture of six tissues from Lilium oriental hybrid‘Sorbonne[J].Plant Molecular Biology Reporter,2014, 33(2):281-293.
[13] BISWAS M K,NATH U K,HOWLADER J,et al.Exploration and explo-itation of novel SSR markers for candidate transcription factor genes in Lilium species[J].Genes,2018,9(2):97.
[14] OBERMEYER G,FRAGNER L,LANG V,et al.Dynamic adaption of metabolic pathways during germination and growth of lily pollen tubes after inhibition of the electron transport chain[J].Plant Physiology,2013,162(4):1822-1833.
[15] ZHANG M F,JIANG L M,ZHANG D M,et al.De novo transcriptome characterization of Lilium ′Sorbonne′ and key enzymes related to the flavonoid biosynthesis[J].Molecular Genetics and Genomics:MGG,2015,290(1):399-412.
[16] YANG P,XU L,XU H,et al.Histological and transcriptomic analysis during bulbil formation in Lilium lancifolium[J].Frontiers in Plant Scie-nce,2017,8:1508.
[17] HUANG J,LIU X,WANG J,et al.Transcriptomic analysis of Asiatic lily in the process of vernalization via RNA-seq[J].Molecular Biology Reports,2014,41(6):3839-3852.
[18] 张洁,游向阳,郭文杰,等.百合小鳞茎抽薹的差异蛋白质组学分析[J].西南农业学报,2016,29(6):1414-1419.
[19] 张艺萍,瞿素萍,杨秀梅,等.百合抗病无性系抗枯萎病的蛋白质组学分析[J].园艺学报,2018,45(3):530-540.
[20] SANTIAGO-VALENT N E,FRANCISCO-ORTEGA J.Plant evolution and biodiversity in the caribbean islands-perspectives from molecular markers[J].Botanical Review,2008,74(1):1-4.
[21] LEE W B.An application of random amplified polymorphic DNA(RAPD)to systematics of some species of Lilium in Korea[J].Korean Journal of Plant Taxonomy,1993,23(2):35.
[22] YAMAGISHI M.Detection of section-specific random amplified polym-orphic DNA(RAPD)markers in Lilium[J].Theoretical and Applied Genetics,1995,91(6/7):830-835.
[23] PERSSON H A,LUNDQUIST K,NYBOM H.RAPD Analysis of genetic variation within and among populations of Turk′s-cap Lily(Lilium martagon L.)[J].Hereditas,2010,128(3):213-220.
[24] 张聪敏,张治国.青岛百合复合种群遗传多样性的RAPD分析[J].湖北农业科学,2014,53(13):3074-3077.
[25] 左志锐,穆鼎,高俊平,等.百合遗传多样性及亲缘关系的RAPD分析[J].园艺学报,2005,32(3):468-472.
[26] GUO W,JEONG J,KIM Z,et al.Genetic diversity of Lilium tsingtauense in China and Korea revealed by ISSR markers and morphological characters[J].Biochemical Systematics & Ecology,2011,39(4/5/6):352-360.
[27] WANG J M,MA S L,LI W Q,et al.Genetic variability and diversity of the main resources of lily assessed via phenotypic characters,pollen morphology,and ISSR markers[J].Genetics and Molecular Research:GMR,2016,15(2):1-14.
[28] 肖伟,张铭芳,贾桂霞,等.百合不同杂种系品种遗传多样性的ISSR分析[J].分子植物育种,2019(18):17.
[29] HEUSDEN V A W,TUYL V J M,MES J J.Molecular assisted breeding for disease resistance in lily[J].Acta Horticulturae,2002,572:131-138.
[30] 柯贤锋,智丽,眭顺照,等.野百合AFLP反应体系的建立及优化[J].西南大学学报(自然科学版),2007,29(12):100-103.
[31] 雷家军,于海涛,王志刚,等.卷丹百合AFLP反应体系的建立与优化[J].东北农业大学学报,2013,44(10):122-127.
[32] 杨素丽,明军,刘春,等.基于EST信息的百合SSR标记的建立[J].园艺学报,2008,35(7):1069-1074.
[33] 徐雷锋,葛亮,袁素霞,等.利用荧光标记SSR构建百合种质资源分子身份证[J].园艺学报,2014,41(10):2055-2064.
[34] 智丽,滕中华,刘旭,等.通江百合天然群体遗传多样性的SRAP分析[J].中国中药杂志,2011,36(14):1921-1926.
[35] YAMAGISHI M,ABE H,NAKANO M,et al.PCR-based molecular ma-rkers in Asiatic hybrid lily[J].Scientia Horticulturae,2002,96(1):225-234.
[36] ARZATE-FERN NDEZ A M,MIWA M,SHIMADA T,et al.Genetic diversity of Miyamasukashi-yuri(Lilium maculatum Thunb. var. bukosa-nense),an endemic and endangered species at Mount Buko,Saitama,Japan[J].Plant Species Biology,2010,20(1):57-65.
[37] COHEN A,P.M C,AGROBACTERIUM.Agrobacterium-mediated tran-sformation of Lilium[J].Acta Horticulturae,1992,325:611–618.
[38] LANGEVELD S A,GERRITS M M,DERKS A F L M,et al.Transforma-tion of lily by Agrobacterium[J].Euphytica,1995,85(1/2/3):97-100.
[39] MERCURI A,BENEDETTI L D,BRUNA S,et al.Agrobacterium-medi-ated transformation with rol genes of Lilium longiflorum Thunb[J].Acta Horticulturae,2003,612(612):129-136.
[40] 田菲菲,劉雅莉,杜灵娟,等.农杆菌介导的ACO-RNAi载体对百合胚性愈伤的转化[J].西北农林科技大学学报(自然科学版),2015,43(3):105-112.
[41] NISHIHARA M,ITO M,TANAKA I,et al.Expression of the [beta]-glucuronidase gene in pollen of lily(Lilium longiflorum),tobacco(Nicotiana tabacum),Nicotiana rustica,and peony(Paeonia lactiflora)by particle bombardment[J].Plant Physiology,1993,102(2):357-361.
[42] VAN DER LEEDGE-PLEGT L M,VEN B C E K,FRANKEN J,et al.Transgenic lilies via pollen-mediated transformation[J].Acta Horticultu-rae,1997,430:529-530.
[43] IRIFUNE K,MORIMOTO Y,UCHIHAMA M.Production of herbicide resistant transgenic lily plants by particle bombardment[J].J Japan Soc Hort Sci,2003,72(6):511-516.
[44] 師守国,梁东,王顺才,等.兰州百合基因枪转化方法的研究[J].西北植物学报,2010,30(4):645-651.
[45] MIYOSHI H,USAMI T .High level of GUS gene expression driven by pollen-specific promoters in electroporated lily pollen protoplasts[J].Sexual Plant Reproduction,1995,8(4):205-209.
[46] WU F S,FENG T Y.Delivery of plasmid DNA into intact plant cells by electroporation of plasmolyzed cells[J].Plant Cell Reports,1999,18(5):381-386.
[47] 杜捷.兰州百合外源DNA花粉管通道法导入的初步研究[D].西安:西北师范大学,2003.
[48] 李双,袁霖,贾桂霞.百合花粉管通道法遗传转化的研究[J].黑龙江农业科学,2011(8):15-18.
[49] HOTTA Y,TABATA S,STUBBS L,et al.Meiosis-specific transcripts of a DNA component replicated during chromosome pairing:homology across the phylogenetic spectrum[J].Cell,1985,40(4):785-793.
[50] KOBAYASHI T,KOBAYASHI E,SATO S,et al.Characterization of cDNAs induced in meiotic prophase in lily microsporocytes[J].DNA Research,1994,1(1):15-26.
[51] HOTTA Y,FURUKAWA K,TABATA S.Meiosis specific transcription and functional proteins[J].Advances in Biophysics,1995,31:101-115.
[52] TERASAWA M,SHINOHARA A,HOTTA Y,et al.Localization of RecA-like recombination proteins on chromosomes of the lily at various meiotic stages[J].Genes & Development,1995,9(8):925-934.
[53] MOROHASHI K,MINAMI M,TAKASE H,et al.Isolation and characte-rization of a novel GRAS gene that regulates meiosis-associated gene expression[J].The Journal of Biological Chemistry,2003,278(23):20865-20873.
[54] MORITA R,HATTORI Y,YOKOI S,et al.Assessment of utility of meiosis-associated promoters of lily for induction of germinal ds transp-osition in transgenic rice[J].Plant & Cell Physiology,2003,44(6):637-642.
[55] MU C,WANG S,ZHANG S,et al.Small heat shock protein LimHSP16.45 protects pollen mother cells and tapetal cells against extreme temperat-ures during late zygotene to pachytene stages of meiotic prophase I in David lily[J].Plant Cell Reports,2011,30(10):1981-1989.
[56] TZENG T Y,YANG C H.A MADS box gene from lily(Lilium longiflorum)is sufficient to generate dominant negative mutation by interacting with PISTILLATA(PI)in Arabidopsis thaliana[J].Plant & Cell Physiology,2001,42(10):1156-1168.
[57] TZENG T Y,LIU H C,YANG C H.The C-terminal sequence of LMADS1 is essential for the formation of homodimers for B function proteins[J].The Journal of Biological Chemistry,2004,279(11):10747-10755.
[58] TZENG T Y,CHEN H Y,YANG C H.Ectopic expression of carpel-specific MADS box genes from lily and lisianthus causes similar homeotic conversion of sepal and petal in Arabidopsis[J].Plant Physiology,2002,130(4):1827-1836.
[59] TZENG T Y,HSIAO C C,CHI P J,et al.Two lily SEPALLATA-like genes cause different effects on floral formation and floral transition in Arabidopsis[J].Plant Physiology,2003,133(3):1091-1101.
[60] BENEDITO V A,VISSER P B,VAN TUYL J M,et al.Ectopic expressi-on of LLAG1,an AGAMOUS homologue from lily(Lilium longiflorum Thunb.)causes floral homeotic modifications in Arabidopsis[J].Journal of Experimental Botany,2004,55(401):1391-1399.
[61] 吴小萍,席梦丽,施季森.麝香百合LLGLO1基因的克隆和表达[J].植物生理学通讯,2006,42(5):871-876.
[62] TUNEN A J V.Floral organogenesis in Tulipa[J].Flowering Newsl,1993,16:33-38.
[63] 隋娟娟,李晓昕,杨秋燕,等.重瓣百合LiSEP3基因克隆与表达分析[J].南京林业大学学报(自然科学版),2017,41(1):42-48.
[64] AKIRA NAKATSUKA,YOKO IZUMI,YAMAGISHI M.Spatial and te-mporal expression of chalcone synthase and dihydroflavonol 4-reductase genes in the Asiatic hybrid lily[J].Plant Science,2003,165(4):759-767.
[65] 杨丽,刘雅莉,王跃进,等.百合查尔酮合成酶(CHS)基因的克隆与分析[J].西北植物学报,2006,26(5):933-936.
[66] 化占勇.百合查尔酮合成酶(CHS)基因对花色调控影响的研究[D].杨凌:西北农林科技大学,2010.
[67] YAMAGISHI M,SHIMOYAMADA Y,NAKATSUKA T,et al.Two R2R3-MYB genes,homologs of Petunia AN2,regulate anthocyanin biosyntheses in flower Tepals,tepal spots and leaves of asiatic hybrid lily[J].Plant & Cell Physiology,2010,51(3):463-474.
[68] NGUYEN THI LAM HAI1,JUN-ICHIRO MASUDA,IKUO MIYAJIMA,et al.Involvement of carotenoid cleavage dioxygenase 4 gene in tepal color change in Lilium brownii var. colchesteri[J].Engei Gakkai Zasshi,2012,81(4):366-373.
[69] YANG C Y,CHEN Y C,JAUH G Y,et al.A lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in Arabidopsis[J].Plant Physiology,2005,139(2):836-846.
[70] YANG C Y,WU C H,JAUH G Y,et al.The LLA23 protein translocates into nuclei shortly before desiccation in developing pollen grains and regulates gene expression in Arabidopsis[J].Protoplasma,2008,233(3/4):241-254.
[71] HSU Y F,YU S C,YANG C Y,et al.Lily ASR protein-conferred cold and freezing resistance in Arabidopsis[J].Plant Physiology and Biochem-istry:PPB,2011,49(9):937-945.
[72] 陳莉,辛海波,李晓艳,等.百合MDHAR基因的克隆与表达分析[J].林业科学,2010,46(9):178-181.
[73] 闫笑,魏迟,张冬梅,等.百合P5CS-F129A基因的遗传稳定性和耐旱性检测[J].北京林业大学学报,2018,40(2):98-105.

