血清COMP、COL10A1、P Ⅱ ANP在骨关节炎诊断及病情评估中的意义
王东旭 闵继康 李恒
[摘要] 目的 探討血清软骨寡聚基质蛋白(COMP)、X型胶原α1链(COL10A1)、ⅡA型前胶原氨基端肽(PⅡ ANP)在骨关节炎诊断及病情评估中的意义。 方法 选取2017年3月~2018年8月期间本院收治的85例膝骨关节炎患者为研究对象,设为OA组。选取同期健康受试者85例作为对照组。统计并比较两组受试者血清中COMP、COL10A1、PⅡ ANP水平。比较不同病情分级、不同VAS评分的OA组患者血清中COMP、COL10A1、PⅡ ANP水平。对血清COMP、COL10A1、PⅡ ANP水平与Pettersson评分进行直线相关性分析。 结果 OA组血清中COMP、COL10A1水平均明显高于对照组,PⅡ ANP水平均明显低于对照组,差异有统计学意义(P<0.05)。不同病情分级、疼痛程度的骨关节炎患者血清中的COMP、COL10A1、PⅡ ANP水平存在明显统计学差异(P<0.05)。病情分级越高、疼痛越严重,血清中的COMP、COL10A1水平越高,PⅡ ANP水平越低,差异有统计学意义(P<0.05)。相关性分析结果显示,血清COMP、COL10A1水平与Pettersson评分呈显著正相关(P<0.05),血清PⅡ ANP水平与Pettersson评分呈显著负相关(P<0.05)。 结论 血清COMP、COL10A1、P Ⅱ ANP可反映骨关节炎患者的骨与软骨损伤情况。
[关键词] 软骨寡聚基质蛋白;X型胶原α1链;ⅡA型前胶原氨基端肽;骨关节炎
[中图分类号] R684.3 [文献标识码] A [文章编号] 1673-9701(2020)12-0018-04
[Abstract] Objective To investigate the significance of serum cartilage oligomeric matrix protein(COMP), type X collagen α1 chain(COL10A1), and type ⅡA procollagen amino terminal peptide(PⅡ ANP) in the diagnosis and evaluation of osteoarthritis. Methods A total of 85 patients with knee osteoarthritis who were treated in our hospital from March 2017 to August 2018 were selected as the study subjects and set as the group OA. 85 healthy subjects in the same period were selected as the control group. The serum levels of COMP, COL10A1, and PⅡ ANP were calculated and compared between the two groups of subjects. The serum levels of COMP, COL10A1, and PⅡ ANP in OA patients with different disease grades and different VAS scores were compared. Linear correlation analysis was performed on serum COMP, COL10A1, PⅡ ANP levels and Pettersson score. Results The serum levels of COMP and COL10A1 in the group OA were significantly higher than those in the control group, and the level of PⅡ ANP was significantly lower than that in the control group, and the difference was statistically significant(P<0.05). There are statistically significant differences in the levels of COMP, COL10A1, and PⅡ ANP in the serum of osteoarthritis patients with different disease grades and pain levels. The higher the disease grade and the more severe the pain, the higher the levels of COMP and COL10A1 in the serum and the lower the level of PⅡ ANP, and the difference was statistically significant(P<0.05). Correlation analysis showed that serum COMP and COL10A1 levels were significantly positively correlated with Pettersson score(P<0.05), and serum PⅡ ANP level was significantly negatively correlated with Pettersson score(P<0.05). Conclusion Serum COMP, COL10A1, and PⅡ ANP can reflect the bone and cartilage damage in patients with osteoarthritis.
[Key words] Cartilage oligomeric matrix protein; Type X collagen α1 chain; Type ⅡA procollagen amino terminal peptide; Osteoarthritis
骨关节炎病因复杂,病理变化涉及多种组织结构,包括滑膜、肌肉、肌腱、软骨、骨膜等[1]。采用某种特殊生物学标志物来监测骨关节炎患者骨与软骨的合成与退变,是探索骨关节炎早期诊断方法的主要途径。通常情况下,临床通过某些炎症因子(如C反应蛋白)等来监测骨关节炎的发生与发展,但单纯依靠炎症指标不能准确地反映出关节软骨的破坏程度。有部分骨关节炎患者血清中炎性标志物水平较低,但组织学方面骨与软骨的破坏却较为严重[2]。软骨寡聚基质蛋白(COMP)为软骨基质成分中的非蛋白聚糖成分[3],X型胶原α1链(COL10A1)为软骨基质成分中的胶原蛋白成分[4],ⅡA型前胶原氨基端肽(PⅡ ANP)是软骨基质成分中ⅡA型胶原蛋白合成过程中的特异性标志物[5]。本研究分析血清COMP、COL10A1、PⅡ ANP水平在骨关节炎诊断及病情评估中的意义。
1 资料与方法
1.1 一般资料
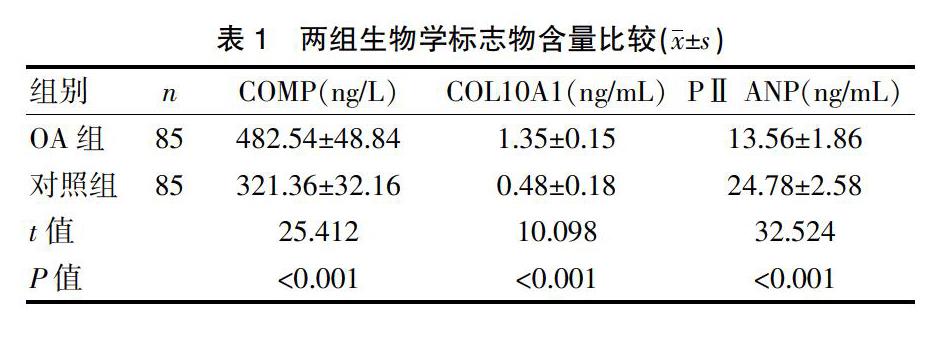
选取2017年3月~2018年8月期间本院收治的85例膝骨关节炎患者为研究对象,设为OA组。其中男40例,女45例;年龄18~84岁,平均(56.8±15.8)岁。诊断标准:均符合中华医学会风湿病学会制定的骨关节炎诊断标准[6]。排除标准:患有其他类型关节病变的患者;感染患者;肿瘤患者;严重肝肾疾病;严重心血管疾病;既往膝关节严重创伤者。采用倾向性评分匹配的方法,对受试者的性别和年龄进行匹配,选取同期健康受试者85例作为对照组,男40例,女45例;年龄20~80岁,平均(55.8±14.5)岁。两组性别、年龄无显著差异(P>0.05)。本研究入組患者均自愿签署知情同意书,且本研究经我院伦理委员会批准同意。
1.2 方法
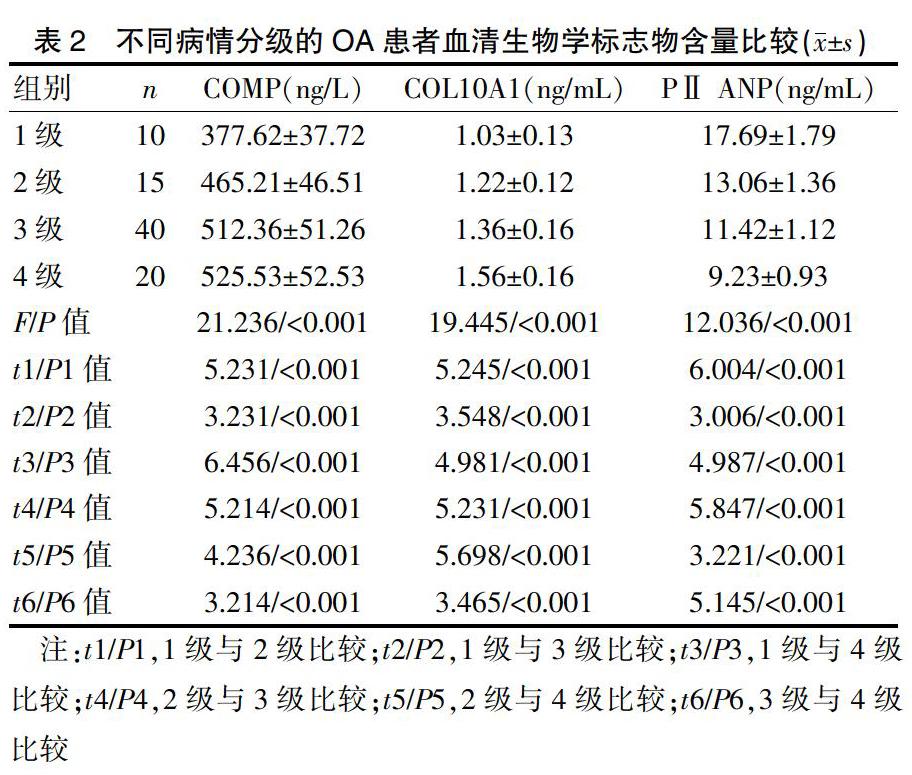
1.2.1 影像学检查 对OA组患者进行X线检查,根据Kellgren法[7]将骨关节炎按照病情分为0~4级,级别越高表明关节间隙越狭窄,关节畸形越明显。0级为正常;1级为关节间隙可疑变窄,可能唇状增生;2级为有明显的骨赘,软骨下骨板粗糙、密度不均或软骨唇样突起,关节间隙可疑变窄;3级为中等量骨赘,关节间隙变窄较明显,有硬化性改变,骨关节面下囊肿呈圆形或卵圆形;4级为大量骨赘,关节间隙明显变窄,严重硬化性病变及明显畸形,并且出现关节半脱位及关节游离体。采用Pettersson法[8]对关节间隙的狭窄程度进行评价,该评分方法对关节病变的8个征象作为评价指标,每个征象赋分1~2分,满分16分,分数越高表明关节间隙狭窄程度越严重。
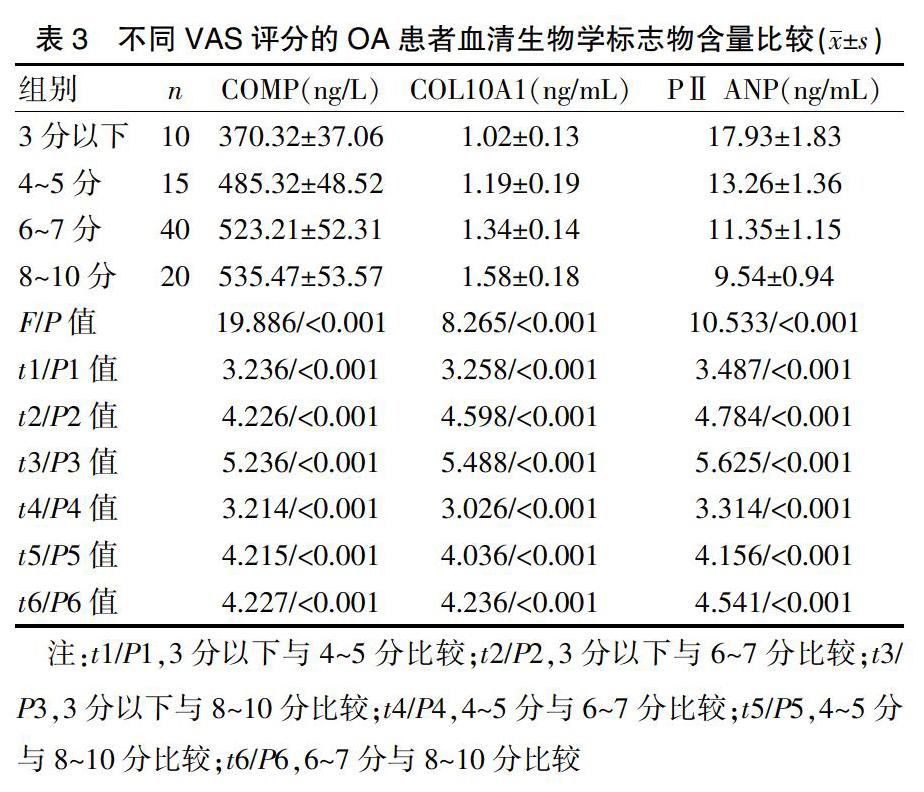
1.2.2 VAS评分 采用视觉模拟评分(visual analogue scale,VAS)方法对OA组患者的疼痛程度进行评价。由主治医师对受试者的疼痛进行评分,绘制10 cm横线,对应0~10分,0分为无痛,10分为剧痛。1~3分为轻微疼痛;4~5分为轻度疼痛;6~7分为中度疼痛;8~10分为重度疼痛。
1.2.3 血清生物学标志物水平检测 受试者均于清晨空腹采集静脉血10 mL,ELISA法检测血清中COMP、COL10A1、PⅡ ANP水平。
1.3 观察指标
统计并比较两组受试者血清中COMP、COL10A1、PⅡ ANP水平。比较不同病情分级、不同VAS评分的OA组患者血清中COMP、COL10A1、PⅡ ANP水平。对血清COMP、COL10A1、PⅡ ANP水平与Pettersson评分进行直线相关性分析。
1.4 统计学分析
实验数据应用SPSS 22.0 软件分析,正态计量资料用(x±s)表示,两样本均数比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析,两两比较采用 LSD法。计数资料用率表示,组间比较采用χ2检验。两变量的相关分析用Pearson直线相关分析法,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清生物学标志物含量比较
统计结果显示,OA组血清中COMP、COL10A1水平均明显高于对照组,PⅡ ANP水平均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 不同病情分级的OA患者血清生物学标志物含量比较
单因素方差分析结果显示,不同病情分级的OA患者血清中的COMP、COL10A1、PⅡ ANP水平存在明显统计学差异(P<0.05)。病情分级越高,血清中的COMP、COL10A1水平越高,PⅡ ANP水平越低,差异有统计学意义(P<0.05)。见表2。
2.3 不同VAS评分的OA患者血清生物学标志物含量比较
单因素方差分析结果显示,不同VAS评分的OA患者血清中的COMP、COL10A1、PⅡ ANP水平存在明显统计学差异(P<0.05)。VAS评分越高,血清中的COMP、COL10A1水平越高,PⅡ ANP水平越低,差异有统计学意义(P<0.05)。见表3。
2.4 血清COMP、COL10A1、PⅡ ANP水平与Pettersson评分的相关性分析
相关性分析结果显示,血清COMP、COL10A1水平与Pettersson评分呈显著正相关(P<0.05),血清PⅡ ANP水平与Pettersson评分呈显著负相关(P<0.05)。见表4。
3 讨论
软骨细胞与周围基质间的相互作用决定了软骨的功能与结构是否正常,软骨细胞可以通过调节基质的产生和降解来维持关节软骨周围基质的稳定性。稳定的基质成分有助于软骨正常结构的维持以及功能的优化,同时基质对软骨细胞还具有保护作用,从而影响了关节的功能。可见,骨关节炎病理条件下发生的关节损伤可涉及到软骨等組织基质成分,损伤的过程也涉及到基质成分的合成和分解。
COMP为软骨基质成分中的非蛋白聚糖成分,是近年来研究较多的一种软骨标记物,但具体生物学功能尚未完全清楚。在临床和实验动物学中被证实,在骨关节炎的临床病例和动物模型中,COMP的水平升高与骨关节炎发生的风险有关[9-12]。COL10A1为软骨基质成分中的胶原蛋白成分。但也有研究认为,COMP虽然可作为骨关节炎早期异常指标,但由于各个关节的软骨损伤均可导致血清COMP水平增加,因此血清COMP异常只能表明软骨受累,不能反映软骨损伤的程度[13-15]。因此本研究中将PⅡ ANP、COL10A1两个指标共同纳入研究。Ⅱ型胶原是软骨基质的主要成分,在软骨代谢过程中,Ⅱ型胶原与软骨的合成与分解密切相关,PⅡ ANP是软骨基质成分中ⅡA型胶原蛋白合成过程中的特异性标志物[16-17]。本研究发现,骨关节炎患者血清中COMP、COL10A1水平明显高于对照组,PⅡ ANP水平均明显低于对照组,证实了骨关节炎发生时的骨与软骨损伤过程,在骨与软骨的损伤过程中,软骨基质成分中的COMP、COL10A1大量释放入血,因此血清中的COMP、COL10A1呈高水平状态。而由于软骨损伤的发生,导致胶原蛋白的合成水平降低,因此血清中PⅡ ANP水平明显低于正常人群,或者是由于骨关节炎晚期软骨磨损丢失,导致软细胞和基质减少所致[18-20]。
为了进一步分析骨关节炎病情严重程度与生物学标志物之间的关系,本研究分别比较了不同病情分级、不同疼痛情况下的骨关节炎患者血清中的COMP、COL10A1、PⅡ ANP水平,统计结果显示,伴随病情分级的增加和疼痛程度的增加,血清中的COMP、COL10A1呈逐步升高状态,而PⅡ ANP水平呈逐步降低状态。相关性分析结果也显示,血清COMP、COL10A1水平与Pettersson评分呈显著正相关,血清PⅡ ANP水平与Pettersson评分呈显著负相关。以上均说明,血清COMP、COL10A1、PⅡ ANP水平可反映骨关节炎患者的骨与软骨损伤情况。
综上所述,COMP、COL10A1、PⅡ ANP均为软骨基质成分中具有代表性的成分,在软骨代谢过程中均发挥重要作用。通过检测骨关节炎患者血清中的COMP、COL10A1、PⅡ ANP水平,可以反映骨关节炎患者的骨与软骨损伤情况。但要将其作为诊断指标应用于临床骨关节炎的诊断还需要进行相关的诊断效能检验,这也是我们未来研究的方向。
[参考文献]
[1] Mehl J,Imhoff AB,Beitzel K. Osteoarthritis of the shoulder:Pathogenesis,diagnostics and conservative treatment option[J]. Orthopade,2018,47(5):368-376.
[2] Tauber M. Shoulder osteoarthritis-pathogenesis,classification,diagnostics and treatment[J]. Orthopade,2019,48(9):795-808.
[3] 艾有利,陈蓓,郑英杰,等. 血清COMP和MMP-13在膝骨关节炎诊疗中的临床研究[J]. 影像研究与医学应用,2017,1(18):168-169.
[4] Gu J,Lu Y. Identification and characterization of the novel Col10a1 regulatory mechanism during chondrocyte hypertrophic differentiation[J]. Cell Death Dis,2014,5(10):e1469.
[5] 张军锋,宋玲花,董海原,等. 联合检测尿C-末端Ⅱ型胶原血清软骨寡聚基质蛋白和硫酸软骨素846在骨关节炎早期诊断中的价值[J]. 中国药物与临床,2014, 14(7): 861-864.
[6] 中华医学会风湿病学会. 骨关节炎诊断及治疗指南[J]. 中华风湿病学杂志,2010,14(6):416-419.
[7] Shilpa P Karande,Seema Kini. Osteoarthritis:Clinical and radiological correlation[J]. J Assoc Physicians India,2018,66(7):37-39.
[8] Erlemann R,Rosenthal H. Reproducibility of the pettersson scoring system. An interobserver study[J]. Acta Radiol,1989,30(2):147-151.
[9] Unnur Styrkarsdottir,Hannes Helgason. Whole-genome sequencing identifies rare genotypes in COMP and CHADL associated with high risk of hip osteoarthritis[J]. Nat Genet,2017,49(5):801-805.
[10] Sakamoto Y. Multiple epiphyseal dysplasia mimicking osteoarthritis due to acetabular dysplasia:A report of a familial case with a COMP mutation[J]. J Orthop Sci,2017, 22(5):967-971.
[11] Lv C. Association of SPP1 promoter variants with hip osteoarthritis susceptibility in Chinese population[J]. Gene,2015,564(1):9-13.
[12] den Hollander W. Genome-wide association and functional studies identify a role for matrix Gla protein in osteoarthritis of the hand[J]. Ann Rheum Dis,2017,76(12): 2046-2053.
[13] Styrkarsdottir U. Corrigendum:Whole-genome sequencing identifies rare genotypes in COMP and CHADL associated with high risk of hip osteoarthritis[J]. Nat Genet,2017,49(8):1286.
[14] Shepherd C. Expression Analysis of the osteoarthritis genetic susceptibility mapping to the matrix Gla protein gene MGP[J]. Arthritis Res Ther,2019,21(1):149.
[15] 顏世昌,魏建军,杨永江,等. 膝骨关节炎患者病情严重程度与尿CTX-Ⅱ及尿COMP的相关研究[J]. 医学综述,2018,24(20): 4123-4126,4132.
[16] 李芳,姚建华,任秀英,等. 痹祺胶囊对不同证型膝骨关节炎患者血清脂联素与软骨寡聚基质蛋白的影响[J].中国老年学杂志,2017,37(8): 2016-2018.
[17] Lang G. Examination of concomitant glenohumeral pathologies in patients treated arthroscopically for calcific tendinitis of the shoulder and implications for routine diagnostic joint exploration[J]. BMC Musculoskelet Disord,2017,18(1):476.
[18] Saltzman BM. Glenohumeral osteoarthritis in the young patient[J]. J Am Acad Orthop Surg,2018,26(17):e361-e370.
[19] Takamura KM. Nonarthroplasty options for the athlete or active individual with shoulder osteoarthritis[J]. Clin Sports Med,2018,37(4):517-526.
[20] Harmsen S. "Shaped" humeral head autograft reverse shoulder arthroplasty:Treatment for primary glenohumeral osteoarthritis with significant posterior glenoid bone loss (B2,B3,and C type)[J]. Orthopade,2017,46(12):1045-1054.
(收稿日期:2019-12-02)

