中药联合动脉灌注化疗对胰腺癌的临床疗效及安全性研究
郑炜望 张宝南


[摘要] 目的 研究中藥联合动脉灌注化疗治疗胰腺癌的临床疗效及安全性。 方法 选取2009年1月~2016年11月我院收治的 60例胰腺癌患者为主要研究对象,采用随机数字表法分组,每组30例。对照组患者接受动脉灌注化疗,观察组在对照组的基础上增加中药汤剂治疗,对两组生存时间、生存率、KPS评分及不良反应进行统计分析。 结果 治疗后对照组患者1年生存率为47%,2年生存率为23%,3年生存率为17%,中位生存时间为12.33个月。观察组患者治疗后1年生存率为67%,2年生存率为40%,3年生存率为27%,中位生存时间为22.34个月;观察组生存期明显高于对照组患者(P<0.05)。且观察组患者KPS评分与治疗前相比有显著差异,且明显优于对照组(P<0.05)。观察组患者严重不良反应发生率16.67%,明显低于对照组的36.67%,但差异无统计学意义(P>0.05)。 结论在胰腺癌的临床治疗上,采用中药联合动脉灌注化疗的治疗方案,效果更加显著,可明显改善患者的各项临床症状,更有效地控制肿瘤的进展,延长患者的生存时间,提高生活质量,减少严重不良反应的发生率,值得在临床治疗上进一步推广应用。
[关键词] 中药治疗;动脉灌注化疗;胰腺癌;六君子汤
[中图分类号] R735.9 [文献标识码] A [文章编号] 1673-9701(2020)12-0005-04
[Abstract] Objective To study the clinical efficacy and safety of traditional Chinese medicine combined with arterial infusion chemotherapy in the treatment of pancreatic cancer. Methods Sixty patients with pancreatic cancer treated in our hospital from January 2009 to November 2016 were selected as the study subjects. They were divided into two groups using the random number table method, with 30 patients in each group. The control group received arterial infusion chemotherapy, while the observation group was treated with traditional Chinese medicine decoction on the basis of the control group. The survival time, survival rate, KPS score and adverse reactions were compared between the two groups. Results After treatment, the one-year survival rate was 47%, the two-year survival rate was 23%, the three-year survival rate was 17% in the control group, and the median survival time was 12.33 months. The one-year survival rate was 67%, the two-year survival rate was 40%, the three-year survival rate was 27% in the observation group, and the median survival time was 22.34 months. The survival time in the observation group was significantly higher than that in the control group(P<0.05). And the KPS score in the observation group were significantly different from those before treatment, and were significantly better than those in the control group(P<0.05). The incidence of severe adverse reactions in the observation group was 16.67%, which was significantly lower than the 36.67% in the control group, but the difference was not statistically significant(P>0.05). Conclusion In the clinical treatment of pancreatic cancer, the use of Chinese medicine combined with arterial infusion chemotherapy has a more remarkable effect, which can significantly improve the clinical symptoms, more effectively control the progress of tumors, prolong the survival time of patients, improve the quality of life, and reduce the incidence of severe adverse reactions. It is worth further promotion and application in clinical treatment.
[Key words] Traditional Chinese medicine treatment; Arterial infusion chemotherapy; Pancreatic cancer; Liujunzi decoction
胰腺癌是一种临床多发的消化道恶性肿瘤,由于起病隐匿,无典型症状体征,临床难于诊断确诊和及时治疗[1]。许多胰腺癌患者一经确诊即是中晚期,常不再具备手术指征,临床多采取静脉化疗或介入治疗手段[2]。目前胰腺癌的常用一线化疗药物及治疗手段疗效有限,且患者不良反应较多[2,3]。而近几年中医药辅助治疗胰腺癌的已取得较大进展,被证实可以减少化疗不良反应,增强疗效,提高患者的生活质量[4,5]。本文以在我院2009年1月~2016年11月就诊的60例胰腺癌患者为主要研究对象,对中药联合动脉灌注化疗治疗胰腺癌的临床疗效及安全性进行研究,现报道如下。
1 资料与方法
1.1 一般资料
研究对象为2009年1月~2016年11月于我院就诊的胰腺癌患者60例,收集患者的基本信息及疾病相关信息。按照随机数字表法进行分组,每组30例。观察组中,男16例,女14例,年龄49~72岁,平均(61.32±13.66)岁,病程均超过6个月;其中胰头癌12例,胰体癌10例,胰尾癌8例;对照组中,男17例,女13例,年龄48~70岁,平均(60.13±10.67)岁,其中胰头癌10例,胰体癌11例,胰尾癌9例,病程均超过6个月。研究前已告知所有患者及家属治疗风险及意义,自愿签署知情同意书,本研究经本院伦理委员会审核许可。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
1.2.1 西医诊断标准 根据国家健康卫生委员会发布的《胰腺癌诊疗规范(2018年版)》[6]中胰腺癌的诊断标准,综合患者的病史、症状体征、各项检验检查进行評估,结合CT、MRI、病理学检查等明确诊断。
1.2.2 中医诊断标准 根据《中医肿瘤学》[7]中胰腺癌诊断标准评估。
1.3 纳入与排除标准
纳入标准:①符合西医诊断标准者;②无根治性手术指征或拒绝手术者;③预计生存期一年以上者;④自愿参与本课题,依从性良好者。排除标准:①对治疗所用药物过敏者;②不能经口进食者;③严重心、肝、肾功能不全者;④妊娠、哺乳期妇女;⑤严重精神神志障碍,依从性差者;⑥不符合以上诊断标准和纳入标准者。
1.4 方法
对照组采用动脉灌注化疗:行股动脉穿刺导管置入,胰头癌患者经胃十二指肠动脉行灌注化疗;胰体及胰尾癌患者经肠系膜上动脉或脾动脉行灌注化疗;化疗药物:盐酸吉西他滨(Eli Lilly and Company,规格:200 mg,国药准字H20110535)1000 mg/m2,持续时间20 min左右,每4周为1个化疗周期。维持其他基础支持治疗。每3个化疗周期为1个疗程。
观察组在对照组基础上加用六君子汤加减方,组成:党参10 g,茯苓10 g,炒白术10 g,炒白芍10 g,炙甘草6 g,姜半夏10 g,陈皮10 g,白花蛇舌草30 g,生薏苡仁15 g,焦麦芽15 g,猪苓15 g,焦稻芽15 g,山药10 g,枇杷叶10 g,茵陈30 g,茯神10 g,藤梨根15 g,半枝莲10 g,八月扎10 g。中药方剂于我院代煎,每付药煎取600 mL,早晚饭后服,300 mL/次。维持其他基础支持治疗。持续治疗每4周为1个周期,每3个周期为1个疗程。
1.5 观察指标
1.5.1 生存时间及生存率 记录患者的生存时间,计算生存率。对比两组患者的生存时间及生存率。生存时间以患者入组时间为起点,以死亡日期、失访日期或本研究结束日期为终点,以月为单位。
1.5.2 Karnofsky performance status(KPS)评分表[6] 患者治疗前及治疗四周期后进行KPS评分,对患者功能状态进行评定。100分:健康状况正常,无主诉和明显客观体征和症状;90分:能正常活动,有轻微症状和体征;80分:勉强可进行正常活动,有一些症状或体征;70分:生活可自理,但不能维持正常生活或工作;60分:生活能大部分自理,但偶尔需要别人帮助,不能从事正常工作;50分:生活大部分不能自理,经常治疗和护理;40分:生活不能自理,需专科治疗和护理;生活完全失去自理能力,需要住院和积极的支持治疗;30分:生活完全失去自理能力,需要住院和积极的支持治疗;20分:病情严重,必须接受支持治疗;10分:垂危,病情急剧恶化,临近死亡;0分:死亡。
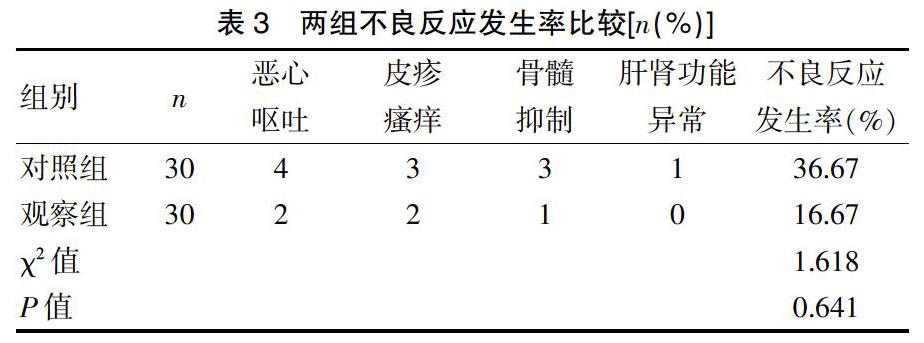
1.5.3 不良反应观察 记录患者治疗四周期中出现的不良反应,如恶心呕吐、腹泻、皮疹瘙痒、骨髓抑制(白细胞下降、中性粒细胞下降、血小板下降、贫血)、肝功能异常、肾功能异常,排除其他原因引起的不良反应。记录不良反应发生例数,计算不良反应发生率(不良反应发生例数/总例数×100%)。
1.6 统计学方法
采用SPSS20.0统计学软件进行数据处理。生存时间及生存率以Kaplan Meier法检验,并绘制生存曲线。对疗效、不良反应等计数资料,组间比较采用χ2检验,对KPS评分用均数±标准差(x±s)表示,两组组内比较采用配对样本t检验,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组生存时间及生存率比较
对照组患者治疗后1年生存率为47%,2年生存率为23%,3年生存率为17%,中位生存时间为12.33个月。观察组患者治疗后1年生存率为67%,2年生存率为40%,3年生存率为27%,中位生存时间为22.34个月;观察组生存时间及生存率明显高于对照组,差异有统计学意义(P<0.05)。见图1、表1。

