利用直扩PCR试剂盒检测小麦多效抗病基因
李玮 宋国琦 李玉莲 张淑娟 张荣志 高洁 李吉虎 李根英
摘要:为了明确直扩PCR在小麦多效抗病基因检测中的效果,促进廉价、快捷的直扩PCR技术在小麦分子育种中的应用,本研究通过对聚合三个多效抗病基因Sr2、Lr34、Lr67的BC2单株进行直扩PCR检测,筛选到了三个基因聚合的杂合单株,证明了直扩PCR的有效性,并讨论了直扩PCR的优缺点和影响因素,为直扩PCR技术在作物分子育种中的推广应用提供参考。
关键词:小麦;直扩PCR试剂盒;多效抗病基因;分子标记
中图分类号:S512.1:Q781 文献标识号:A 文章编号:1001-4942(2020)02-0015-04
Abstract To clarify the effect of direct PCR in detecting pleiotropic disease resistant genes in wheat, and promote the utilization of inexpensive and rapid direct PCR technology in wheat molecular breeding, the BC2 progeny were detected by direct PCR. The results showed that the heterogeneous individuals with three pleiotropic disease resistant genes Sr2, Lr34 and Lr67 were selected by direct PCR which indicated the effectiveness of direct PCR. The advantages, disadvantages and impact factors of direct PCR were also discussed. This study would provide references for popularization and application of direct PCR in crop molecular breeding.
Keywords Wheat; Direct PCR kit; Pleiotropic disease resistant gene; Molecular marker
小麥是我国第三大粮食作物,条锈病、叶锈病、秆锈病和白粉病是小麦生产中的重要病害,多效抗病基因对锈病和白粉病均有持久抗性,主要有Lr34/Yr18/Pm38/Sr57[1]、Lr27/Yr30/Sr2[2]、Lr46/Yr29/Pm39/Sr58[3]和Lr67/Yr46/Pm46/Sr55[4]。利用分子标记辅助将多效抗病基因导入优良品种培育抗病品种是防治病害经济有效的途径。开展分子标记辅助选择育种需要提取DNA进行分子标记检测,常用的DNA提取方法主要是CTAB法[5]和SDS法[6],这两种方法都需要经过组织破碎、细胞裂解、蛋白沉淀、DNA洗盐和重新溶解等多个步骤,不但费时费力,而且DNA提取质量和数量不能保证。传统的DNA提取方法耗时耗力,已成为分子标记检测的限速步骤。
随着研究的深入,科研人员发现导致PCR失败的主要原因不是模板不足,而是PCR抑制因子太多[7]。通过改变DNA提取策略,使用极少量组织样品或稀释粗提液作为模板进行PCR反应(即直扩PCR)被提出并在法医检测中成功应用[8]。在植物方面,Berthomieu等最早在烟草中使用蓝枪头(1 mL)或黄枪头(200 μL)穿刺叶片和根获得少量组织碎片,加入100 μL PCR反应体系中获得了直扩PCR成功[9];Rogers等用白枪头(10 μL)挤压叶片获得小叶盘,加入50 μL PCR反应液中进行扩增,也获得了成功[7]。Collard等比较了6种从水稻叶片中提取DNA的方法,发现碱法(以NaOH溶液为提取液)和传统SDS法提取DNA的PCR扩增效果相当[10]。在小麦中,He等对Pm21进行基因定位时,采用TE煮沸法获得粗提DNA直接进行PCR反应,也取得较好的效果[11]。
直扩PCR减少了繁琐的DNA提取步骤,操作简便,省时省力,特别适用于对大量个体的分子标记检测,是简便快捷的可选方法。鉴于直扩PCR在小麦中应用较少,为了明确直扩PCR在小麦分子育种中的效果,本研究利用直扩试剂盒对聚合三个多效抗病基因(Sr2/Lr34/Lr67)的小麦BC2单株进行分子标记检测,成功筛选到同时含有三种基因的杂合单株,可为自交创制多效抗病基因聚合新种质提供材料,并为促进直扩PCR的广泛应用提供参考。
1 材料与方法
1.1 试验材料
本研究所用小麦材料为Pavon76(含Sr2)、中国春(含Lr34)、NP876(含Lr67)和济麦229复交聚合三个多效抗病基因然后用济麦229回交的BC2单株。
1.2 试验方法
1.2.1 DNA粗提液准备 参考T5植物直扩试剂盒(擎科,青岛)说明书中的加热裂解法处理样品。取苗期小麦叶片,剪取4 mm×2 mm大小放入1.5 mL离心管中,加入50 μL buffer A,用黄枪头捣几下使溶液变绿,95℃温浴10 min,加入等体积buffer B,混匀后取上清1 μL作模板。
1.2.2 引物 试剂盒提供阳性对照引物rbcLa-F(5′-ATGTCACCACAAACAGAGACTAAAGC-3′)和rbcLa-R(5′-GAAACGGTCTCTCCAACGCAT-3′),用于扩增维管植物rbcL基因650 bp片段。选用cssfr1检测Lr34[12]。选用csSr2检测Sr2[13],由于csSr2引物组合扩增不稳定,用DNAMAN8设计引物Sr2-637R(5′-CCCTGCTATCATCATAATCAGTC-3′)与原引物csSr2F组合进行检测。TM4是Lr67的KASP标记[14],利用dCAPS Finder 2.0[15]将TM4转换成dCAPS标记TM4dcaps,用于检测Lr67。
1.2.3 直擴PCR 采用10 μL体系,包含2×T5直扩酶Mix 5 μL,10 μmol·L-1上下游引物各0.5 μL(擎科,青岛),DNA粗提液1 μL,去离子水3 μL。利用384孔PCR仪Veriti(AB,美国)进行PCR,程序为:98℃ 3 min; 98℃ 10 s,退火10 s(退火温度:阳性对照64℃,cssfr1 58℃,csSr2 62℃,TM4dcaps 53℃),72℃ 10 s,40个循环;最后72℃ 3 min。
1.2.4 酶切反应 取5 μL dCAPS标记扩增产物进行琼脂糖凝胶电泳检测,扩增成功的加入1×buffer R 1 μL,HinfⅠ(10 U·μL-1)1 μL,去离子水3 μL,混匀后37℃温浴1 h。
1.2.5 产物检测 PCR产物或酶切产物用1.5%~2.5%琼脂糖凝胶电泳检测,GoldView Ⅱ型核酸染料(索莱宝,北京)染色,Universal Hood Ⅱ(Bio-Rad,美国)拍照。PCR产物检测用Marker DL2000(六条带从大到小依次为2 000、1 000、750、500、250、100 bp),酶切产物检测用50 bp DNA Ladder(八条带从大到小依次为500、400、300、250、200、150、100、50 bp)。
2 结果与分析
2.1 阳性对照检测结果
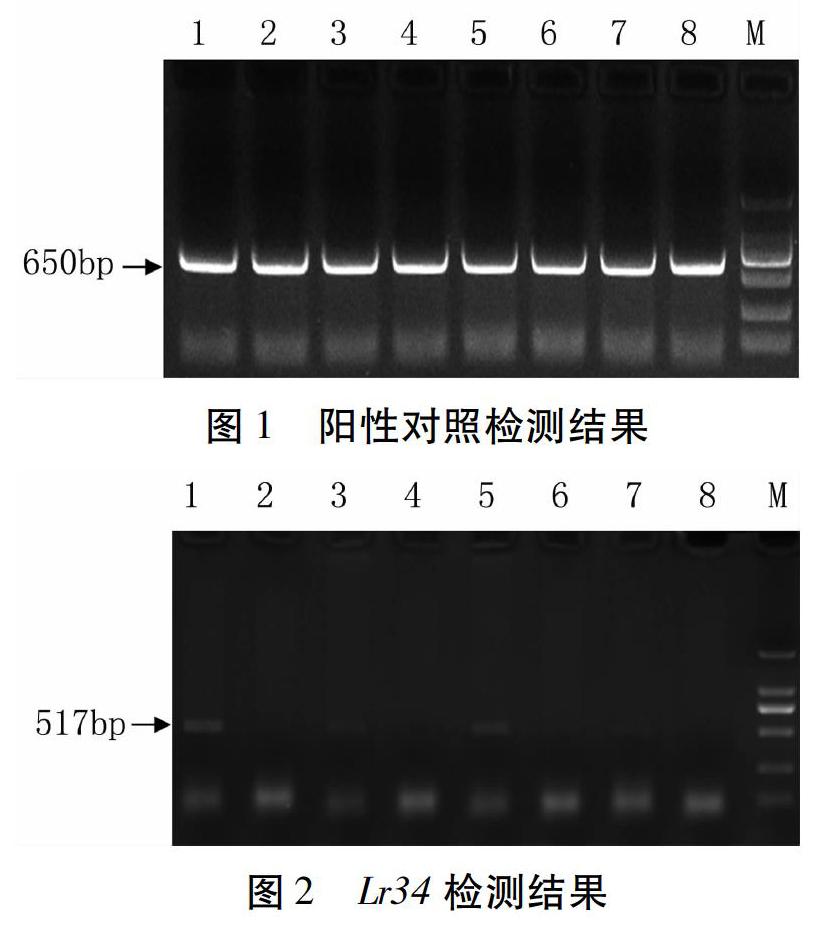
在获得DNA粗提液后,首先利用试剂盒提供的阳性对照引物进行检测,从结果(图1)可见,所有个体均能扩增出650 bp条带,说明粗提液可以用于后续实验检测。
2.2 Lr34检测结果
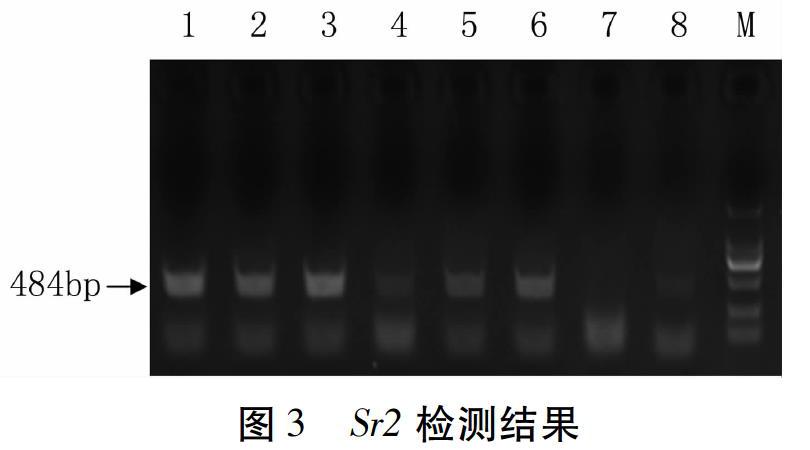
Lr34的分子标记cssfr1是一个显性标记,含有该基因的单株可扩增出517 bp条带,而不含该基因的单株无该条带(图2)。在本研究中,BC1代时用隐性纯和亲本济麦229对杂合型个体进行了回交,BC2个体能扩增出517 bp条带即表明其为杂合型单株(下同)。扩增条带的强弱可能与DNA粗提液的质量有关。
2.3 Sr2检测结果
csSr2是CAPS标记,有三种检测结果:无扩增(不含Sr2),有扩增但不能酶切(不含Sr2),有扩增可以酶切(含有Sr2)。在本研究中,由于仅供体亲本Pavon76含有Sr2,其他亲本均无,所以至BC2时,仅通过有无扩增产物即可判断是否含有Sr2,不需要进行酶切。含有Sr2的单株(杂合型)可扩增出484 bp条带,不含Sr2的单株无扩增(图3)。
2.4 Lr67检测结果
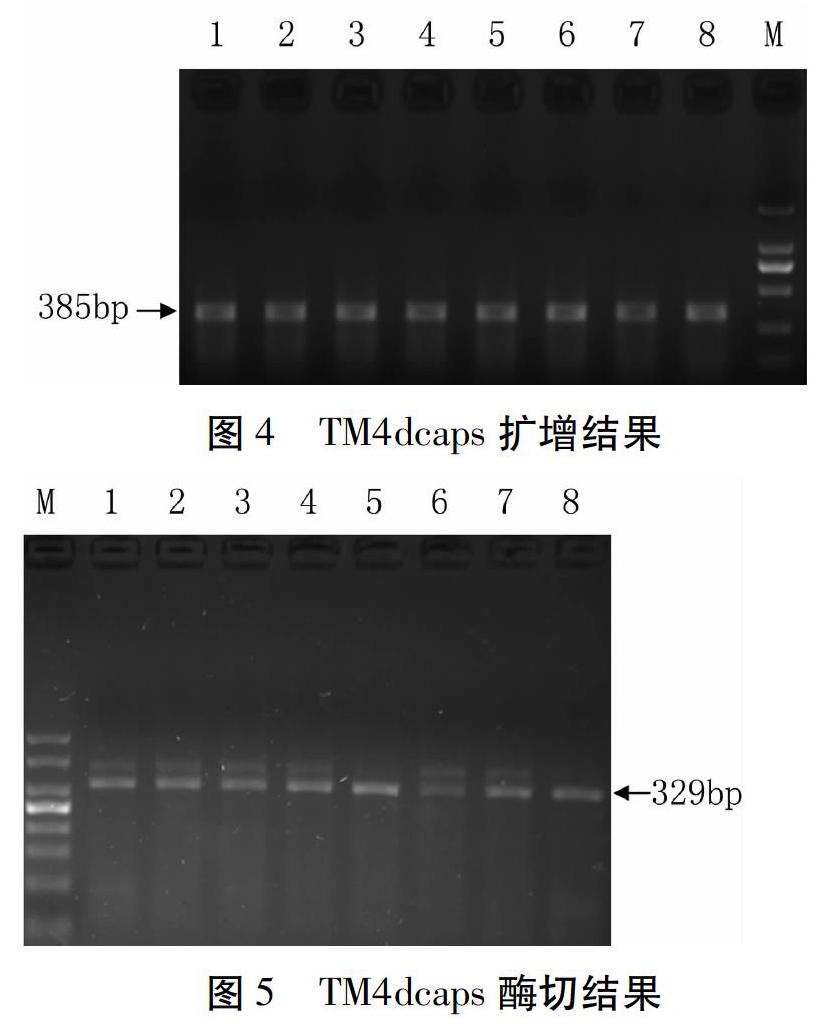
TM4dcaps扩增产物385 bp(图4),用HinfⅠ酶切后,不含Lr67的单株产生329 bp条带,含有Lr67的单株不酶切,杂合型单株同时含有385 bp和329 bp两条带(图5)。
2.5 三个多效抗病基因的筛选结果
通过上述直扩PCR筛选,我们从8个BC2单株中筛选到了同时含有Lr34、Sr2和Lr67三个多效抗病基因的杂合单株1和3,成功筛选出目标。
3 讨论
多效抗病基因是小麦宝贵的基因资源,利用分子标记辅助选择进行回交转育是利用这些宝贵资源的有效手段。直扩PCR作为一种分子标记检测策略,已经在法医数据库建设中得到了广泛应用[16],将其用于小麦分子育种有助于改善当前分子标记检测成本较高、耗时费力的现状。与传统的CTAB或SDS提取方法相比,直扩PCR采用DNA粗提液作为模板,其突出优势表现在:仅需少量组织样品,不需要液氮研磨,不需要离心,不需要氯仿、异丙醇等有机溶剂,无需更换离心管或深孔板,操作步骤少,节省大量时间。其缺点是DNA浓度太低,无法用电泳或紫外吸收法进行检测,保存时间不长,样品量太少用研磨仪打碎困难等。
直扩PCR的扩增效果受多种因素影响。利用粗提DNA进行直扩PCR时模板DNA少,对于低拷贝目标序列可能会失败[9]。Rogers等对不同物种叶盘法直扩PCR的研究认为直扩PCR的效率在物种间存在差异,导致扩增失败的原因不是模板量少,而是抑制物太多,使用更小的叶盘可以获得较好的检测效果[7]。Li等也认为组织样品的多少是直扩PCR成功的关键,太多的组织会抑制扩增,在反应体系中加入硫酸铵可以增加引物退火的特异性,改善检测效果[17]。用NaOH作为提取液的碱法获得的粗提液,后续的稀释起到关键作用[18]。在本研究中,阳性对照引物和TM4dcaps扩增效果较好,csSr2单株间扩增条带强弱差异较大,cssfr1的扩增效果较差,说明引物的扩增效率对直扩PCR的效果也有影响。获得足够的DNA,降低抑制物的含量,是直扩PCR成败的关键,不管是减少组织样品量,还是稀释粗提液,目前都存在个别样品扩增效果不佳甚至失败的问题。因此有必要进一步研究改进直扩PCR技术,为分子育种的高效率、低成本规模化应用提供技术支持。
参 考 文 献:
[1] Krattinger S G, Jordan D R, Mace E S, et al. Recent emergence of the wheat Lr34 multi-pathogen resistance: insights from haplotype analysis in wheat, rice, sorghum and Aegilops tauschii[J]. Theoretical and Applied Genetics, 2013, 126(3): 663-672.
[2] Tabe L, Samuel S, Dunn M, et al. Phenotypes conferred by wheat multiple pathogen resistance locus, Sr2, include cell death in response to biotic and abiotic stresses [J]. Phytopathology, 2019, 109(10): 1751-1759.
[3] Lan C, Rosewarne G M, Singh R P, et al. QTL characterization of resistance to leaf rust and stripe rust in the spring wheat line Francolin#1 [J]. Molecular Breeding, 2014, 34(3): 789-803.
[4] Herrera-Foessel S A, Singh R P, Lillemo M, et al. Lr67/Yr46 confers adult plant resistance to stem rust and powdery mildew in wheat [J]. Theoretical and Applied Genetics, 2014, 127(4): 781-789.
[5] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA [J]. Nucleic Acids Res., 1980, 8(19): 4321-4326.
[6] Aljanabi S M, Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR- based techniques [J]. Nucleic Acids Res., 1997, 25(22): 4692-4693.
[7] Rogers H J, Parkes H C. Direct PCR amplification from leaf discs [J]. Plant Science, 1999, 143(2): 183-186.
[8] Cavanaugh S E, Bathrick A S. Direct PCR amplification of forensic touch and other challenging DNA samples: a review [J]. Forensic Science International: Genetics, 2018, 32: 40-49.
[9] Berthomieu P, Meyer C. Direct amplification of plant genomic DNA from leaf and root pieces using PCR [J]. Plant Molecular Biology, 1991, 17(3): 555-557.
[10] Collard B C Y, Das A, Virk P S, et al. Evaluation of ‘quick and dirty DNA extraction methods for marker-assisted selection in rice (Oryza sativa L.) [J]. Plant Breeding, 2007, 126(1): 47-50.
[11] He H, Ji Y, Zhu S, et al. Genetic, physical and comparative mapping of the powdery mildew resistance gene Pm21 originating from Dasypyrum villosum[J]. Frontiers in Plant Science, 2017, 8: 1914.
[12] Lagudah E S, Krattinger S G, Herrerafoessel S, et al. Gene-specific markers for the wheat gene Lr34/Yr18/Pm38 which confers resistance to multiple fungal pathogens [J]. Theoretical and Applied Genetics, 2009, 119(5): 889-898.
[13] Mago R, Simkova H, Brown-Guedira G, et al. An accurate DNA marker assay for stem rust resistance gene Sr2 in wheat [J]. Theoretical and Applied Genetics, 2011, 122(4): 735-744.
[14] Moore J W, Herrera-Foessel S, Lan C, et al. A recently evolved hexose transporter variant confers resistance to multiple pathogens in wheat [J]. Nature Genetics, 2015, 47(12): 1494-1498.
[15] Neff M M, Turk E, Kalishman M. Web-based primer design for single nucleotide polymorphism analysis [J]. Trends in Genetics, 2002, 18(12): 613-615.
[16] 沈偉, 马骏, 潘豪杰, 等. 直接扩增技术在法医DNA检验中的研究进展[J]. 刑事技术, 2018, 43(5): 390-395.
[17] Li Y, Zhao H, Yan X, et al. A universal method for direct PCR amplification of plant tissues [J]. Analytical Methods, 2017, 9(11): 1800-1805.
[18] Satya P, Mitra S, Ray D P, et al. Rapid and inexpensive NaOH based direct PCR for amplification of nuclear and organelle DNA from ramie (Boehmeria nivea), a bast fibre crop containing complex polysaccharides [J]. Industrial Crops and Products, 2013, 50: 532-536.

