小麦胁迫相关基因TaUCE2的克隆及表达模式分析
毛凤鑫 葛超 李豪圣 王灿国 韩冉 程敦公 李法计 孙福来 赵振东 刘爱峰

摘要:前期通过对耐旱小麦的RNA-Seq分析发现,转录本TRIAE_CS42_3DL_TGACV1_252817_AA0892160在干旱胁迫下表达量下降;通过克隆、生物信息学分析发现,该转录本包含一个444 bp的完整编码区,编码147个氨基酸,蛋白结构分析其含有一个UBC结构域,与山羊草泛素结合酶(E2)的氨基酸序列完全一致,证明该基因为泛素结合酶(E2)基因(TaUCE2)。蛋白序列比对发现其第7、91、144位置处的氨基酸在单双子叶植物之间是特异的。进化分析发现该基因是在单双子叶植物进化后期分化的。荧光定量PCR分析表明,该基因响应ABA、干旱、高盐、低温的胁迫,在四种胁迫下,该基因在根中的表达量均降低。本研究为进一步分析泛素蛋白酶体途径在小麦逆境响应中的功能和机制奠定基础。
关键词:小麦;泛素结合酶(E2);TaUCE2;逆境胁迫
中图分类号:S512.1:Q785 文献标识号:A 文章编号:1001-4942(2020)02-0001-06
Abstract The RNA-Seq analysis result showed that the expression level of transcript TRIAE_CS42_3DL_TGACV1_252817_AA0892160 decreased under drought stress. It was found that the transcript contained one gene whose CDS was 444 bp based on cloning and bioinformatics analysis. The protein encoded by this gene contained 147 amino acids and had a UBC domain. The amino acid sequence of this protein was the same as ubiquitin binding enzyme (E2) in Aegilops tauschii, which indicated that this gene belonged to the ubiquitin binding enzyme gene (TaUCE2). Protein sequence alignment revealed that the amino acids at position 7, 91 and 144 were specific between monocotyledonous and dicotyledonous plants. Evolutionary analysis showed that the gene was differentiated in the later stage of monocotyledonous and dicotyledonous plant evolution. Real-time PCR analysis showed that TaUCE2 was response to ABA, drought, high salt and low temperature, and its expression level in root was down-regulated under the four kinds of stress. This study could provide a foundation for further function and mechanism analysis of ubiquitin proteasome pathway in wheat stress response.
Keywords Wheat; Ubiquitin-conjugating enzyme (E2);TaUCE2; Abiotic stress
非生物胁迫包括干旱、盐碱等,是影响作物产量和品质的重要因素。植物在长期进化过程中形成了一套响应外界胁迫的信号传递网络。其中,蛋白质泛素化途径在维持细胞功能、抵御胁迫等方面发挥重要作用。植物会因为胁迫产生异常蛋白影响细胞的代谢,而植物泛素化途径可以有效去除这些异常蛋白,使细胞正常代谢[1]。
蛋白质泛素化在真核生物的许多生理过程中至关重要,大量研究表明,植物通过泛素-蛋白酶体途径降解靶蛋白,从而维持自身正常的生长发育及代谢调控过程[2]。泛素化过程是通过将泛素加到靶蛋白上的泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)依次作用来实现的[3-5]。其中泛素结合酶(E2)在E1和E3之间起桥梁作用。E2通过与特定的E3相互作用将泛素连接到靶蛋白上[6-8]。另外,E2还通过影响多聚泛素链的空间结构调节泛素途径中的底物[9-10]。因此对泛素结合酶(E2)的研究具有重要意义。
泛素结合酶(E2)约由150个氨基酸组成,含有UBC结构,且第85个氨基酸为半胱氨酸,该Cys可与ATP激活的泛素蛋白共价结合形成硫酯键。拟南芥E2基因主要参与抗逆、DNA修复、雌配子发育、开花的调节[11-13]。近年来,泛素结合酶E2在提高植物抗性方面的研究已成为一个热点[14]。
本研究室在耐旱小麦转录组测序结果中发现一个转录本TRIAE_CS42_3DL_TGACV1_252817_AA0892160,该转录本在重度干旱胁迫下的表达量仅为对照的一半,说明该转录本响应干旱胁迫。通过克隆、序列比对发现该转录本编码泛素结合酶(E2)。为了更深入了解小麦泛素结合酶(E2)基因(TaUCE2)的功能,本研究克隆了耐旱小麦济麦262中的TaUCE2基因,并对其蛋白序列进行了分析,通过荧光定量分析了该基因在非生物胁迫条件下的表达模式,为深入研究该基因参与小麦抗逆调控的机理奠定了基礎。
1 材料与方法
1.1 植物材料
本研究以山东省农业科学院抗旱节水小麦品种济麦262为材料,选取饱满种子,置于直径为9 cm的培养皿中,于光照培养箱中25℃恒温培养3 d后,选择生长状态一致的幼苗移栽到塑料培养盒中,1/2 Hogland培养液培养至两叶一心时,用于非生物胁迫处理。干旱处理:将材料置于含 20% PEG-6000的水溶液中生长;盐胁迫处理:将待处理材料置于含250 mmol/L NaCl水溶液中生长;ABA处理:将待处理材料置于含100 μmol/L ABA的水溶液中生长;低温处理:将待处理材料置于4℃培养箱中生长。分别于处理0、3、6、12、24、48 h时取根、茎、叶部位材料。
1.2 试验方法
1.2.1 样品RNA的提取及cDNA的合成 样品RNA的提取采用RNA提取试剂盒(大连宝生物工程有限公司)按操作说明进行。取检测浓度适宜及完整度较好的RNA为模板进行cDNA合成。试验步骤按照反转录试剂盒(大连宝生物工程有限公司)操作说明进行。合成后的cDNA保存在-20℃中备用。
1.2.2 TaUBE2基因的克隆 利用引物TaUCE2F (5′-CAGACAGCGAGCAAAGGA-3′,位于起始密码子上游170~187处),TaUCE2R (5′-GCAGGTGGCGACATTTATC-3′,位于终止密码子下游164~182处),以反转录合成的cDNA为模板,利用高保真DNA聚合酶进行PCR扩增。扩增产物连接到pEASY-Blant载体上,转化到大肠杆菌中,挑取6个阳性菌落送于青岛擎科生物公司进行测序。测序结果利用DNAMAN软件进行分析。
1.2.3 基因的生物信息学分析 利用DNAMAN软件将DNA序列翻译成蛋白序列并通过在线软件ExPASy(https://web.expasy.org/protparam/)、TMHMM进行分析(http://www.cbs.dtu.dk/services/TMHMM/)推定蛋白质的理化性质。不同物种间进化树的构建使用软件MEGA 7.0进行。
1.2.4 荧光定量PCR分析 使用罗氏公司的LightCycler 480Ⅱ进行荧光定量PCR检测TaUCE2的表达模式。利用TaUCE2基因的特异引物(F: 5′-GCAGGCAACAATAATGGG-3′, R: 5′-GTGGGCGATCTCAGGAAC-3′)。反应体系20 μL,含2×Taq PCR MasterMix(含荧光染料) 10 μL,10 μmol/L引物各0.5 μL,cDNA模板0.5 μL,ddH2O 8.5 μL。扩增程序为95℃预变性5 min;95℃变性20 s,56℃退火25 s,72℃延伸20 s,40个循环。以小麦Actin基因作为内参(F:5′-AAGTACAGTGTCTGGATTGGAGGG-3′,R:5′-TCGCAACTTAGAAGCACTTCCG-3′)。每个处理时期3次生物学重复,每个重复3个试验重复,利用2-ΔΔCT法对试验数据进行计算与分析。
2 结果与分析
2.1 TaUCE2基因的克隆和序列分析
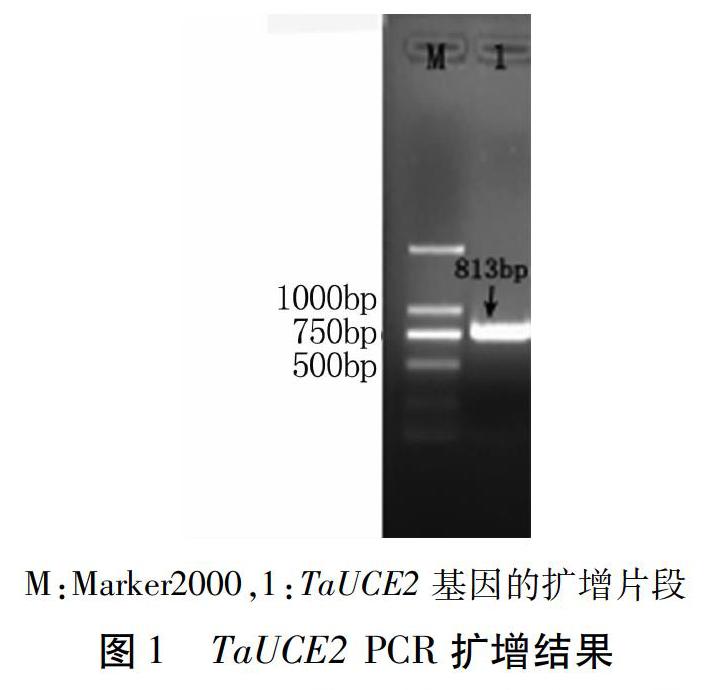
2.1.1 TaUCE2基因的克隆 以干旱胁迫处理的济麦262根系cDNA为模板,通过PCR扩增获得了813 bp的扩增片段(图1),将该片段连接到克隆载体上进行测序,结果发现其包括444 bp的完整编码区。将编码区序列在NCBI上进行比对,发现与山羊草的泛素结合酶E2基因的相似度达到98%(NCBI登录号XM_020329095.1),认为该基因为小麦泛素结合酶E2,将该基因暂命名为TaUCE2。
2.1.2 TaUCE2编码蛋白序列分析 利用DNAMAN软件将TaUCE2翻译成蛋白,发现其编码147个氨基酸。将此氨基酸序列在ExPASy-PROSITE和SMART进行保守域分析,发现该基因包含一个典型的UBC结构域。蛋白酶活性位点位于74~89位的15个氨基酸残基以及85位的半胱氨酸残基,与其他物种的泛素结合酶序列完全匹配,说明TaUCE2具有半胱氨酸催化位点和结合酶的活性,属于泛素结合蛋白家族成员(图2)。
通过在线软件TMHMM对TaUCE2蛋白跨膜结构域进行预测,发现TaUCE2蛋白无跨膜结构。该蛋白的等电点为7.69,相对分子量为1656 kD,不稳定系数为43.09,属于不稳定蛋白。
将目前已报道的不同物种的UCE2蛋白与预测的小麦UCE2蛋白进行比对发现,其与山羊草序列相同,与二穗短柄草和水稻仅有3个氨基酸的不同,相似度达到97.3%。不同植物间的UCE2蛋白的氨基酸序列相似度高达97%,说明该蛋白具有较高的保守性。另外,第7、91、144位置的氨基酸在单子叶植物中是Q、D和R,而在双子叶植株中分别为L、E和K(图2箭头所示),表明该3个位点的氨基酸是单双子叶植物所特异的。
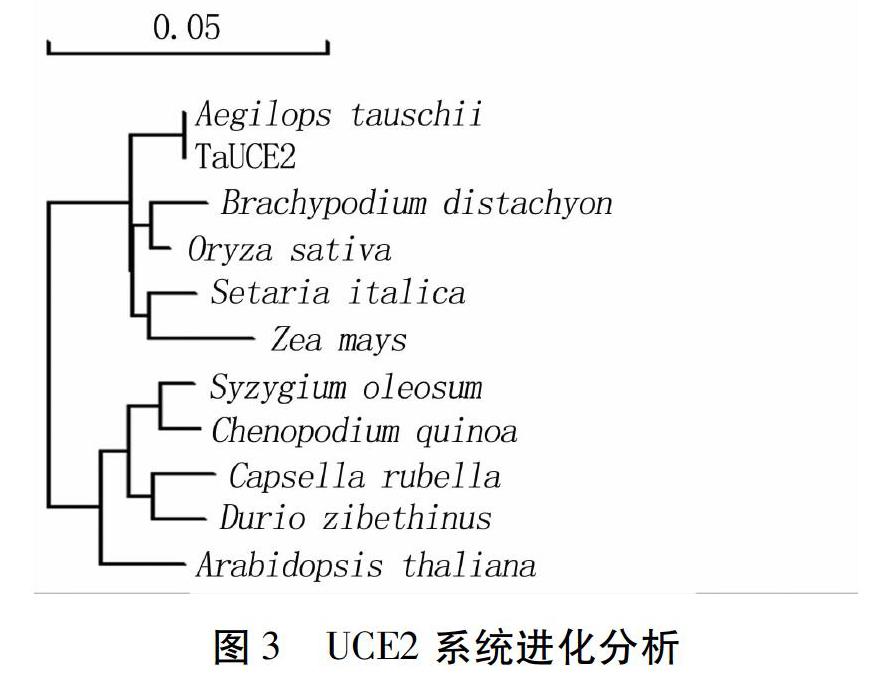
系统进化分析发现,单子叶植物和双子叶植物各自聚为一类(图3),表明该蛋白在单双子叶植物进化后期才进行的分化。
2.2 TaUCE2基因在非生物胁迫下应答分析
TaUCE2基因的轉录表达受ABA、干旱、盐和低温的影响(图4)。受四种胁迫的影响,TaUCE2基因在根中的表达量均下降,其中在ABA和干旱胁迫下,该基因在根中的表达趋势一致,均为在胁迫后6 h内表达量持续下降,从6 h到12 h有小幅上升,但从12 h之后又开始下降直至24 h时最低,之后又有小幅上升。在盐和低温胁迫下,该基因在根中的表达是在3 h内降低,从3 h到12 h有小幅上升,从12 h之后又开始降低直至24 h降到最低,之后又有小幅上升。最终,该基因在根中的表达量与未处理相比是降低的。
在四种胁迫下,该基因在叶和茎部的表达不同于在根中的表达,除低温胁迫下的叶片,该基因在叶和茎部的表达量在处理3 h内,与未处理相比均增高。在处理24 h时,该基因的表达量与未处理相比降低到整个处理时间段的最低。在低温处理下,叶中该基因在处理3 h时表达量降低,这可能与该基因在低温响应中的代谢方式有关。以上结果表明,TaUCE2基因受干旱、ABA、盐、低温的诱导。
3 讨论与结论
本研究对根据耐旱小麦转录组测序结果中发现的在干旱胁迫下表达量显著下调的基因(TRIAE_CS42_3DL_TGACV1_252817_AA0892160)进行了克隆、序列比对,发现该基因为泛素结合酶(E2)基因(TaUCE2)。泛素结合酶(E2)的特征为包含一个由150个左右的氨基酸残基形成的UBC结构域,这个区域中有一个保守的半胱氨酸残基可与被ATP激活的 Ub蛋白共价结合形成硫酯键[15]。利用DNAMAN软件对该序列进行翻译,发现其编码147个氨基酸,包含一个典型的UBC结构域。蛋白酶活性位点位于74~89位,且第85位为半胱氨酸,序列比对发现其与其他物种的泛素结合酶对应的序列完全匹配,说明TaUCE2具有半胱氨酸催化位点和结合酶的活性,属于泛素结合蛋白家族成员。
蛋白序列分析发现TaUCE2蛋白与山羊草UCE2蛋白序列完全一致,与其他物种蛋白序列之间的相似度也达到97%,说明该蛋白序列具有较高的保守性,另外发现在该蛋白的第7、91、144位置处的氨基酸在单双子叶植物之间是特异的。进化分析发现单双子叶植物各聚為一类,说明该蛋白的分化是发生在单双子叶分化形成之后。
泛素结合酶作为植物泛素/蛋白酶体系统的主要成分,在植物的生长发育、信号转导、蛋白运输以及生物或非生物胁迫应答中均起到了重要作用。张雅文等[16]发现大豆E3泛素连接酶基因GmAIRP1通过提高抗氧化酶活性以及积累渗透调节增强植物的抗旱与抗盐能力。棉花的E3泛素连接酶基因GhRING1-like通过调控ABA而调控植物的抗旱能力[17];水茄E2泛素结合酶基因StUBCc与黄萎病菌有关;拥有泛素连接酶活性的拟南芥AtPUB18基因参与非生物胁迫[18]。为了进一步确定该基因与逆境胁迫的关系,利用荧光实时定量PCR(qRT-PCR)的方法,分析了TaUCE2在非生物胁迫处理下的动态表达,发现TaUCE2基因在干旱、ABA、盐、低温胁迫下表达量均发生了变化,特别是在根中,该基因在四种胁迫下一直处于下调表达状态,表明TaUCE2能够参与逆境胁迫响应,可能在提高小麦抗逆性中发挥重要作用。
参 考 文 献:
[1] 张祥云,赵思语,温潇,等. 小麦TaUBC基因泛素结合酶活性分析[J].聊城大学学报(自然科学版), 2018, 31(3):82-88.
[2] Yu F F, Xie Q. Non-26S proteasome endomembrane trafficking pathways in ABA signaling[J]. Trends in Plant Science, 2017, 22:976-985.
[3] Vierstra R D. The ubiquitin-26S proteasome system at the nexus of plant biology[J]. Nature Reviews Molecular Cell Biology, 2019, 10(6):385-397.
[4] Bachmair A, Novatchkova M, Potuschak T, et al. Ubiquitylation in plants: a post-genomic look at a post-translational modification[J]. Trends in Plant Science, 2001, 6(10):463-470.
[5] Huang L, Kinnucan E, Wang G,et al. Structure of an E6AP-Ubc H7 complex:insights into ubiquitination by the E2-E3 enzyme cascade[J]. Science, 1999, 286(5443):1321-1326.
[6] Lei L, Bandola-Simon J, Roche P A. Ubiquitin-conjugating enzyme E2 D1 (Ube2D1) mediates lysine-independent ubiquitination of the E3 ubiquitin ligase March-I[J]. Journal of Biological Chemistry, 2018, 293(11): 3904-3912.
[7] Wang D G, Tian YX, Wei, D, et al. DNA damage-induced foci of E2 ubiquitin-conjugating enzyme are detectable upon co-transfection with an interacting E3 ubiquitin ligase[J]. Biochemical Genetics, 2016, 54(2):147-157.
[8] Ibarra R, Sandoval D, Fredrickson E K, et al. The San1 ubiquitin ligase functions preferentially with ubiquitin-conjugating enzyme Ubc1 during protein quality control[J]. Journal of Biological Chemistry, 2016, 291(36): 18778-18790.
[9] Van Wijk S J L, Timmers H T M. The family of ubiquitin-conjugating enzymes (E2s): deciding between life and death of proteins[J]. The FASEB Journal, 2010, 24(4): 981-993.
[10] Nguyen L, Plafker K S, Starnes A, et al. The ubiquitin-conjugating enzyme, UbcM2, is restricted to monoubiquitylation by a two-fold mechanism that involves backside residues of E2 and Lys48 of ubiquitin[J]. Biochemistry, 2014, 53(24): 4004-4014.
[11] Gu X, Jiang D, Wang Y, et al. Repression of the floral transition via histone H2B monoubiquitination[J]. The Plant Journal, 2009, 57(3): 522-533.
[12] Xu L, Ménard R, Berr A, et al. The E2 ubiquitin-conjugating enzymes, AtUBC1 and AtUBC2, play redundant roles and are involved in activation of FLC expression and repression of flowering in Arabidopsis thaliana[J]. The Plant Journal, 2009, 57(2): 279-288.
[13] Wang S, Cao L, Wang H. Arabidopsis ubiquitin-conjugating enzyme UBC22 is required for female gametophyte development and likely involved in Lys11-linked ubiquitination[J]. Journal of Experimental Botany, 2016, 67(11): 3277-3288.
[14] 尹麗娟, 陈阳, 刘沛, 等. 小麦泛素结合酶TaE2的表达分析及蛋白互作[J].植物遗传资源学报, 2014, 15(1): 144-152.
[15] Ye Y, Rape M. Building ubiquitin chains: E2 enzymes at work[J]. Nature Reviews Molecular Cell Biology, 2009, 10(11): 755.
[16] 张雅文, 沈祥娟, 张静, 等. 大豆E3泛素连接酶基因GmAIRP1的同源克隆及在烟草中的功能鉴定[J].植物遗传资源学报,2019, 20(4):1011-1019.
[17] 夏朝阳,安晓晖,张中起,等. 棉花E3泛素连接酶基因GhRING1-like的克隆及功能分析[J].南京农业大学学报,2019, 42(1): 39-50.
[18] 刘炎霖,陈钰辉,刘富中,等. 水茄泛素结合酶E2基因StUBCc的克隆及黄萎病菌诱导表达分析[J].园艺学报,2015, 42(6): 1185-1194.

