蒲公英对NaCl单盐和海水复合盐胁迫的生理响应
付娆 张海洋 梁晓艳 顾寅钰 邢延富 宋延静 李萌 李茹霞 王向誉 郭洪恩
摘要:为开发更多的耐盐(海水)蔬菜新品种,本研究以兼具食用和药用价值的野生蔬菜蒲公英为材料,以200 mmol/L NaCl为单盐胁迫处理,以等Na+含量的海水(盐浓度16 g/L)为复合盐胁迫处理,研究不同时间(0、3、6 h和12 h)盐胁迫下超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,膜脂过氧化产物丙二醛(MDA)含量及渗透调节物质可溶性蛋白含量的变化。结果表明:与0 h相比,盐胁迫处理3 h和6 h时,蒲公英叶片中的三种抗氧化酶(SOD、POD和CAT)活性、MDA及可溶性蛋白含量迅速增加(P<0.05),12 h时三种酶活性与盐胁迫3 h或6 h相比有所降低,但仍显著高于0 h时;海水复合盐胁迫下蒲公英叶片SOD、POD和CAT活性的增加及MDA和渗透调节物质的积累,相较于NaCl单盐胁迫有所提高,但多数差异不显著(P>0.05)。综上所述,受到盐胁迫时,蒲公英快速启动细胞内的保护酶系统,细胞膜透性和可溶性蛋白含量增加,使细胞维持较低的渗透势,以抵抗逆境胁迫,但植株受到较高浓度盐胁迫一段时间后,体内积累了大量活性氧,其活性氧清除酶活性降低,植株生长受到显著抑制。
关键词:蒲公英;NaCl胁迫;海水复合盐胁迫;生理响应
中图分类号:S647 文献标识号:A 文章编号:1001-4942(2020)02-0033-05
Abstract In order to develop more new species of salt (seawater) tolerant vegetables,the wild dandelion with both edible and medicinal values was used as the experimental material. Two treatments were set as single salt stress (200 mmol/L NaCl) and compound salt stress (seawater with 16 g/L of salinity with equal Na+ concentration. The activities of superoxide dismutase (SOD),peroxidase (POD) and catalase (CAT),and the contents of malondialdehyde (MDA) and soluble protein under salt stress were determined after treated for 3,6 and 12 hours respectively. The results showed that the activities of SOD,POD and CAT and the contents of MDA and soluble protein increased rapidly under salt stress after 3 hours and 6 hours compared with no stress. Nevertheless,the activity of the three antioxidant enzymes decreased after 12 hours compared with that after 3 hours and 6 hours under salt stress,but they were still higher than that of no stress. The compound salt (seawater) stress increased the activity of antioxidant enzymes and the accumulation of MDA and soluble protein compared with single salt (NaCl) stress,but most differences were not significant. In summary,when subjected to salt stress,the protective enzyme system in dandelion was rapidly activated,and the cell membrane permeability and soluble protein content increased,in order to maintain lower osmotic potential of cells to resist salt stress. However,a large amount of reactive oxygen species could accumulated in the plants after a period of high concentration salt stress,and the activity of reactive oxygen scavenging enzymes decreased, so the plant growth was significantly inhibited.
Keywords Taraxacum mongolicum Hand.-Mazz.; NaCl stress; Seawater compound salt stress; Physiological response
由于海水含鹽量高,培育的蔬菜不易发生病虫害,不用施加化学农药,因此,海水蔬菜是世界上公认的绿色有机食品。海水蔬菜除含有普通蔬菜的营养成分外,其胡萝卜素、微量元素及钠的含量等均高于普通蔬菜,同时因其含碱成分高,还可调节人体内的酸碱平衡[1]。但作为一种新兴产业,海水蔬菜发展在我国还处于起步阶段。目前耐海水蔬菜品种仍很稀少,能用100%海水灌溉的蔬菜品种,主要有西洋海笋、海茴香、黑枸杞等品种[2]。大力发展海水蔬菜产业首要而关键的环节是,加强滨海地区抗盐耐海水植物种质资源的筛选与培育,或驯化现有蔬菜作物,提高其经济价值和耐盐属性,使其逐步达到完全耐海水灌溉的程度。
鹽胁迫可诱导植物气孔关闭,限制CO2固定,增加超氧阴离子自由基(O·—2)、过氧化氢(H2O2)、羟自由基(·OH)和单态氧(1O2)等活性氧(reactive oxygen species,ROS)的大量积累生成[3,4],此时植物会启动细胞内的保护酶系统,及时清除体内由于氧化胁迫产生的大量自由基来维持正常的代谢[5,6]。超氧化物歧化酶(superoxide dismutase,SOD)是植物抗氧化酶系统的第一道防线,通过催化歧化反应使活性氧生成H2O2和O2,清除细胞中过量的超氧化物阴离子,消除其毒性[7-9]。过氧化物酶(peroxide,POD)能联合超氧化物歧化酶、过氧化氢酶清除过剩的自由基,使体内自由基维持在正常的动态水平[10]。过氧化氢酶(catalase,CAT)主要存在于植物过氧化物酶体和乙醛酸循环体中,亦是去除H2O2的主要酶之一,主要清除光呼吸过程中产生的H2O2[11]。高盐胁迫下,植物体内活性氧的增加导致细胞膜脂过氧化,丙二醛(MDA)是盐胁迫下膜脂过氧化的主要产物,其含量代表细胞膜损伤程度和植物对胁迫的耐受性[9]。
蒲公英集食用和药用价值于一身,作为蔬菜食用具有丰富的营养价值[12];作为一种传统的中药材,具有利尿、清热解毒、消肿散结等功效[13]。鉴于上述原因,我们选择蒲公英作为开发耐海水蔬菜的一个种质资源,通过分析其盐胁迫下植株的抗氧化酶活性、膜脂过氧化产物及渗透调节物质含量高低的变化动态,增进对蒲公英盐胁迫适应机制的了解,为评价其盐分耐受性提供参考。
1 材料与方法
1.1 幼苗培养及盐胁迫处理
本试验于2018年春采用盆栽法进行。蒲公英(Taraxacum mongolicum Hand.-Mazz.)幼苗长至4片真叶时,选取长势基本一致的幼苗移栽于装有蛭石的塑料花盆(高15 cm,口径20 cm)中,每盆3株。设置200 mmol/L的NaCl溶液和等Na+含量的海水(盐浓度16 g/L)为盐胁迫处理条件。其中天然海水取自烟台近海,盐浓度为33.33 g/L。对照组浇灌蒸馏水,试验组一浇灌200 mmol/L NaCl,试验组二浇灌盐度16 g/L海水,均设置3个生物学重复。盐胁迫后0、3、6 h和12 h取样,每处理选取长势一致3个植株相同叶位的叶片。
1.2 生理生化指标测定
酶液制取:取叶片0.5 g剪碎放入冰浴的研钵中,加入提样缓冲液3 mL研磨成匀浆,后于12 000 r/min下离心10 min,其上清液即为粗酶制剂[14]。
超氧化物歧化酶(SOD)活性测定采用氯化硝基四氮唑蓝(NBT)光化还原法[15];过氧化物酶(POD)活性测定采用愈创木酚法[16];过氧化氢酶(CAT)活性测定采用紫外吸收法[17];丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[18];可溶性蛋白含量测定采用考马斯亮蓝比色法[15]。
1.3 数据处理与分析
用Microsoft Excel 2007和SPSS 13.0软件对试验数据进行整理和显著性分析,用SigmaPlot 12.5软件绘制图。
2 结果与分析
2.1 盐胁迫对蒲公英叶片抗氧化酶活性的影响
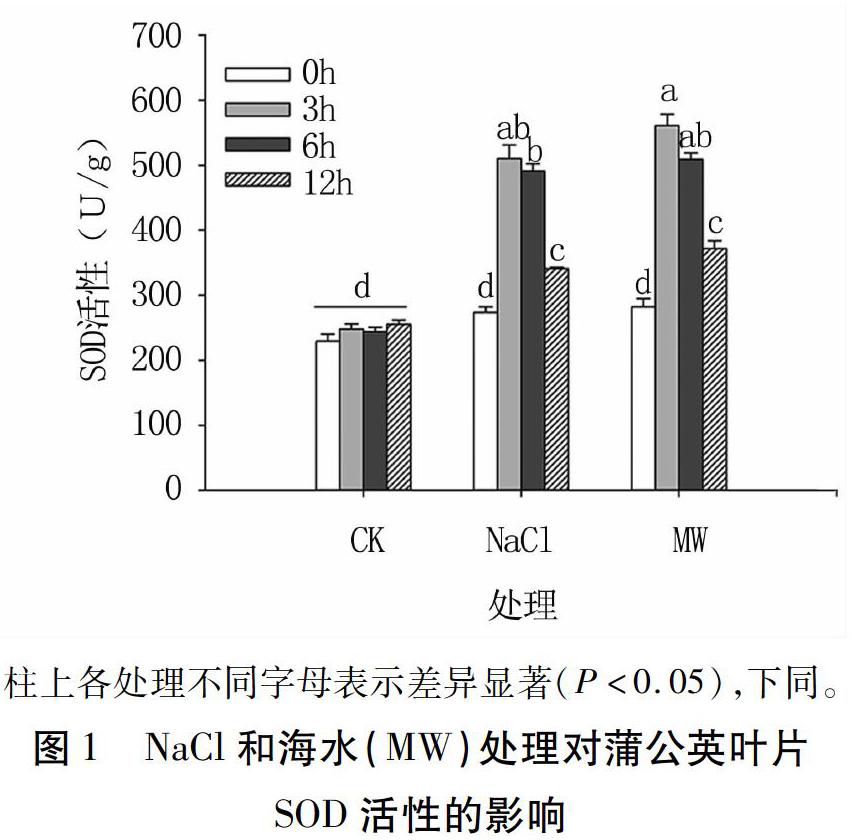
SOD是植物体内清除活性氧自由基的关键酶,其活性的强弱与植物抗氧化能力密切相关。对照组蒲公英叶片SOD活性无显著变化(P>0.05),两种类型盐胁迫处理后,叶片SOD活性升高(图1)。NaCl处理3、6、12 h,SOD活性分别为510.51、490.99、340.95 U/g,相比0 h(273.85 U/g)分别升高86.42%、79.29%和24.50%(P<0.05)。海水处理3、6、12 h,SOD活性分别为560.81、509.25、372.14 U/g,相比0 h(282.66 U/g)分别升高98.40%、80.16%和31.66%(P<0.05)。
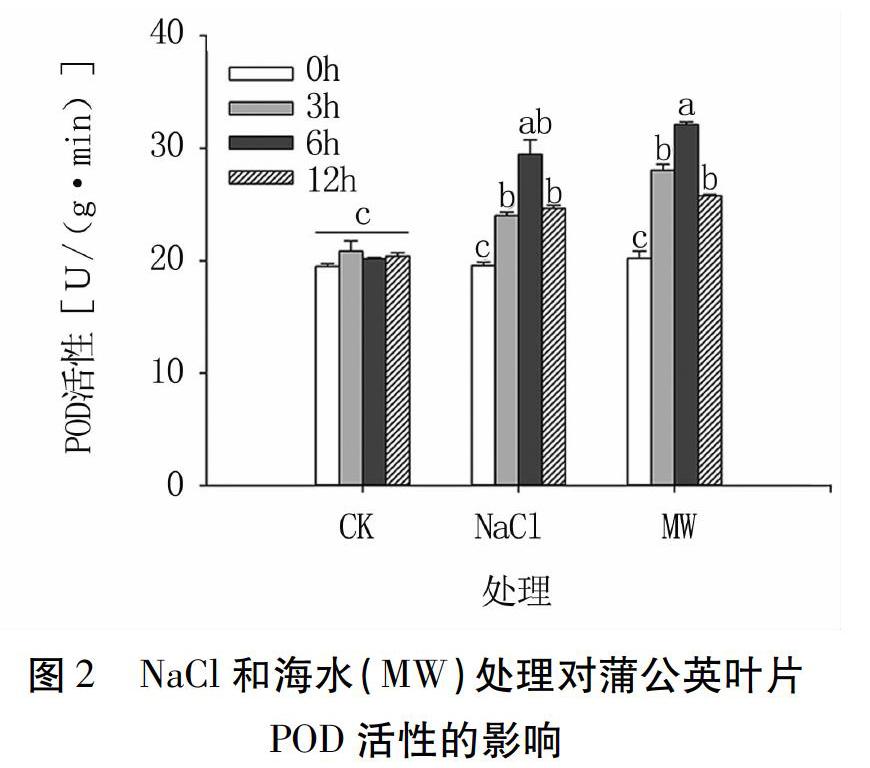
POD可催化H2O2转化为活性较低的H2O,从而使植物体免受过氧化伤害,这对细胞维持正常的新陈代谢活动具有重要作用。对照组蒲公英叶片POD活性无显著变化(P>0.05),两种类型盐协迫处理后,叶片POD活性升高(图2)。NaCl处理3、6、12 h,POD活性分别为24.00、29.47、24.64 U/(g·min),相比0 h[19.58 U/(g·min)]分别升高22.57%、50.51%和25.84%(P<0.05)。海水处理3、6、12 h,POD活性分别为28.06、32.11、25.81 U/(g·min),相比0 h[20.22 U/(g·min)]分别升高38.77%、58.80%和27.65%(P<0.05)。
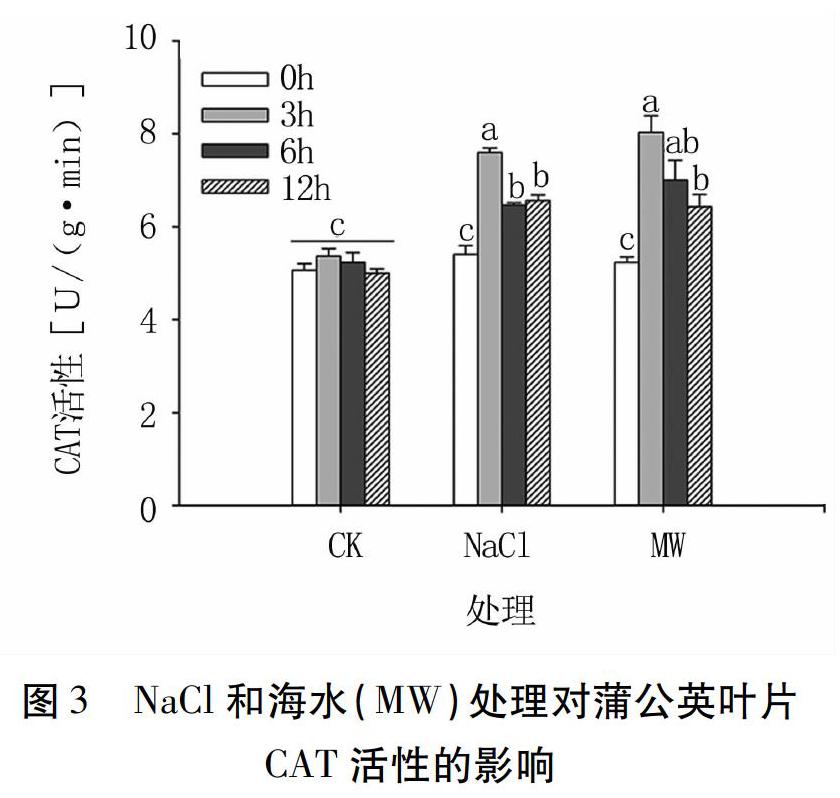
CAT对H2O2具有较高的亲和力,可清除线粒体电子传递和脂肪酸氧化过程中产生的H2O2,故CAT在维持H2O2的动态平衡中具有重要作用。对照组蒲公英叶片CAT活性无显著变化(P>0.05),两种类型盐胁迫处理后,叶片CAT活性升高(图3)。NaCl处理3、6、12 h,CAT活性分别为7.60、6.47、6.57 U/(g·min),相比0 h[5.40 U/(g·min)]分别升高40.74%、19.81%和21.67%(P<0.05)。海水处理3、6、12 h,CAT活性分别为8.03、7.00、6.43 U/(g·min),相比0 h[5.23 U/(g·min)]分别升高53.54%、33.84%和22.94%(P<0.05)。
2.2 盐胁迫对蒲公英叶片丙二醛和可溶性蛋白含量的影响
丙二醛(MDA)是膜脂过氧化作用的主要产物之一,可间接反映细胞膜的受损程度和植物对盐胁迫的耐受性。对照组蒲公英叶片MDA含量无显著变化(P>0.05),两种类型盐胁迫处理后,叶片MDA含量升高(图4)。NaCl处理3、6、12 h,MDA含量分别为6.46、7.40、6.36 μmol/g,相比0 h(5.08 μmol/g)分别升高27.17%、45.67%和25.20%(P<0.05)。海水处理3、6、12 h,MDA含量分别为7.42、6.42、6.25 μmol/g,相比0 h(5.40 μmol/g)分别升高37.41%、18.89%和15.74%(P<0.05)。
可溶性蛋白是植物体内重要的渗透调节物质,盐胁迫下其含量的增加有利于维持细胞正常代谢。对照组蒲公英叶片可溶性蛋白含量无显著变化(P>0.05),两种类型盐肋迫处理后,叶片可溶性蛋白含量升高(图5)。NaCl处理3、6、12 h,可溶性蛋白含量分别为14.40、17.31、17.73 mg/g,相比0 h(12.37 mg/g)分别升高16.41%、39.94%和43.33%(P<0.05)。海水处理3、6和12 h,可溶性蛋白含量分别为16.07、18.32、17.50 mg/g,相比0 h(12.57 mg/g)分别升高27.84%、45.74%和39.22%(P<0.05)。
3 讨论与结论
在抗氧化系统中,各种抗氧化酶活性、还原物质及抗氧化物质含量的高低,可反映出植物对活性氧的清除能力或抗氧化能力[19]。正常条件下,POD、CAT和SOD耦联,能彻底清除体内活性氧自由基,保护膜系统,维持体内活性氧代谢平衡。本研究中,用200 mmol/L NaCl和等Na+含量的海水(盐浓度16 g/L)处理,蒲公英叶片中的三种酶活性迅速增加,盐胁迫3 h或6 h时,叶片SOD、POD和CAT活性达到较高水平,显著高于0 h,而盐胁迫12 h时,三种酶活性与盐胁迫3 h或6 h相比又有所降低。这说明在受到盐胁迫时,蒲公英植株快速启动了细胞内的保护酶系统,从而及时清除体内氧化胁迫产生的大量自由基来维持正常代谢,但植株受到较高浓度盐胁迫一段时间后,体内积累了大量活性氧,继而抑制活性氧清除酶活性,POD、CAT与SOD的协同耦联作用下降,活性氧的产生与清除失去平衡,保护酶活性下降,生长受到显著抑制。
植物细胞在盐胁迫下产生大量活性氧,导致膜蛋白和脂质氧化损伤,膜脂过氧化产生大量的丙二醛。因此,MDA含量代表膜损伤程度和植物对胁迫的耐受性[20]。本研究中两种类型盐胁迫处理,蒲公英叶片中的MDA含量迅速增加,说明高盐胁迫下蒲公英的细胞膜结构受到损伤,细胞内外的稳定性遭到破坏,造成植物细胞内的电解质渗漏增强。植物体内的渗透调节物质(如可溶性蛋白、可溶性糖、脯氨酸等)在逆境胁迫条件下迅速积累[21],植物体则通过增加渗透调节物质含量帮助维持细胞较低的渗透势,同时增强植物的耐脱水能力、制约离子吸收、保护生物膜及细胞结构,防止活性氧对膜脂及膜蛋白的伤害,抵抗逆境胁迫[22]。本研究结果显示,盐胁迫处理后,蒲公英叶片可溶性蛋白含量迅速提高,随处理时间延长,与短时间处理相比有所下降,但与0 h相比仍为增加趋势,这有利于维持细胞较低的渗透势。蒲公英叶片中可溶性蛋白含量的显著升高,表明盐胁迫下蒲公英叶片某些蛋白基因的表达增强,促进蛋白合成或者诱导合成新的蛋白,从而维持细胞内较低的渗透势,缓解盐胁迫伤害。
目前关于盐胁迫对植物种子萌发及幼苗影响的研究多以NaCl单盐胁迫为主,而在耐海水蔬菜新品种选育中需考虑海水的综合含盐状况,因海水除含有较高浓度的Na+和Cl-,还含有一定浓度的SO2-4、Mg2+、K+、Ca2+等。相比单盐,复合盐中高盐度和高碱度对种子萌发影响具有协同效应,其抑制作用明显大于单盐与单碱[23]。本試验研究表明,海水胁迫下蒲公英叶片的SOD、POD和CAT活性的增加,丙二醛和可溶性蛋白的积累,相较于NaCl单盐胁迫有所提高,但多数差异不显著(P>0.05)。本研究结果证实了盐胁迫下蒲公英抗氧化酶活性的增加及膜脂过氧化产物和渗透调节物质的积累,但尚未对变化机理进行相关研究,后续需开展相关试验。
参 考 文 献:
[1] 王海军. 江苏海盐产区海水蔬菜产业化发展前景[J]. 苏盐科技,2006(3):19-20.
[2] 韩立民,王金环. 我国海水蔬菜种植发展面临的问题及对策分析[J]. 浙江海洋学院学报(自然科学版),2015,34(3):276-281.
[3] Gunes A,Inal A,Alpaslan M,et al. Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize (Zea mays L.) grown under salinity[J]. Journal of Plant Physiology, 2007,164(6):728-736.
[4] Murata N,Takahashi S,Nishiyama Y,et al. Photoinhibition of photosystemⅡunder environmental stress[J]. Biochimica et Biophysica Acta,2007,1767(6):414-421.
[5] Deinlein U,Stephan A B,Horie T,et al. Plant salt-tolerance mechanisms[J]. Trends in Plant Science,2014,19(6):371-379.
[6] Muchate N S,Nikalje G C,Rajurkar N S,et al. Plant salt stress: adaptive responses, tolerance mechanism and bioengineering for salt tolerance[J]. The Botanical Review,2016,82(4):371-406.
[7] 夏民旋,王维,袁瑞,等. 超氧化物歧化酶与植物抗逆性[J]. 分子植物育种,2015,13(11):2633-2646.
[8] Wang M C,Zhao X,Xiao Z,et al. A wheat superoxide dismutase gene TaSOD2 enhances salt resistance through modulating redox homeostasis by promoting NADPH oxidase activity[J]. Plant Molecular Biology,2016,91(1/2):115-130.
[9] Liang W J,Ma X L,Wan P,et al. Plant salt-tolerance mechanism:a review[J]. Biochemical and Biophysical Research Communications,2018,495(1):286-291.
[10] 王蕾,覃和業,徐微风,等. 海水胁迫对白子菜生长及生理特性的影响[J]. 江苏农业科学,2017,45(24):103-108.
[11] Willekens H,Langebartels C,Tiré C,et al. Differential expression of catalase genes in Nicotiana plumbaginifolia(L.)[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(22):10450-10454.
[12] 陈华,李银心. 耐海水蔬菜新成员——蒲公英[J]. 植物杂志,2003(6):9-10.
[13] 赵磊,杨延杰,林多. 蒲公英的经济价值[J]. 辽宁农业科学,2006(6):33-35.
[14] 王爱国,罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990(6):55-57.
[15] 孔祥生,易现峰. 植物生理学实验技术[M]. 北京:中国农业出版社,2008:259-261.
[16] 朱广廉等. 植物生理学实验[M]. 北京:北京大学出版社,1990.
[17] 王学奎,黄见良. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2015.
[18] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:210-219.
[19] 张腾国,李巧丽,刁志宏,等. 盐及干旱胁迫对油菜抗氧化系统和RbohC、RbohF基因表达的影响[J]. 应用生态学报,2019,30(3):969-978.
[20] Ma X L,Cui W N,Liang W J,et al. Wheat TaSP gene improves salt tolerance in transgenic Arabidopsis thaliana[J]. Plant Physiology and Biochemistry,2015, 97:187-195.
[21] 周莹,赵永娟,黄丽瑾,等. 荆芥幼苗对盐胁迫的生理响应[J]. 核农学报,2019,33(1):166-175.
[22] 张怀山,赵桂琴,栗孟飞,等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报,2014,23(2):180-188.
[23] 袁飞敏,权有娟,陈志国. 不同钠盐胁迫对藜麦种子萌发的影响[J]. 干旱区资源与环境,2018,32(11):182-187.

