miRNA-374对缺血再灌注损伤的保护作用
赵征 李迎春 刘飞

摘要 目的 探讨miRNA-374对心肌缺血再灌注损伤是否存在保护作用。方法 取SD新生大鼠,分离心肌组织细胞培养,随机分为空白组(Blank)、阴性对照组(NC)(转染miRNA-374阴性对照序列),miRNA-374模拟组(转染miRNA-374模拟基因),miRNA-374抑制剂组(转染 miRNA-374抑制剂)、siRNA-DTNA组(转染siRNA-DTNA)和miRNA-374抑制剂siRNA-DTNA组(转染miRNA-374抑制剂和siRNA-DTNA)。分别观察各组心肌细胞超氧化物歧化酶(SOD)、丙二醛(MDA)和乳酸脱氢酶(LDH)的水平,并检测各组心肌细胞增殖及凋亡情况。结果 ①过表达miRNA-374和DTNA会使AKT、Hes1、bcl2表达上升,使Notch1、DTNA、BAX、HIF-1α表达下降;②上调miRNA-374、下调DTNA能保护心肌细胞、促进心肌细胞增殖、改变心肌细胞的细胞周期、抑制心肌细胞凋亡。结论 miRNA-374通过介导DTNA下调,并阻断Notch1通路,从而保护心肌细胞免受缺血再灌注的损伤。
关键词 miRNA-374;DTNA;心肌缺血再灌注损伤
中图分类号 R743.3 文献标识码 A 文章编号 1671-0223(2020)10-033-06
PROTECTIVE EFFECT OF MIRNA-374 ON ISCHEMIA-REPERFUSION INJURY Zhao Zheng,Li Yingchun,Liu Fei.Cangzhou Central Hospital,Cangzhou 061001,China
Abstract Objective To explore the protective effect of miRNA-374 on myocardial ischemia-reperfusion injury.Methods SD neonatal rats were divided into blank group, negative control group (NC) (transfection of miRNA-374 negative control sequence),miRNA-374 simulation group (transfection of miRNA-374 analog gene) and miRNA-374 inhibitor group (transfection of miRNA-374 inhibitor).siRNA-DNA group (transfected siRNA-DINA) and miRNA-374 inhibitor siRNA-DNA group (transfection of miRNA-374 inhibitors and siRNA-DTNA).The levels of superoxide dismutase (SOD),malondialdehyde (MDA) and lactate dehydrogenase (LDH) in cardiac myocytes were observed.Results ①Overexpression of miRNA-374 and DTNA increased the expression of AKT,Hes1,bcl2, and decreased the expression of Notch1,DTNA,Bax,HIF-1α.②Upregulation of miRNA-374,down-regulation of DTNA can protect cardiomyocytes,promote cardiomyocyte appreciation,change the cell cycle of cardiomyocytes,and inhibit cardiomyocyte apoptosis.Conclusion miRNA-374 protects the cardiomyocytes from ischemia-reperfusion injury by mediating the down-regulation of DINA and blocking the Notch1 pathway.
Key words miRNA-374;DTNA;Myocardial ischemia-reperfusion injury
心肌缺血再灌注損伤是指在心肌缺血一段时间后恢复组织血流灌注从而造成的组织损伤,通常会引起细胞死亡,导致梗死面积的扩大,诱发心衰,并增加患者的死亡率[1-2]。合并ST段抬高的急性心肌梗死患者更容易经历再灌注损伤[3],对于再灌注损伤最有效的治疗是及时的冠脉溶栓治疗以及经皮冠状动脉介入治疗。目前对于心肌缺血再灌注损伤发生的原因尚不完全明了,可能与氧自由基、炎症反应、细胞凋亡、钙超载等原因有关[4]。微小RNA(miRNA)属于一个具有大约21个核苷酸短长度的非编码RNA家族。有序列研究证明包括心脏纤维化、心肌肥大、心肌梗死、心力衰竭以及血管生成在内的心血管疾病发病机制均涉及 miRNA。本研究亦通过miRNA-374感染心肌细胞,并通过一系列实验来探究miRNA-374对心肌细胞缺血再灌注损伤的作用。
1 材料与方法
1.1 细胞培养和转染
从广东省医学实验动物中心购买了SPF雄性大鼠(这项研究是严格按照美国国立卫生研究院“保护和使用实验动物指南”中的建议进行的。该协议得到了沧州市中心医院动物保护与利用机构委员会批准)。处死后用眼科剪将大鼠心肌组织切成1mm3大小的组织块,然后用D-Hanks液冲洗。去除上清液后加入含有0.15%胶原酶的低糖DMEM。随后,将组织块放到无菌离心管,在37℃的恒温电磁搅拌器上放置30分钟,99克,并转速离心5分钟,收集沉淀物,然后悬浮在含20%胎牛血清(FBS)的低糖DMEM中,99克,再次离心5分钟。去除上清液,用D-Hanks液冲洗后,用0.25%胰蛋白酶(含0.02EDTA) 在37℃下作用7~9分钟。加入含20%FBS的培养基,209克,离心5分钟后收集沉淀,再悬浮于含20%FBS的DMEM后接种于新的培养皿中。将细胞悬液放置于含5%CO2的培养箱中37℃下连续培养,每隔2、3天换一次培养基。
1.2 实验分组
取指数生长的细胞,进行分组实验。分为空白组(Blank)、阴性对照组(NC)(转染miRNA-374阴性对照序列),miRNA-374模拟组(转染miRNA-374模拟基因),miRNA-374抑制剂组(转染 miRNA-374抑制剂)、siRNA-DTNA组(转染siRNA-DTNA)和miR-374抑制剂siRNA-DTNA组(转染miRNA-374抑制剂和siRNA-DTNA)。
1.3 试验方法
将对数生长心肌细胞种植在六孔板中。当细胞密度达到30%~50%时,按脂质2000(Invitrogen,Carlsbad,CA)的说明转染。分别取各实验组细100 pmol,用250μL无血清Opti-mem培养基(Gibco,Grand Island,NY)稀释后在室温下孵育5分钟。同时将250μL无血清Opti-MEM培养基与5μL Lipofectamine2000混合,室温孵育5分钟。将两种制剂混合,室温孵育20分钟后将细胞种植到培养孔中,37℃下孵育6~8小时。最后,换成全培养基培养24~48小时后可收获细胞。
1.4 大鼠心肌细胞超氧化物歧化酶、丙二醛和乳酸脱氢酶的检测
收集转染大鼠心肌细胞,置于冷冻离心机3221克离心15分钟,用Eppendorf管收集部分上清液保存于?20℃环境。根据检测试剂盒(中国上海Mlbio有限公司)的使用方法分别测定上清液中超氧化物歧化酶(SOD)、丙二醛(MDA)和乳酸脱氢酶(LDH)的含量。SOD浓度用黄嘌呤氧化酶法测定,而MDA的浓度则用其与硫代巴比妥钠反应的红色产物的OD值间接测定。
1.5 大鼠心肌细胞增值能力的检测
转染后细胞汇合率达80%时,用磷酸缓冲盐溶液(PBS)洗涤细胞,0.25%胰蛋白酶处理后产生单个细胞悬液。然后对细胞进行计数并以3×103- 6×103/孔的密度接种于96孔板。培养24、48和72小时后,将培养基换成10%的噻唑蓝(MTT)溶液培养4小时。然后去掉上清液,加入100μL二甲基亚砜,在摇床上震荡孵育10分钟。测量每个孔在490 nm波长处的OD值。每个实验都是重复3次,以时间为横坐标,OD值为纵坐标绘制细胞活力曲线。
1.6 流式实验测细胞周期和凋亡
将细胞培养48小时后用0.25%胰蛋白酶消化并收集,将细胞密度调节为1×106个/mL。随后,取1毫升的细胞悬液以453克离心10分钟收集细胞,然后重新悬浮在2mLPBS中离心,用70%预冷乙醇溶液在4℃下固定。第二天对固定细胞进行清洗。 用PBS清洗2次,过滤100μL细胞悬浮液(含有至少106m/L细胞)。随后,将单细胞悬浮液与1mL碘化丙啶(PI)(50mg/mL)混合后在黑暗中孵育30分钟。用流式细胞仪在488 nm处测定细胞周期。
用V-FITC/PI双染法检测细胞凋亡。收集细胞的方法与细胞周期检测方法相同。然后添加了V-FITC(10μL)和PI(5μL)。 将细胞在黑暗中孵育15分钟后加入300μL结合缓冲液后,用流式细胞仪在488 nm处检测到细胞凋亡。
1.7 统计学方法
采用SPSS21.0统计软件进行统计分析。计量资料以“均数±标准差”表示,两组间均数比较采用t检验,多组间均数比较采用方差分析方法,两两比较采用方差分析方法。P<0.05为差异有统计学意义。
2 结果
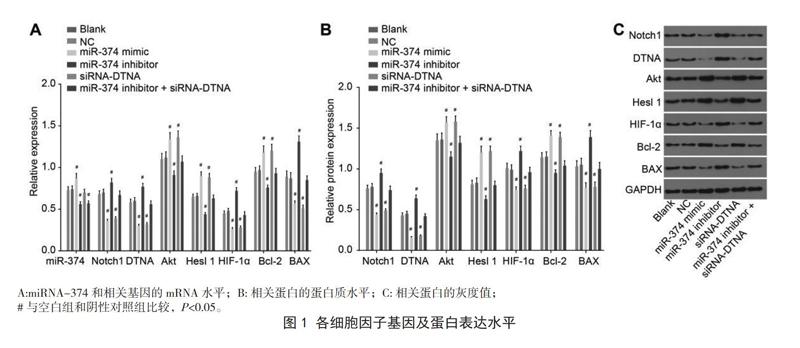
2.1 各组miRNA-374、相关基因的mRNA及蛋白水平比较
转染结束后通過RT-PCR和Western来分析比较各组miRNA374的表达情况,以及AKT、Hes1、bcl、Notch1、DTNA、BAX、HIF-1α的细胞因子的基因和蛋白表达水平,见图1。两两比较结果显示,各指标空白组和阴性对照组之间差异无统计学意义(P>0.05);miRNA374模拟组的AKT、Hes1、bcl2、表达水平高于空白组和阴性对照组(P<0.05),Notch1、DTNA、BAX、HIF-1α表达水平低于空白组和阴性对照组(P<0.05);与阴性对照组比较,miRNA-374的表达水平在miRNA模拟组和siRNA-DTNA组均明显升高,两组中AKT、Hes1、bcl2表达均上升,Notch1、DTNA、BAX、HIF-1α表达均下降,但两组之间差异无统计学意义(P>0.05)。miRNA-374抑制剂组中的AKT、Hes1、bcl2表达下降,而Notch1、DTNA、BAX、HIF-1α表达上升(P<0.05)。
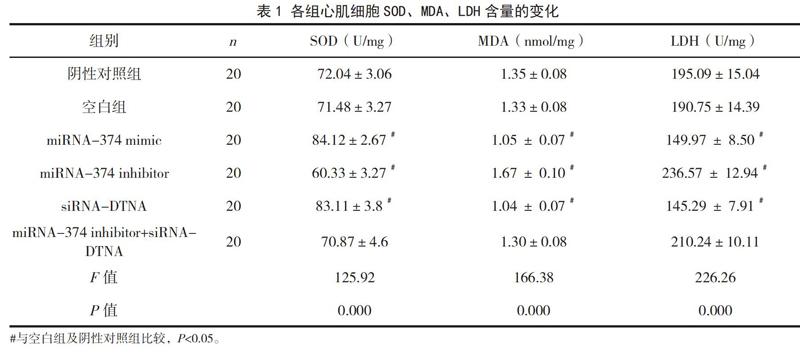
2.2 各组心肌细胞SOD、MDA、LDH含量比较
提取并比较各组心肌组织中SOD、MDA、LDH的表达水平。两两比较结果显示,与空白组和阴性对照组相比,过表达miRNA374会导致SOD水平明显上升和MDA、LDH明显下降;下调表达DTNA会导致SOD水平明显下降和MDA、LDH明显上升;SOD、MDA、LDH的水平在miRNA-374抑制剂siRNA-DTNA组无明显改变;这证明上调miRNA374、下调DTNA能保护心肌细胞,见表1。
2.3 各组细胞增殖能力的比较
经过处理后的各组细胞被接种于96孔板,于相应时间后收集并计数。通过MTT实验与0、24、48、72小时观察细胞增殖情况。各组细胞的增殖情况在24小时无明显差异,在48、72小时开始出现差异(P<0.05)。空白组和阴性对照组之间各个时间段细胞殖情况差异均无统计学意义,siRNA374模拟组和siRNA-DTNA组心肌细胞增殖能力增强;而siRNA374抑制剂组细胞增殖能力下降;miR-374抑制剂+siRNA-DTNA组细胞的增殖能力无明显变化(P>0.05)。这证实过表达miR-374、抑制DTNA能增强心肌细胞增殖能力,见图2。
2.4 各组细胞周期分布
通过PI染色来观察细胞周期分布。miR-374抑制剂组与空白组和阴性对照组之间细胞周期分布差异无统计学意义(P<0.05),见图3。
2.5 各组细胞凋亡比较
各组心肌细胞的凋亡率检测结果,见图4。空白组、阴性对照组、miRNA-374组、siRNA-DTNA组、miRNA-374抑制剂组、和miRNA-374抑制剂siRNA-DTNA组的凋亡率分别为:(34.18±2.78)%,(31.18±2.44)%,(20.36±
1.74)%,(18.37±2.21)%,(45.59±3.43)%,(32.19±2.20)%。凋亡率在空白组和NC组差异无统计学意义(P>0.05);与空白组比较,miRNA-374组和siRNA-DTNA组的凋亡率明显下降(P<0.05);miRNA-374抑制剂组的凋亡率比空白组明显增加(P<0.05);miRNA-374抑制剂siRNA-DTNA组的凋亡率与空白组差异无统计学意义(P>0.05)。表明上调miRNA374、下调DTNA能抑制心肌细胞凋亡。
3 讨论
心肌缺血再灌注损伤是一个动态的过程,缺血器官损伤和炎症介导再灌注损伤的分期不同,但相互关联[5]。心肌缺血再灌注损伤对心脏术后早期心功能的损害存在一定影响 [6]. 此外,心肌缺血再灌注损伤与炎症、内皮功能障碍、凋亡和坏死密切相关[7-8]。现如今对于恶性心血管疾病的处理措施不仅仅是恢复心脏的血供,而且要同时预防由于缺血-再灌注带来的心肌损伤。
随着对 Micro RNA越来越多的研究,其在心脏保护方面的作用逐渐被发现。先前的研究表明,miRNA-21通过Akt和Bcl-2/Bax途径对心脏缺血再灌注损伤起到保护作用[9] .本研究中我们通过miRNA-374感染心肌细胞,并通过一系列实验来探究miRNA-374对心肌细胞缺血再灌注损伤的作用。NOTCH 1是Notch家族的成员之一,在许多癌症中调节细胞的生长、凋亡、迁移和侵袭[10]。先前的研究表明[11-12],NOTCH信号可以被上调的miRNA-34a所抑制。另有研究发现褪黑素[13]可以通过降低Bax的表达从而抑制心肌细胞凋亡。Cao等[14]证实了在H9C2细胞系中上调野生型DTNA可以抑制心房利钠因子(ANF)和脑利钠肽(BNP)的转录,表明DTNA通过作用于 ANF和BNP进而保护心肌细胞的功能。DTNA是miRNA-374的目标蛋白,过表达miRNA-374会使DTNA表达下调,同时阻断Notch1通路。培养正常心肌细胞,过表达miRNA-374,心肌细胞活性增强,凋亡和坏死减少,处于细胞周期S阶段的心肌细胞数量增加。本实验证实,miRNA-374会介导DTNA下調,并阻断Notch1通路,上调miR-374和下调DTNA可增加Akt、Hes1和bcl-2的表达,而减少Notch 1、bax和HIF-1α的表达,从而保护心肌细胞免受缺血再灌注的损伤。此结论与之前所发布的报告结论一致[15]。
综上所述,我们的研究表明,miRNA-374下调DTNA,阻断Notch 1轴,进一步保护大鼠心肌缺血再灌注损伤。本研究为心肌缺血再灌注损伤的治疗提供了新的思路。然而,还需要进一步研究miRNA-374影响心肌I/R损伤的具体机制。
4 参考文献
[1] Arslan F,Smeets MB,ONeill LA,et al.Myocardial ischemia/reperfusion injury is mediated by leukocytic toll-like receptor-2 and reduced by systemic administration of a novel anti-toll-like receptor-2 antibody[J].Circulation, 2010,121(1):80-90.
[2] Yang Y,Duan W,Jin Z,et al.JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J].Journal of Pineal Research,2013,55(3):275-286.
[3] Hausenloy DJ,Yellon DM.Myocardial ischemia-reperfusion injury:A neglected therapeutic target[J].The Journal of Clinical Investigation,2013,123(1):92-100.
[4] 邓海英,赖为国.心肌缺血再灌注损伤的机制研究进展[J].中国医药指南,2013,1(1):63-64.
[5] Zhai Y,Busuttil RW,Kupiec-Weglinski JW.Liver ischemia and reperfusion injury: New insights into mechanisms of innate-adaptive immune-mediated tissue inflammation[J].American Journal of Transplantation,2011,11(8):1563-1569.
[6] Raedschelders K,Ansley DM,Chen DD.The cellular and molecular origin of reactive oxygen species generation during myocardial ischemia and reperfusion[J].Pharmacology & Therapeutics,2012,133(2):230-255.
[7] Maehata Y,Miyagawa S,Sawa Y.Activated protein C has a protective effect against myocardial I/R injury by improvement of endothelial function and activation of AKT1[J].PLoS One,2012,7(8):e38738.
[8] Ran X,Diao JX,Sun XG,et al.Huangzhi oral liquid prevents arrhythmias by upregulating caspase-3 and apoptosis network proteins in myocardial ischemia‐ reperfusion injury in rats[J].Evidence-Based Complementary and Alternative Medicine,2015:518926.
[9] Ma N,Bai J,Zhang W,et al.Trimetazidine protects against cardiac ischemia/reperfusion injury via effects on cardiac miRNA21 expression, Akt and the Bcl2/Bax pathway[J].Molecular Medicine Reports,2016,14(5):4216-4222.
[10] Huang X,Ma J,Xu J,et al.Simvastatin induces growth inhibition and apoptosis in HepG2 and Huh7 hepatocellular carcinoma cells via upregulation of Notch1 expression[J].Molecular Medicine Reports,2015,11(3):2334-2340.
[11] Li XJ,Ji MH,Zhong SL,et al.MicroRNA-34a modulates chemosensitivity of breast cancer cells to adriamycin by targeting Notch1[J].Archives of Medical Research,2012,43(7):514-521.
[12] Pang RT,Leung CO,Ye TM,et al.MicroRNA-34a suppresses invasion through downregulation of Notch1 and Jagged1 in cervical carcinoma and choriocarcinoma cells[J].Carcinogenesis,2010,31(6):1037-1044.
[13] Yu L,Liang H,Lu Z,et al.Membrane receptor‐dependent Notch1/Hes1 activation by melatonin protects against myocardial ischemia-reperfusion injury: In vivo and in vitro studies[J].Journal of Pineal Research,2015,59(4):420-433.
[14] Cao Q,Shen Y,Liu X,et al.Phenotype and functional analyses in a transgenic mouse model of left ventricular noncompaction caused by a DTNA mutation[J]. International Heart Journal,2017,58(6):939-947.
[15] Yu L, Li F,Zhao G,et al.Protective effect of berberine against myocardial ischemia reperfusion injury: Role of Notch1/Hes1‐PTEN/Akt signaling[J].Apoptosis,2015,20(6):796-810.
[2020-4-27收稿]
作者單位:061001 河北省沧州市中心医院

