利福平诱导小鼠肝脏炎性损伤中相关因子的动态变化
张咪 吴冬雪 王雪 朱晗瑀 杨璐铭 王林 裴盛斐 冯福民


摘要 目的 初步探讨利福平诱导小鼠肝损伤过程中,炎症因子及相关指标的变化情况。方法 48只昆明小鼠随机分为基线组和利福平组,灌胃3、5、7、10、15天后处死。酶联免疫吸附(ELISA)法检测血清中丙二醛(MDA)、超氧化物歧化酶(SOD)含量。RT-PCR和ELISA法检测肝组织中核因子κB(NF-κB)和肿瘤坏死因子-α(TNF-α)的mRNA及蛋白表达水平。结果 肝组织病理学及MDA、SOD水平变化,提示肝脏损伤进展。与基线组相比,利福平组NF-κB或TNF-α的mRNA及蛋白表达水平均在第7天和第10天出现显著升高(P<0.05)。结论 利福平可能通过激活NF-κB信号通路诱导小鼠肝脏发生炎性损伤。
关键词 抗结核药物;肝损伤;NF-κB;小鼠
中图分类号 R575 文献标识码 A 文章编号 1671-0223(2020)10-030-03
DYNAMIC CHANGES OF RELATED FACTORS IN RIFAMPICIN-INDUCED LIVER INFLAMMATORY INJURY IN MICE Zhang Mi,Wu Dongxue,Wang Xue,et al. School of Public Health, North China University of Science and Technology, Tangshan 063210, China
Abstract Objective To explore the changes of NF-κB and TNF-α in liver injury induced by rifampicin in mice.Methods Forty-eight Kunming mice were randomly divided into the baseline group and the rifampicin group, and were sacrificed after gavage for 3d, 5d, 7d, 10d and 15d.The levels of MDA and SOD in serum were detected by ELISA.RT-PCR and ELISA were used to detect mRNA and protein expression levels of NF-κB and TNF-α in liver tissues.Results Changes in liver histopathology and MDA and SOD levels suggested the progression of liver injury.Compared with the baseline group,the mRNA and protein expression levels of NF-κB or TNF-α in the rifampicin group were significantly increased on the 7th and 10th days(P<0.05). Conclusion Rifampicin may activate the NF-κB pathway during liver injury in mice.
Key words Antituberculosis drugs; Liver injury; NF-κB; Mice
據中国疾病预防控制中心统计,2017年我国肺结核发病数为835193人,死亡人数为2831人。近年来,结核发病率在我国乃至全球范围内呈现急剧增加的趋势,死亡率居各传染病之首[1]。结核病患者在接受抗结核药物治疗时可出现多种不良反应,极易出现抗结核药物性肝损伤(Antituberculosis liver injury,ADLI)[2]。其中,利福平是利福霉素类半合成抗生素,在治疗结核疾病方面具有廉价、高效的优点,并且与异烟肼等其他抗结核一线药物相比,具有特殊的药物作用途径。虽然ADLI是多因子介导的疾病,其发生机制尚不明确。但有研究发现,氧化应激可显著影响ADLI的发生[3]。抗结核治疗期间会产生大量可与肝酶或膜受体结合致细胞代谢和功能紊乱的活性氧(ROS)[4]。核因子-κB(NF-κB)是被证实可由ROS激活的真核细胞转录因子,ROS和NF-κB通过相互激活表现出正反馈效应[5-7]。也有研究表明,在乙醇引起的肝损伤中,肝细胞内NF-κB活性显著增加,与肝损伤程度呈高度正相关[8]。但NF-κB与利福平所致肝损伤之间的关系仍需要进一步研究。
1 材料与方法
1.1 试验动物及处理[9]
在中国阜康生物技术有限公司购买48只SPF级昆明小鼠[动物许可证号:SCXK(北京)2009-0004],雌雄各半。分别于灌胃给予药物利福平前一天及给药后3、5、7、10、15天各随机处死8只,剂量按照临床成人正常用药剂量的9倍计算所得,135mg/Kg.d。随后进行病理学及血清丙二醛(MDA)、超氧化物歧化酶(SOD)水平和肝组织中NF-κB和肿瘤坏死因子-α(TNF-α)的mRNA以及蛋白含量检测。实验获得了动物伦理委员会的批准(批准号:14-016)。
1.2 检测指标
1.2.1 组织病理学改变[9]
取小鼠肝组织,福尔马林固定,脱水包埋、切片、染色。镜下观察染色结果。
1.2.2 检测小鼠血清MDA、SOD水平
酶联免疫吸附(ELISA)试剂盒(购于南京建成生物工程研究所)检测血清MDA、SOD水平。
1.2.3 检测肝组织中NF-κB和TNF-α的mRNA表达水平。
TRIzol法提取总核糖核酸(RNA),逆转录和RT-PCR使用试剂盒(购于Invitrogen公司),RT-PCR条件为94℃ 30s,63℃ 30s,72℃ 30s,35个循环。
1.2.4 检测肝组织中NF-κB和TNF-α蛋白含量
肝组织和盐水按照1∶4制成匀浆,离心并收集上清液。ELISA试剂盒检测基线组和利福平组小鼠肝组织中NF-κB和TNF-α蛋白含量。
1.3 统计学分析
采用SPSS23.0软件系统分析数据,计量资料以“均数±标准差”的形式表示,组间均数比较采用方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 肝組织病理改变
基线组肝细胞无明显形态变化(图1-D)。利福平组给药后3天开始表现出明显的形态学变化,肝细胞肿胀,炎性细胞增多,胞质空泡化,核皱缩,到15天损伤程度最为严重(图1-R3d~R15d)。
2.2 小鼠血清MDA、SOD水平
利福平给药后第5天MDA和SOD指标出现变化,其中MDA随着给药时间的延长,呈上升趋势,而SOD呈下降趋势,组间比较差异有统计学意义(P<0.05),见图2。
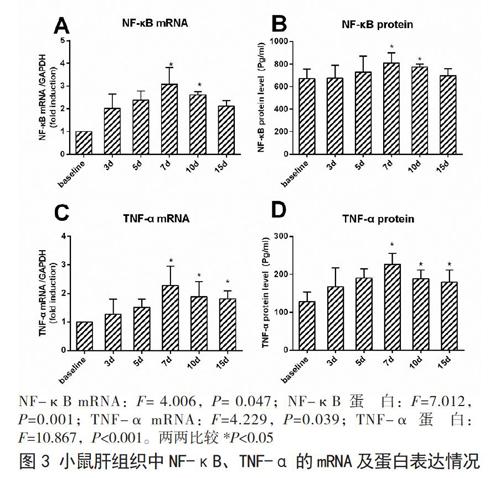
2.3 小鼠肝组织NF-κB和TNF-α的mRNA及蛋白表达
利福平给药后小鼠肝组织NF-κB和TNF-α的mRNA及蛋白表达呈现先升高后略降低趋势,均以给药后的第7天最高,组间比较差异有统计学意义(P<0.05),见图3。
3 讨论
NF-κB作为重要的炎症因子,在静息状态下,细胞胞质中NF-κB因与IκB结合而处于非活性状态[10-11]。当细胞受到氧化应激刺激时,氧化应激可导致IκB降解并与NF-κB分离[12]。活化的NF-κB易位入核与炎症介质靶基因启动子区域的κB位点结合,导致炎症介质基因的过表达[13-14]。在本研究中,与基线组比较NF-κB的基因表达水平随着用药时间的延长发生了显著的变化,提示NF-κB通路被激活。TNF-a作为肿瘤坏死因子,在炎症发生时,变化是最显著的,又因为TNF-a是NF-KB的下游炎症因子,因此,本研究也对TNF-a进行了动态监测,进一步测量了TNF-α的mRNA及蛋白表达,发现NF-κB和TNF-α的mRNA及蛋白的表达趋势一致。这些结果说明,在抗结核药物利福平诱导的小鼠肝脏损伤过程中,可能由NF-κB通路及下游炎症因子TNF-α共同介导,但具体机制尚不清楚。此外,我们发现利福平组中NF-κB的表达水平先升高后略有下降。前期研究发现用利福平处理的人单核细胞和小鼠均可抑制NF-κB的活化[15-16],可能原因是利福平到达一定浓度可抑制NF-κB活化并减少促炎因子的产生。另外,SOD、MDA不仅代表了肝脏损伤进展,也是氧化应激的指标,但是否是氧化应激作用导致NF-κB和TNF-α的mRNA及蛋白水平变化,两者之间的因果联系有待进一步研究。
总之,本研究结果表明,NF-κB通路在利福平诱导的小鼠肝脏损伤过程中被激活,但具体机制尚未明确,本课题组将继续在体内、体外研究深入探讨抗结核药物造成的肝脏炎性损伤,以期为抗结核药物性肝损伤的预防和保肝治疗提供实验基础。
4 参考文献
[1] 王书杰,王沛,李晓天,等.药物性肝损伤的代谢、遗传学机制[J].中国药理学通报,2016,32 (7):898-902.
[2] 赵红,范颖,谢雯.抗结核药物所致肝损伤临床研究进展[J].现代医药卫生,2018,34(13) :1953-1955.
[3] Li S,Tan HY,Wang N,et al.The role of oxidative stress and antioxidants in liver diseases[J]. Int J Mol Sci,2015,16:26087-26124.
[4] Gupta SC,Sundaram C,Reuter S,et al.Inhibiting NF-kappaB activation by small molecules as a therapeutic strategy[J].Biochim Biophys Acta,2010,1799:775-787.
[5] Morgan MJ,Liu ZG.Crosstalk of reactive oxygen species and NF-kappaB signaling[J].Cell Res,2011,21:103-115.
[6] Bakkar N,Guttridge DC.NF-kappaB signaling:A tale of two pathways in skeletal myogenesis[J].Physiol Rev,2010,90:495-511.
[7] Liu B,Sun L,Liu Q,et al.A cytoplasmic NF-kappaB interacting long noncoding RNA blocks IkappaB phosphorylation and suppresses breast cancer metastasis[J].Cancer Cell,2015,27:370-381.
[8] Wang M,Shen G,Xu L,et al.IL-1 receptor like1protects against alcoholic liver injury by limiting NF-kappaB activation in hepatic macrophages[J].J Hepatol,2017.
[9] 张刚,陈磊,陈静,等.不同剂量利福平致小鼠肝损伤特点的研究[J].局解手术学杂志,2017,26(4):244-247.
[10] Rao P,Hayden MS,Long M,et al.Ikappa bbeta acts to inhibit and activate gene expression during the inflammatory response[J].Nature,2010,466:1115-1119.
[11] Chen S,Maini R,Bai X,et al.Incorporation of phosphorylated tyrosine into proteins: In vitro translation and study of phosphorylated ikappaB-alpha and its interaction with NF-kappaB[J].J Am Chem Soc,2017,139:14098-14108.
[12] Zuo T,Zhu M,Xu W,et al.Iridoids with genipin stem nucleus inhibit lipopolysaccharide-induced inflammation and oxidative stress by blocking the NF-kappaB pathway in polycystic ovary syndrome[J].Cell Physiol Biochem,2017,43:1855-1865.
[13] Kastl L,Sauer SW,Ruppert T,et al.TNF-alpha mediates mitochondrial uncoupling and enhances ROS-dependent cell migration via NF-kappaB activation in liver cells[J].FEBS Lett. 2014,588: 175-183.
[14] Lian YH,Fang J,Zhou HD,et al.Sufentanil preconditioning protects against hepatic ischemia-reperfusion injury by suppressing inflammation[J].Med Sci Monit,2019,25: 2265-2273.
[15] Manca C,Koo MS,Peixoto B,et al.Host targeted activity of pyrazinamide in Mycobacterium tuberculosis infection[J].PLoS One,2013,8:e74082.
[16] Sakala IG,Eickhoff CS,Blazevic A,et al.Dipterinyl calcium pentahydrate inhibits intracellular mycobacterial growth in human monocytes via the C-C chemokine MIP-1beta and nitric oxide[J]. Infect Immun,2013,81:1974-1983.
[2020-01-15收稿]
作者單位:063210 河北省唐山市,华北理工大学公共卫生学院(张咪、吴冬雪、王雪、朱晗瑀、杨璐铭、王林、裴盛斐、冯福民);生命科学学院(冯福民)
*通讯作者

