丙戊酸对食管癌细胞增殖凋亡的影响及其抗肿瘤活性机制的研究
杨鲸蓉 柳亚明 张锦灿 曾志勇


[摘要]目的 探索丙戊酸(VPA)对食管癌细胞增殖凋亡的影响以及Bcl-2蛋白、Caspase蛋白表达及信号转导通路的分子机制。方法 将食管癌ECa-109细胞株培养于PRMI1640培养液,按照溶剂对照和溶度梯度分组:空白对照及VPA 0.25 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、4.0 mmol/L。根据不同的药物浓度处理细胞24、48、72 h后,观察食管癌ECa-109细胞的变化,运用不同的检测方法检测食管癌ECa-109细胞的细胞活力、细胞凋亡及周期的变化;Western Blot检测CyclinD1、p21、Survivin、Bcl-2和Caspase蛋白及PI3K/Akt和MAPK信号转导通路的变化。结果 VPA可有效影响ECa-109细胞的活力、增殖和分化,能够通过诱导细胞周期阻滞使细胞产生凋亡。Western Blot实验结果显示,VPA可以影响ECa-109细胞中Bcl-2、Survivin以及Caspase蛋白的表達;VPA可明显降低ECa-109细胞中CyclinD1蛋白表达水平,同时增加p21蛋白的表达,使其能够影响信号通路PI3K/Akt和MAPK途径中AKT、MAPK等关键蛋白的磷酸化。结论 VPA能够影响食管癌细胞的增殖凋亡,并具有浓度依赖性;能够通过影响多种蛋白激酶途径中的信号通路、生存蛋白的表达以及PI3K/Akt和MAPK信号通路的表达而影响食管癌细胞的生长。
[关键词]组蛋白去乙酰化酶;组蛋白去乙酰化酶抑制剂;食管癌;ECa-109细胞;丙戊酸;Bcl-2;Caspase3;Akt
[中图分类号] R966 [文献标识码] A [文章编号] 1674-4721(2020)5(c)-0004-06
Effect of Valproic Acid on proliferation and apoptosis of esophageal cancer cells and study on its antitumor activity mechanism
YANG Jing-rong1 LIU Ya-ming1 ZHANG Jin-can2 ZENG Zhi-yong1
1. Department of Cardiothoracic Surgery, the 900th Hospital of the Joint Support Force (the Former Fuzhou General Hospital of Nanjing Military Region), Fujian Province, Fuzhou 350025, China; 2. Fuzong Clinical College of Fujian Medical University, Fujian Province, Fuzhou 350025, China
[Abstract] Objective To explore the effect of Valproic Acid (VPA) on proliferation and apoptosis of esophageal cancer cells, and expression of Bcl-2, Caspase protein, as well as molecular mechanisms of signal transduction pathways. Methods ECa-109 cell line of esophageal cancer was cultured with PRMI1640 medium, and grouped according to solvent control and solubility gradient: blank control and VPA 0.25 mmol/L, 0.5 mmol/L, 1.0 mmol/L, 2.0 mmol/L, 4.0 mmol/L. After treating cells for 24, 48 and 72 hours according to different drug concentrations, the changes of esophageal cancer ECa-109 cells were observed, and different detection methods were used to detect the changes of cell viability, apoptosis and cycle of esophageal cancer ECa-109 cells. Western Blot was used to detect CyclinD1, p21, Survivin, Bcl-2, Caspase protein and PI3K/Akt and MAPK signal transduction pathway changes. Results VPA showed different extent changes on vitality, proliferation, differentiation of ECa-109 cells, could induce cell apoptosis by inducing cell cycle arrest. Western Blot experiment results showed that VPA could affect the expression of Bcl-2, Survivin and Caspase proteins in ECa-109 cells. VPA could significantly reduce the expression level of CyclinD1 protein in ECa-109 cells and increase the expression of p21 protein, which influenced the phosphorylation of key proteins such as AKT and MAPK in the signaling pathway PI3K/Akt and MAPK pathway. Conclusion VPA has an effect on the proliferation and apoptosis of esophageal cancer cells and it is concentration-dependent, which can affect the growth of esophageal cancer cells through the signaling pathways of multiple protein kinase pathways, the expression of survival proteins, the expression of PI3K/Akt and MAPK signaling pathways.
1.2.5 Western Blot检测 VPA可促进食管癌细胞凋亡来抑制食管癌细胞的生长。为了进一步探究VPA诱导的食管癌细胞凋亡的潜在的分子机制,选用Western Blot检测CyclinD1、p21、Survivin、Bcl-2家族和Caspase蛋白、C-PARP及PI3K/Akt和MAPK信号因子;在浓度为0.5 mmol/L VPA处理0、24、48 h后,经过RIPA裂解、蛋白的提取、蛋白溶度的测定、蛋白电泳、转膜、封闭后进行抗体孵育及显影。加入配置好的一抗室温下孵育2 h,TBST洗涤干净后,再加入辣根过氧化物酶标记的二抗,室温下孵育1 h,然后将多余的抗体弃去,加入显影液使其覆盖膜表面,最后进行显影。
1.3统计学方法
采用SPSS 15.0统计软件进行统计学处理,实时定量RT-PCR实验重复3次,每次做3个重复孔,计量资料用均数±标准差(x±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1 MTT检测不同VPA浓度处理对细胞生长的抑制作用
VPA能够抑制ECa-109细胞活力,且抑制作用具有浓度依赖性,随着浓度的增高,抑制效果明显增强,而且其IC50值为0.5 mmol/L,此浓度将作为后续试验VPA的浓度;进一步分析得出,相同时间及浓度下,药物作用时间越长,抑制率越高,生存能力越低。不同浓度VPA两两比较,差异有统计学意义(P<0.05)。VPA对细胞的增殖抑制作用随其浓度的增加而增强,用浓度为0.5 mmol/L的VPA分别作用于细胞24、48、72 h后,发现其对细胞生长均有明显的抑制作用,抑制率分别为(31.20±0.21)、(54.30±0.23)、(57.40±0.33)%,与空白对照组比较,差异有统计学意义(P<0.05)。不同时间下VPA对细胞的抑制率有显著影响(P<0.05)(图1)。
2.2流式细胞检测细胞凋亡及周期的变化
经VPA处理后的食管癌细胞,处于G2/M期的细胞随着浓度的增加而逐渐增多;VPA对食管癌细胞诱发凋亡有作用,0.5 mmol/L VPA在0、24和48 h时,细胞凋亡比例依次为2.6%、11.9%、17.4%,食管癌凋亡細胞的数目随着药物作用时间的延长,细胞凋亡的数目逐渐增多(图2)。
2.3 VPA对CyclinD1蛋白和p21调控蛋白表达的影响
经0.5 mmol/L VPA处理后的食管癌细胞,CyclinD1蛋白表达水平降低,而p21表达水平增高,而且随着药物作用时间的延长,具有一定的时效关系(图3~4)。
2.4 VPA对Caspase家族蛋白表达的影响
经过0.5 mmol/L VPA处理后的食管癌细胞对Caspase家族蛋白的影响主要是通过调节相应的活化蛋白C-Caspase-3、C-Caspase-8、C-PARP的表达水平,且随着药物作用时间的延长,增加了相应的活化蛋白C-Caspase-3、C-Caspase-8、C-PARP的表达水平(图5~7)。
2.5 VPA对Bcl-2家族蛋白和Survivin蛋白表达的影响
经过0.5 mmol/L VPA处理后的食管癌细胞,降低了Bcl-2家族蛋白和Survivin蛋白的表达,且随着作用时间的延长,Survivin蛋白的表达以及抗凋亡蛋白Mcl-l、Bcl-XL的表达逐渐降低(图8~10)。
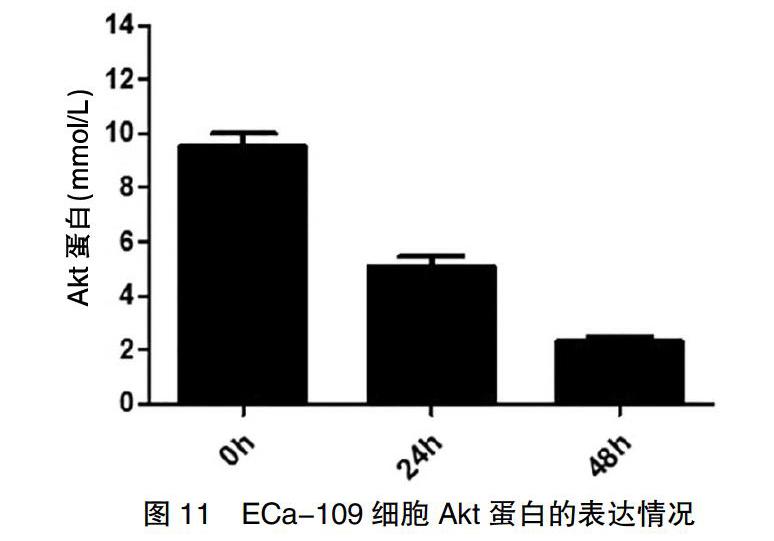
2.6 VPA对PI3K/AKT和MAPK信号通路的影响
经0.5 mmol/L VPA处理食管癌细胞后,Akt和MAPK信号因子表达水平降低,且随着作用时间的延长,Akt、MAPK的表达逐渐下降(图11~12)。
3讨论
随着临床医学研究工作的逐渐深入,越来越多的研究发现在肿瘤的发生与发展中,除了基因突变外,表观遗传调控也扮演者重要的角色[5-6]。在众多的表观遗传调控中都存在着相对应的一系列酶对其进行修饰,而在这些表观遗传调控修饰酶中,HDACS作为其中的一类存在意义重大,其参与了许多生物化学信号传导通路的去乙酰化修饰,其作用与有效干扰肿瘤发生、发展的信号传导激活密切相关,这为在临床展开研究工作和治疗肿瘤提供了新的切入点。目前,所有HDACi按照化学结构可分为4大类:以MGCD0103、MS-275等为代表的苯酰胺类;以TSA、PXD-101、SAHA等为代表的异羟肟酸类;以丁酸钠、丙戊酸等为代表的羧酸类;以Trapoxin、Aci- dipin、FK-228等为代表的环肽类。由于HDACi的抗肿瘤分子机制相对的复杂,再加上不同肿瘤类型中其抗肿瘤机制有着非常大的差别,对于各个HDACi在体内的抗肿瘤机制依然存在欠缺[7-10]。目前已有多种HDACi被批准上市,主要用于血液/淋巴系统的治疗,包括伏立诺他、罗米地辛、贝林司他、西达本胺等[4,11]。但是,由于药代动力学性质以及肿瘤特异性等原因,大多数HDACi在实体瘤治疗中的效果并不令人满意。
根据目前相关研究显示,VPA具有明显的HDACi活性,可以特异性地作用在HDACⅠ与HDACⅡ中,故具有抗肿瘤作用的效果[12]。本次研究所使用的VPA归于短链脂肪酸(SCFA)的范畴内。其优势在于患者耐受性较好且不会产生明显的副作用。本研究结果显示,VPA可影响ECa-109细胞的增殖凋亡以及抑制细胞的生长,而且具有浓度依赖性,尤其在浓度为0.05 mmol/L时即可明显抑制食管癌细胞的活力和增殖。能够通过抑制CyclinD1启动子组蛋白H4的乙酰化水平,诱导细胞G2/M期阻滞和细胞凋亡,显示出较强的抗食管癌活性。相关研究表明,在大多数的肿瘤模型当中,HDACi已经被证实可以通过影响细胞内、外信号转导途径而发挥作用[13]。死亡受体(DR)转导通路在大多数的转导途径中有与其相对应的配体,当死亡受体和其相对应的配体结合后就能够启动凋亡途径,诱导相对应的细胞凋亡。相关的研究已经证实,在乳腺癌中,MS275和SAHA能够诱导TRAIL的表达而不改变DR4和DR5水平,通过募集FADD和激活Caspase8促进肿瘤细胞的调亡[14]。另有研究表明,线粒体凋亡途径也被证实能够通过细胞内外信号转导途径而发挥作用,其受到外界应激因素的干扰破坏线粒体内蛋白质的释放,导致Caspase8、Caspase9的释放和活化,紧接着被活化的Caspase3、Caspase6、Caspase8和已被激活的Caspase8和Caspase9共同作用诱导细胞的调亡[14]。在调节细胞凋亡的过程中,细胞内的促调亡蛋白和抗调亡蛋白也发挥着非常重要的作用[15]。本研究结果显示,VPA能够通过对Caspase通路的干扰及减少Survivin蛋白的表达,下调Bcl-2家族中的抗凋亡蛋白Bcl-XL、Mcl-1等机制促进细胞的凋亡来影响食管癌细胞。相关研究表明,细胞周期抑制剂p21可以被HDACi特异性地抑制[16-17];而且,抑制HDACS可以阻断多种肿瘤生长相关信号通路,如PI3K/Akt、MAPK/Erk等[18-19]。因此,本研究通过Western Blot检测了VPA对p21表达和PI3K/Akt、MAPK/Erk这两条细胞生长依赖的生存信号通路的影响,结果显示,VPA可明显上调细胞周期抑制剂p21的表达水平以及抑制这两条信号通路中的关键蛋白Akt、MAPK的磷酸化,提示VPA抗食管癌活性不仅仅涉及简单的分子机制,还可以通过上调p21、抑制PI3K/Akt和MAPK信号通路在其中发挥重要作用。经0.5 mmol/L VPA处理食管癌细胞后,Akt和MAPK信号因子表达水平降低,且随着作用时间的延长,Akt、MAPK的表达逐渐降低。出现这一结果的原因为VPA作用癌细胞后,抑制了AKt及MAPK的激活,使其表达降低,间接影响其下游靶基因的激活,从而调节下游凋亡相关蛋白Caspase表达。
綜上所述,本研究报道的一种高活性的HDACi——VPA的抗食管癌作用及其分子机制,VPA可以影响食管癌细胞的增殖凋亡,且具有浓度依赖性;可以通过降低CyclinD1启动子组蛋白H4的乙酰化水平,抑制G2期CyclinD1的转录和表达使食管癌细胞周期停滞在G2/M期;可以通过影响蛋白酶途径和减少Survivin蛋白的表达促进细胞凋亡,并下调Bcl-2家族中的抗凋亡蛋白Bcl-XL和Mcl-1,从而激活多重信号转导途径和诱导细胞凋亡;可以通过降低CyclinD1蛋白的表达和上调细胞周期抑制剂p21表达水平,并有效抑制Akt和MAPK的磷酸化,影响PI3K/Akt和MAPK信号通路的表达而影响食管癌细胞的生长,为进一步临床用药提供了理论依据;然而,目前有关VPA在食管癌患者体内单独用药效果如何以及用药后不良反应的相关报道罕见,需要进一步的动物实验及临床研究,随着该领域研究工作的不断深入,HDACi VPA在食管癌方面的应用价值必然会不断的增强。
[参考文献]
[1]郭琼.甲基化、乙酰化修饰改变对食管癌细胞生长及相关基因表达的研究[D].乌鲁木齐:新疆医科大学,2015.
[2]王小兵.MIC1在食管鳞癌诊断和抗体靶向治疗中的意义及其作为肿瘤干细胞治疗靶点的初步研究[D].北京:北京协和医学院,2014.
[3]吴健,王晶晶,杨鲸蓉,等.组蛋白去乙酰化酶抑制剂对食管癌细胞抗肿瘤活性及其相关机制的研究进展[J].东南国防医药,2018,20(4):394-398.
[4]Wahaib K,Beggs AE,Campbell H,et al.Panobinostat:A histone deacetylase inhibitor for the treatment of relapsed or refractory multiple myeloma[J].Am J Health Syst Pharm,2016, 73(7):441-450.
[5]Conte M,Palma RD,Altucci L.HDAC inhibitors as epigenetic regulators for cancer immunotherapy[J].Int J Biochem Cell Biol,2018,98:65-74.
[6]Carolina V D A,Julia H,César C,et al.Epigenetic priming in cancer initiation[J].Trends Cancer,2018,4(6):408-417.
[7]Knipstein J,Gore L.Entinostat for treatment of solid tumors and hematologic malignancies[J].Expert Opin Investig Drugs,2011,20(10):1455-1467.
[8]Ozaki T,Wu D,Sugimoto H,D,et al.Runt-related transcription factor 2 (RUNX2) inhibits p53-dependent apoptosis through the collaboration with HDAC6 in response to DNA damage[J].Cell Death Dis,2019,4(4):e610.
[9]Lopez G,Bill KL,Bid HK,et al.HDAC8,a potential therapeutic target for the treatment of malignant peripheral nerve sheath tumors (MPNST)[J].PLoS One,2015,10(7):e133302.
[10]Saito T,Nishida K,Furumatsu T,et al.Histone deacetylase inhibitors suppress mechanical stress-induced expression of RUNX-2 and ADAMTS-5 through the inhibition of the MAPK signaling pathway in cultured human chondrocytes[J].Osteoarthritis Cartilage,2013,21(1):165-174.
[11]Yoon S,Eom GH.HDAC and HDAC inhibitor:from cancer to cardiovascular diseases[J].Chonnam Med J,2016,52(1):1-11.
[12]Yang H,Maddipoti S,Quesada A,et al.Analysis of class Ⅰ and Ⅱ histone deacetylase gene expression in human leukemia[J].Leuk Lymphoma,2015,56(12):3426-3433.
[13]Glaser KB.HDAC inhibitors:Clinical update and mechanism-based potential[J].Biochem Pharmacol,2007,74(5):659-671.
[14]Xu J,Zhou JY,Wei WZ,et al.Sp1-mediated TRAIL induction in chemosensitization[J].Cancer Res,2008,68(16):6718-6726.
[15]Fulda S.Modulation of TRAIL-induced apoptosis by HDAC inhibitors[J].Curr Cancer Drug Targets,2008,8(2):132-140.
[16]Zhou H,Cai Y,Liu D,et al.Pharmacological or transcriptional inhibition of both HDAC1 and 2 leads to cell cycle blockage and apoptosis via p21Waf1/Cip1 and p19INK4d upregulation in hepatocellular carcinoma[J].Cell Prolif,2018,51(3):e12447.
[17]Arts J,King P,Marien A,et al.JNJ-26481585,a novel "second-generation" oral histone deacetylase inhibitor,shows broad-spectrum preclinical antitumoral activity[J].Clin Cancer Res,2009,15(22):6841-6851.
[18]Witt O,Sand K,Pekrun A.Butyrate induced erythroid differentiation of human K562 cells involves inhibition of ERK and activation of p38 MAP kinase pathways[J].Blood,2000, 95(7):2391-2396.
[19]Peng Z,Guo Z,Ying W,et al.Histone deacetylase inhibitors inhibit the proliferation of gallbladder carcinoma cells by suppressing AKT/mTOR signaling[J].PLoS One,2015,10(8):e136193.
(收稿日期:2020-02-14 本文編辑:任秀兰)
[基金项目]福建省自然科学基金项目(2017J01223)
通讯作者

